- •1. Аллергические пробы in vivo и in vitro, их сущность, применение.
- •2. Анатоксины. Получение, применение. Антитоксический иммунитет
- •3. Антибактериальные препараты. Классификация. Механизмы антибактериального действия. Механизмы возникновения и распространения устойчивости.
- •Классификация, которую Козлова указала у себя в презентации:
- •3)По типу взаимодействия с микробной клеткой:
- •4)По кислотоустойчивости антимикробные препараты классифицируются на:
- •5. Бактериологический метод диагностики. Требования к выращиванию бактерий в искусственных условиях.
- •6. Бактериоскопический метод диагностики, его задачи и возможности. Методы микроскопии и их применение.
- •7. Бактериофаги. Взаимодействие фага с бактериальной клеткой. Умеренные и вирулентные бактериофаги. Лизогения.
- •8. Бактериофаги. Получение, титрование. Практическое применение в диагностике, профилактике и лечение
- •9. Вакцины Вакцинопрофилактика и вакцинотерапия
- •10. Внутривидовое типирование бактерий. Методы. Использование в практике
- •11. Врожденный иммунитет. Фагоцитоз. Показатели фагоцитоза
- •14 Грибы. Строение клетки. Классификация грибов по морфологии таллома.
- •15. Действие физических и химических факторов на микроорганизмы. Использование в практике.
- •16. Дисбиозы. Препараты для восстановления микробиоты
- •17 Иммунодиагностика (серодиагностика) инфекционных заболеваний. Принципы и диагностические критерии.
- •18. Иммунопрофилактика, иммунотерапия. Осложнения: анафилактический шок, сывороточная болезнь. Их предупреждение
- •19. Иммуноферментный анализ, иммуноблоттинг. Принципы методов, используемые реагенты и оборудование, применение.
- •20. История микробиологии. Этапы развития. Современные задачи.
- •21. Культивирование бактерий in vitro. Требования к условиям культивирования. Питательные среды, их классификация. Требования, предъявляемые к питательным средам
- •Условия культивирования бактерий:
- •Требования к питательным средам:
- •Классификация
- •Примеры сред
- •22. Методы культивирования вирусов. Вирусологический метод, основные этапы.
- •23. Методы микроскопического исследования (световая, люминесцентная, темнопольная, фазово-контрастная, электронная микроскопия)
- •24. Методы определения чувствительности бактерий к антибиотикам. Мпк (мик) и мбк. Критерии определения бактериальных изолятов как чувствительные, устойчивые, умеренно чувствительные
- •Достоинства метода
- •Недостатки метода
- •28. Механизмы формирования и распространения устойчивости к антибактериальным препаратам бактерий – возбудителей инфекционных болезней
- •29. Микробиота желудочно-кишечного тракта человека
- •30. Микробиота урогенитального тракта человека
- •31. Моноклональные антитела. Получение. Использование
- •32. Морфология микроорганизмов. Морфологические группы бактерий
- •33. Нагрузочные серологические реакции. Реакции непрямой гемагглютинации. Компоненты. Применение
- •34. Наследственность и изменчивость у бактерий. Механизмы обеспечения и передачи дочерним клеткам генетической информации. Механизмы изменчивости
- •35. Органеллы бактериальной клетки. Функциональное назначение органелл
- •Особенности клеточной стенки грамположительных бактерий
- •Особенности клеточной стенки грамотрицательных бактерий
- •5. Жгутики
- •36. Особенности биологии вирусов. Принципы классификации вирусов
- •37. Особенности противовирусного иммунитета
- •38. Отличительные черты риккетсий. Методы культивирования. Риккетсиозы, общая характеристика.
- •39. Патогенность и вирулентность бактерий. Факторы вирулентности. Генетические основы распространения факторов вирулентности среди бактерий.
- •40. Понятие о морфологических свойствах микроорганизмов. Морфологические группы бактерий.
- •41.Понятие об инфекции. 3 участника инфекционного процесса. 3 звена эпидемической цепи
- •3 Участника инфекционного процесса:
- •3 Звена эпидемической цепи:
- •42. Предмет и задачи медицинской микробиологии и иммунологии. Вклад российских ученых в развитии микробиологии и иммунологии.
- •43. Предмет и современные задачи санитарной микробиологии. Санитарно-показательные микроорганизмы. Их значение для оценки безопасности объектов окружающей среды и продуктов питания
- •44. Принципы классификации инфекционных заболеваний.
- •45. Противогрибковые препараты.
- •46. Различия в строении микроорганизмов прокариот и эукариот
- •47. Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
- •48. Реакция иммунофлюоресценции. Механизм, типы, компоненты, применение для индикации антигенов и иммунодиагностики
- •49. Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки, применение
- •51.Роль врожденного и приобретенного иммунитета в развитии инфекции
- •52. Рост и размножение бактерий в искусственных условиях. Фазы размножения
- •53. Спирохеты. Характеристика. Особенности строения. Роль в патологии человека
- •54. Стерилизация, способы, аппаратура
- •Физические:
- •Химические:
- •Механические:
- •55. Строение бактериального генома. Хромосомные и внехромосомные элементы. Подвижные элементы. Умеренные бактериофаги и их роль в изменчивости генома
- •56. Структура и функции клеточной стенки бактерий. Особенности строения клеточной стенки грамположительных и грамотрицательных бактерий.
- •57. Тинкториальные свойства бактерий. Цели и методы окраски
- •Источник: Mikrobiologia_Zverev, khoroshie_lektsii_po_mikre
- •58. Типы и механизмы питания бактерий. Классификация бактерий по используемым источникам углерода и энергии. Прототрофы и ауксотрофы
- •59. Токсины бактерий, их природа и свойства. Получение и применение экзо- и эндотоксинов.
- •60. Транспорт веществ в бактериальную клетку. Экскреция высокомолекулярных соединений из бактериальной клетки
- •Секреция продуктов жизнедеятельности бактериальной клеткой
- •61. Ферменты бактерий. Роль ферментов в патогенности бактерий Идентификация бактерий по ферментативной активности
- •62. Чистые культуры микроорганизмов. Принципы и методы выделения
- •63. Энергетический метаболизм у бактерий. Типы энергетического метаболизма. Типы дыхания.
- •64. Этапы взаимодействия вирусов с чувствительными клетками и факторы, способные их нарушить. Формы вирусной инфекции.
- •1. Аденовирусная инфекция. Характеристика возбудителей. Лабораторная диагностика.
- •4. Вирусы герпеса. Классификация, значение в патологии человека. Профилактика
- •5. Вирусы экхо и Коксаки, вызываемые ими заболевания. Лабораторная диагностика энтеровирусных инфекций.
- •Коксаки Coxsackievirus
- •Экхо есно (Enteric Cytopathic Human Orphan)
- •7. Возбудители анаэробной газовой инфекции. Характеристика. Лабораторная диагностика. Специфическая и неспецифическая профилактика. Принципы лечения
- •Характеристика возбудителей
- •C. Septicum (палочка Гона-Сакса)
- •Эпидемиология
- •Патогенез
- •Клиника
- •Иммунитет
- •Лабораторная диагностика
- •Профилактика
- •Лечение
- •8. Возбудители бруцеллеза. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •9.Возбудители брюшного тифа и паратифов. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •10. Возбудители возвратных тифов. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения
- •11. Возбудители гнойно-септических инфекций. Принципы лабораторной диагностики.
- •Возбудители гси
- •Принципы лабораторной диагностики гси, вызванных аэробными и факультативно-анаэробными бактериями
- •Лабораторная диагностика анаэробных инфекций
- •Аэробные грамположительные кокки
- •12.Возбудители гриппа. Характеристика. Лабораторная диагностика. Специфическая профилактика.
- •Характеристика
- •Вирус гриппа а
- •1.Геном.
- •2.Морфология
- •5.Методы культивирования.
- •6.Резистентность
- •Лабороторная диагностика.
- •Специфическая профилактика
- •Вирус гриппа в
- •Вирус гриппа с
- •13. Возбудители кишечного иерсиниоза и псевдотуберкулеза. Характеристика. Лабораторная диагностика. Профилактика
- •14. Возбудители коклюша и паракоклюша. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •15. Возбудители микобактериозов. Морфология, особенности строения микобактериальной клетки). Распространенность. Лабораторная диагностика
- •16. Возбудители микозов кожи и ее придатков
- •Дерматофиты
- •Возбудители разноцветного лишая и других поверхностных микозов
- •17. Возбудители орви. Общая характеристика. Принципы диагностики, профилактики и лечения.
- •18. Возбудители пищевых токсикоинфекций. Лабораторная диагностик.
- •19. Возбудители сальмонеллезных гастроэнтеритов. Характеристика возбудителей. Лабораторная диагностика. Профилактика. Принципы лечения
- •20. Возбудители пищевых токсикоинфекций. Лабораторная диагностика.
- •21. Возбудители туберкулеза. Классификация. Особенности микобактериальной клетки. Распространенность.
- •22. Возбудители хламидиозов. Характеристика. Лабораторная диагностика. Принципы лечения
- •23. Возбудители шигеллезов. Характеристика. Лабораторная диагностика. Специфическая профилактика и принципы лечения
- •24. Возбудители эшерихиозов. Характеристика. Лабораторная диагностика эшерихиозов
- •25. Возбудитель бешенства. Характеристика. Патогенез. Специфическая профилактика.
- •26. Возбудитель ботулизма. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •Источник: лекции 21 года и Коваленко
- •28. Возбудитель кампилобактериоза. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения.
- •29. Возбудитель клещевого энцефалита. Характеристика
- •30. Возбудитель кори. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •Профилактика. Для профилактики кори используют вакцины:
- •31. Возбудитель краснухи. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •32. Возбудитель Ку-лихорадки. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •33. Возбудитель паротита. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •34. Возбудитель сибирской язвы. Характеристика. Лабораторная диагностика. Специфическая профилактика Принципы лечения
- •35. Возбудитель сифилиса. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения.
- •38. Возбудитель чумы. Характеристика. Лабораторная диагностика. Специфическая профилактика Принципы лечения
- •39. Гонококки. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения
- •40. Классификация микозов по локализации инфекционного процесса
- •41. Криптококкоз. Возбудители. Лабораторная диагностика криптококкоза
- •43. Микологический метод диагностики микозов. Методы идентификации дрожжей и нитчатых грибов.
- •44. Микоплазмы. Биологические свойства, особенности строения. Роль в патологии человека. Принципы диагностики и лечения
- •Возбудители урогенитальных микоплазмозов и уреаплазмоза.
- •45. Микоплазмы. Биологические свойства, особенности строения. Роль в патологии человека. Принципы диагностики и лечения.
- •46. Общая характеристика рода Candida. Методы и критерии диагностики.
- •Основные свойства грибов рода Candida:
- •Лабораторная диагностика
- •47. Патогенные и условно-патогенные грибы. Классификация грибов по группам патогенности.
- •49 Стафилококки.Характеристика. Лабораторнаядиагностика стафилококковых инфекций. Стафилококковое носительство
- •50. Стрептококки. Характеристика. Лабораторная диагностика стрептококковых инфекций.
- •1. Назовите возбудителя гриппа.
- •2. Таксономическое положение возбудителя.
- •3. Какова морфология возбудителя?
- •4. Эпидемиология гриппа (источник инфекции, механизм, пути передачи инфекции).
- •5. Каковы основные звенья патогенеза гриппа?
- •Задача 2
- •Задача 3.
- •1. Назовите возбудителя коклюша.
- •2. Назовите факторы вирулентности возбудителя коклюша.
- •3. Эпидемиология коклюша (источник инфекции, механизм, пути передачи инфекции).
- •4. Какие периоды болезни выделяют и какие методы диагностики будут эффективны в каждом? Периоды болезни.
- •5. Профилактика коклюша
- •Задача 4.
- •Задача 5.
- •1. Назовите возбудителя сифилиса. К какой морфологической группе относится возбудитель сифилиса?
- •2. Как называется первичный аффект при сифилисе и место его локализации.
- •3. Опишите морфологические, тинкториальные и культуральные свойства возбудителя сифилиса.
- •4. Эпидемиология сифилиса: источник инфекции, механизм и пути передачи инфекции.
- •Задача 6.
- •Задача 7.
- •1. Кто из обследованных сотрудников хирургического отделения является носителем патогенного стафилококка?
- •2. По каким признакам проводится идентификация s.Aureus?
- •3. С какой целью проводилось фаготипирование s.Aureus?
- •4. Кто из обследованных лиц мог быть источником послеоперационных осложнений у больных?
- •5. Какие меры необходимо срочно принять для прекращения распространения данной внутрибольничной инфекции?
- •Задача 8.
- •Задача 9.
- •1. Какой микроорганизм чаще всего вызывает данное заболевание?
- •3. Основной метод диагностики гси? Какой материал может использоваться для исследования?
- •4. Какие препараты помимо антибиотиков можно применять для специфической терапии?
- •5. Какие другие заболевания еще может вызывать данный возбудитель: специфические и неспецифические?
- •Задача 10.
- •Задача 11.
- •Задача 12.
- •1. Назовите возбудителя названного заболевания, его таксономическое положение, морфологические и тинкториальные свойства.
- •2. Эпидемиология менингита: источник инфекции, входные ворота, механизм, факторы и пути передачи инфекции.
- •3. Какие формы инфекции существуют и их эпидемиологическое значение?
- •4. Какой материал нужно взять для микробиологического исследования? Основные методы микробиологического исследования?
- •5. Проводится ли специфическая профилактика названного заболевания?
- •Задача 13.
- •1. Назовите род и вид основного возбудителя туберкулеза у человека.
- •2. Морфологические и тинкториальные свойства возбудителя туберкулеза.
- •3. В чем особенность строения клеточной стенки возбудителя туберкулеза, и какую они играют роль в диагностических приемах?
- •4. Какой метод окраски применяется для выделения возбудителя туберкулеза?
- •5. Профилактика туберкулеза.
- •Задача 14
- •Задача 15.
- •Задача 16
- •Задача 17.
- •1. К какой группе микробов относится возбудитель краснухи?
- •2. К чему приводит заражение женщин в первые 4 месяца беременности?
- •3. Эпидемиология краснухи (источник инфекции, механизм, пути передачи инфекции).
- •4. Методы лабораторной диагностики краснухи и характер исследуемого материала.
- •5. Специфическая профилактика краснухи.
- •Задача 18.
- •Задача 19
- •1. Назовите возбудителя и инфекционного паротита.
- •2. Какое лабораторное исследование было назначено?
- •3. Эпидемиология данного заболевания (источник инфекции, механизм, пути передачи инфекции).
- •4. Какие осложнения данного заболевания?
- •5. Какова профилактика данного заболевания?
- •Задача 20.
- •1. Какое/ие инфекционное заболевание можно предположить в данном случае?
- •2. С чем необходимо дифференцировать заболевание?
- •3. Какие дополнительные исследования следует провести для уточнения этиологического диагноза?
- •4. Нужно ли в данном случае назначить антифунгальные препараты?
- •5. Нужна ли изоляция больного для предотвращения распространения инфекции?
- •Задача 22. (эту задачу я еще уточню у преподавателя)
- •5. Каковы принципы лечения инфекции?
- •Задача 23.
- •Задача 24.
- •Задача 25.
- •1. Назовите возбудителя/лей газовой гангрены
- •2. Особенности биологии возбудителя.
- •3. Какова причина возникновения подобного осложнения?
- •4. Какие факторы способствуют развитию газовой гангрены?
- •5. Какой материал необходимо взять на исследование и какие лабораторные методы могут применяться для диагностики данного заболевания?
- •Задача 26.
- •1. Как называется группа микроорганизмов, в норме населяющих тело человека?
- •2. При каких условиях микроорганизмы данной группы могут вызывать заболевания у человека?
- •3. Какой главный критерий диагностики при выделении данных микроорганизмов?
- •4. Какова роль микроорганизмов этой группы в возникновении внутрибольничных инфекций?
- •5. Какими особенностями обладают госпитальные штаммы микроорганизмов?
- •Задача 27
- •Задача 28.
- •1. Назовите возбудителя скарлатины?
- •2. Факторы вирулентности данного микроорганизма, чем он отличается от представителей того же вида?
- •3. Каковы основные осложнения нелеченой скарлатины?
- •4. Каковы принципы лечения скарлатины?
- •5. Назовите основные методы диагностики скарлатины.
- •Задача 29.
- •Задача 30.
- •1. Что содержится в препарате?
- •2. Как получен препарат?
- •3. Показания к применению и способ применения.
- •4. Механизм противовирусного действия препарата.
- •5. Клинический эффект от применения препарата.
- •Задача 31.
- •Задача 32.
- •1. Что содержится в препарате?
- •2. Как получают нистатин?
- •3. Показания и способ применения
- •4. Механизм действия
- •5.Клинический эффект применения нистатина
- •Задача 33.
- •1. К какой группе относится препарат флуконазол?
- •2. Как получают флуконазол?
- •3. Механизм действия флуконазола на клетки грибов.
- •4. Показания и способы применения препарата
- •5. Клинический эффект от применения препарата.
- •Задача 34.
- •1. Что содержит препарат?
- •2. Как получен биопрепарат?
- •3. Что означает адсорбированный?
- •4. Для чего используется данный препарат?
- •Задача 35.
- •Задача 36.
- •Задача 37.
- •1. Для чего он используется препарат? Что он содержит?
- •2. Как получен биопрепарат?
- •3. Механизм действия препарата.
- •4. Дайте характеристику иммунитета при введении данного препарата.
- •5. Схема введения вакцины?
- •Задача 38.
- •5. О чем говорит отрицательный, положительный и гиперергический результат пробы?
- •Задача 39.
- •Задача 40.
- •Задача 41
- •Задача 42.
- •Действующее вещество:
- •5. Объясните достигаемый эффект после введения препарата.
- •Задача 43
- •Задача 44
- •1. К какой группе относится данный препарат?
- •2. Что содержит препарат?
- •3. Каков механизм действия препарата?
- •4. Как применяют препарат?
- •5. Укажите противопоказания к применению препарата
- •2. При нарушении функции почек
- •Задача 45.
- •5. Опишите достигаемый эффект после введения препарата.
- •Задача 48.
- •Задача 49.
- •Задача 50.
- •Задача 51.
- •Задача 52
- •Задача 53.
- •1. К какой группе относится данный препарат?
- •2. Что содержит данный препарат?
- •3. Как получен данный препарат?
- •4. Какова причина, по Вашему мнению, состояния больного?
- •5. В чем состоит профилактика последствий подобных травм?
- •Задача 54.
- •Задача 55.
- •1. Какой препарат следует назначить для коррекции данного дисбиотического состояния? к какой группе он относится?
- •2. Что содержит данный препарат?
- •3. Как получен и как применяется данный препарат?
- •4. Объясните предполагаемый механизм действия препарата.
- •5. Какие еще группы препаратов могут применяться при коррекции дисбиозов?
- •Задача 56.
- •Задача 57.
- •1. К какой группе относится данный биопрепарат?
- •2. Что содержит данный биопрепарат?
- •3. Как получен данный препарат?
- •4. Кому рекомендуют вакцинацию «Пневмо – 23»?
- •5. Дайте характеристику иммунитета, возникающего после введения данной вакцины.
- •Задача 58.
- •1. К какой группе относится данный препарат?
- •2. Что содержит данный препарат?
- •3. Как получен препарат?
- •4. Каковы показания для вакцинации, схема вакцинации?
- •Задача 59.
- •Задача 60.
- •Задача 61.
- •Задача 62.
- •1. К какой группе относится данный биопрепарат?
- •2. Что содержит биопрепарат?
- •3. Как получен биопрепарат?
- •4. Для чего применяется препарат?
- •5. Схема использования и учета результата
- •Задача 63
- •1)К какой группе относится препарат «интести-бактериофаг»?
- •2)Что содержит препарат«интести-бактериофаг»?
- •3)Как получен«интести-бактериофаг»?
- •4)Для чего используется «интести-бактериофаг»?
- •5)Возможный способ введения препарата?
- •Задача 64.
- •Задача 65.
- •Задача 66
- •Задача 67.
- •1. Какой (какие) возбудитель(и) при данной патологии Вы предполагаете?
- •2. Факторы вирулентности возбудителя?
- •3. Какой материал, помимо мокроты, можно взять для исследования?
- •Задача 68.
- •Задача 69
- •1. Какой (какие) возбудитель(и) при данной патологии Вы предполагаете?
- •2. Факторы вирулентности возбудителя.
- •3. Особенности подготовки мокроты для микроскопии.
- •4. Какие лабораторные методы исследования должны применяться в этом случае?
- •5. Профилактика данной инфекции
- •Задача 70.
- •1. Какой возбудитель, кроме мбт, при данной патологии Вы предполагаете?
- •2. Факторы вирулентности возбудителя.
- •3. Особенности подготовки мокроты для микроскопии.
- •4. Какие лабораторные методы исследования должны применяться в этом случае?
- •5. Профилактика данной инфекции
- •Задача 71.
- •Задача 72.
- •Задача 73.
- •4. Какие лабораторные методы исследования должны применяться в этом случае?
- •5. Профилактика туберкулеза
- •Задача 74.
- •Задача 75.
- •Задача 76.
- •1. Какие методы лабораторного исследования следует применить для подтверждения диагноза?
- •2. Каковы меры профилактики заболевания у контактных с ним детей?
- •3. Каковы особенности эпидемиологии гепатита а?
- •4. Существует ли специфическая профилактика гепатита а?
- •5. Какой еще гепатит может передаваться таким же механизмом?
- •Задача 77
- •Задача 78
- •1. Какой возбудитель при данной патологии Вы предполагаете?
- •2. Какой диагностический материал может быть исследован в этом случае?
- •3. Факторы вирулентности данного возбудителя.
- •4. Методы лабораторной диагностики.
- •5. Какие осложнения, кроме гломерулонефрита, может вызвать данный возбудитель?
Достоинства метода
· Простой метод, доступный для практических лабораторий
· Количественная характеристика резистентности
Недостатки метода
· Высокая стоимость
· Большой расход питательных сред (на стандартную чашку Петри можно поместить только один тест)
Доп инфа:
Определение антибиотика в крови, моче и других жидкостях организма человека.
В штатив устанавливают два ряда пробирок. В одном из них готовят разведения эталонного антибиотика, в другом — исследуемой жидкости.
Затем в каждую пробирку вносят взвесь тест-бактерий, приготовленную в среде Гисса с глюкозой.
При определении в исследуемой жидкости пенициллина, тетрациклинов, эритромицина в качестве тест-бактерий используют стандартный штамм S. aureus, а при определении стрептомицина — Е. coli.
После инкубирования посевов при 37 °С в течение 18—20 ч отмечают результаты опыта по помутнению среды и ее окрашиванию индикатором вследствие расщепления глюкозы тест-бактериями.
Концентрация антибиотика определяется умножением наибольшего разведения исследуемой жидкости, задерживающей рост тест-бактерий, на минимальную концентрацию эталонного антибиотика, задерживающего рост тех же тестбактерий.
Например, если максимальное разведение исследуемой жидкости, задерживающее рост тест-бактерий, равно 1 :1024, а минимальная концентрация эталонного антибиотика, задерживающего рост тех же тест-бактерий, 0,313 мкг/мл, то произведение 1024- 0,313=320 мкг/мл составляет концентрацию антибиотика в 1 мл.
Определение способности S. aureus продуцировать бета-лактамазу.
В колбу с 0,5 мл суточной бульонной культуры стандартного штамма стафилококка, чувствительного к пенициллину, вносят 20 мл расплавленного и охлажденного до 45 °С питательного агара, перемешивают и выливают в чашку Петри. После застывания агара в центр чашки на поверхность среды помещают диск, содержащий пенициллин. По радиусам диска петлей засевают исследуемые культуры. Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта. О способности исследуемых бактерий продуцировать бета-лакта-мазу судят по наличию роста стандартного штамма стафилококка вокруг той или другой исследуемой культуры (вокруг диска).
25. Механизм фагоцитоза. Выживание микобактерий туберкулеза в фагоците. Туберкуломы.
Общая информация по учебнику Зверева.
Фагоцитоз – процесс поглощения клеткой частиц или крупных макромолекулярных комплексов, складывающийся из нескольких этапов:
Активация и хемотаксис – целенаправленное движение клеток к объекту фагоцитоза в сторону повышающейся концентрации хемоаттрактантов (хемокины, компоненты комплемента, продукты деградации тканей);
Адгезия частиц к поверхности фагоцита. В адгезии важную роль играют Toll-подобные рецепторы, а также рецепторы к Fc-фрагменту иммуноглобулина и C3в-компоненту комплемента (иммунный фагоцитоз).
Поглощение частиц – погружение в цитоплазму и образование фагосомы(вакуоли).
Внутриклеточный киллинг и переваривание. Фагосома сливается с лизосомой→фаголизосома, в которой под действием ферментом происходит гибель бактерии (кислороднезависимая система бактерицидности). Одновременно в клетке усиливается потребление кислорода и глюкозы, развивается респираторный взры (образуются токсичные продукты кислорода, н-р, перекись водорода и супероксиданион) – кислородзависимая система бактерицидности.
*Фагоциты – это макрофаги (моноциты и тканевые макрофаги) и микрофаги (нейтрофилы).
Касаемо туберкулеза и фагоцитоза:
Фагосома→фаголизосома→ в результате процессирования МБТ в фаголизосоме фрагменты микобактерии презентуются на поверхность макрофага. Исходы попадания МБТ в фаголизосому:
• завершенный фагоцитоз – уничтожение МБТ макрофагом;
• сохранение (выживание) ее в макрофаге.
• незавершенный фагоцитоз - внутриклеточное размножение МБТ → гибель альвеолярного макрофага→повторный фагоцитоз;
При незавершенном фагоцитозе МБТ происходит апоптоз, тем самым обеспечивая важную связь с адаптивным иммунитетом, поскольку апоптозные везикулы содержат антигены МБТ, которые захватываются ДК (дендритные клетки). Последние презентуют эти антигены незрелым Т-клеткам, стимулируя их активацию.
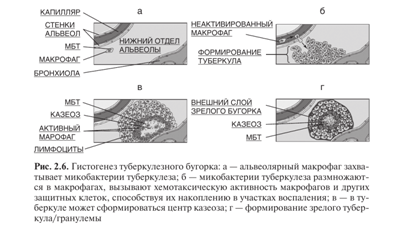
Одновременно макрофаги выделяют в окружающую среду противовоспалительные цитокины и интерлейкины, притягивающие в очаг инфекции Т-лимфоциты. Т-лимфоциты считывают информацию об антигенах с мембраны макрофага и превращаются в клетки памяти. Таким образом, активированные Т-лимфоциты продуцируют эффекторные цитокины, гамма-интерферон (IFN-y) и фактор некроза опухоли альфа (TNF-a), которые привлекают из капилляров в очаг воспаления большое количество различных клеток: макрофагов, лимфоцитов, гранулоцитов и др. Эти клетки участвуют в формировании гранулемы и тем самым ограничивают распространение МБТ в организме. На месте воспаления происходит формирование специфических бугорков — гранулем/туберкулем— как проявление локального туберкулезного воспаления в участке своего первоначального внедрения.
Подробнее про сохранение в макрофаге
Бактерицидной активности. Проникновение МБТ не сопровождается полноценной активацией макрофагов (из-за особенности клеточной стенки МБТ)→фагоцитоз не сопровождается образованием перекисных радикалов и носит неагрессивный характер. Далее проникнув внутрь, микобактерии включают механизмы, препятствующие образованию фаголизосом (продукция аммония, синтез сульфолипидов).
Если же фаголизосома образовалась, то МБТ начинают подавлять кислородозависимую и кислородонезависимую киллерную активность макрофагов целым рядом механизмов:
Синтез ферментов с каталазной и пероксидазной активностью;
Продолжающийся синтез аммония и сульфолипидов.
Используя железосодержащие соединения макрофагов для своих ферментных систем, МБТ блокируют иммуноспецифичемкие функции макрофагов (снижение антигенпредставляющей ункции, ослабление чувствительности к активирующим сигналам Т-лимфоцитов). Поражаются и митохондрии макрофагов (миколовыми арабинолипидными кислотами), что в конечном счете может привести к апоптозу.
26 . Механизмы возникновения и распространения устойчивости бактерий к антибактериальным препаратам. Природная и приобретенная устойчивость к антибактериальным препаратам.
Антибиотикорезистентность – феномен устойчивости микробных штаммов к действию одного или нескольких антимикробных препаратов (АМП). В микробиологии – способность штамма выживать при более высоких концентрациях АМП, чем большинство штаммов этого вида. Антибиотикорезистентость – пример адаптации бактерий к условиям внешней среды.
Различия внебольничных и внутрибольничных (госпитальных) инфекций – во внебольничных инфекциях: этиологический агент специфичен для отдельной нозологической формы (определенной болезни), уровень АБ-резистентности можно предсказать, возможно разработать универсальные рекомендации для терапии. Внутрибольничные инфекции – самые устойчивые, выраженной специфичности болезни нет, универсальные рекомендации не разработать.
Различают природную (видовую, первичную, естественную) и приобретенную устойчивость.
Видовая устойчивость
· является постоянным видовым признаком
· Детерминируется хромосомой
· Отсутствие мишени для АМП или недоступность мишени из-за инзкой проницаемости ЦПМ или ферментативной инактивации АПМ
· При её наличии у бактерий препараты не эффективны, она легко прогнозируется
Приобретенная устойчивость
· свойство отдельных штаммов бактерий сохранять жизнеспособность при концентрациях антибиотиков, которые подавляют основную часть микробной популяции
· детерминируется хромосомой (мутации, транспозоны) или R-плазмидами
· эффективность препарата не всегда снижается
Генетические механизмы АБ-резистентности
· Мутации
· Рекомбинации (перераспределение генов с созданием новых комбинаций)
· Репликативные единицы
o Конъюгативные транспозоны – мобильные генетические элементы
o Конъюгативные R-плазмиды – способные передаваться в другие клетки
· Нерепликативные едицины
o Транспозоны
o Генные кассеты – автономные, нереплицирующиеся, замкнутые в кольцо элементы.
o Интегрон – система захвата и экспрессии генов, например, в генной кассете
Биохимические механизмы развития устойчивости к химиотерапевтическим препаратам.
1. Выработка ферментов, инактивирующих АБ
2. Снижение проницаемости ЦМП бактерии для АБ
3. Структурные изменения мишени
4. Альтернативные пути метаболизма
5. Эффлюкс – актиный выброс АБ из клетки
Диагностика резистентности:
o Диско-диффузионный метод
o Е-тест
o Метод серийных разведений
27. Механизмы обмена генетической информацией у бактерий
Рекомбинация – процесс генетического обмена между донором и реципиентом, в результате которого является включение фрагментов нуклеиновой кислоты донора в хромосому реципиента путём кроссинговера.
Передача генетического материала (хромосомных генов) от одних бактерий к другим происходит путем:
1) трансформации,
2) трансдукции
3) конъюгации,
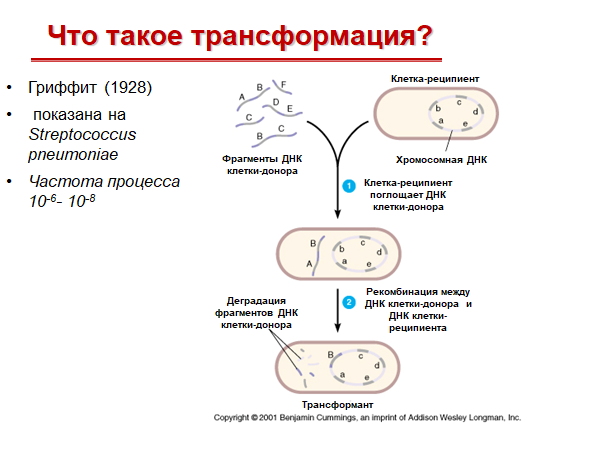
Трансформация – фрагмент нативной ДНК клетки донора, оказавшийся в окружающей среде, поглощается реципиентом (зачастую после смерти донора)
В 1944 г. О. Эвери, К. Мак-Леод и К. Мак-Карти установили, что активным началом, содержащимся в экстракте убитых пневмококков, является ДНК, которая определяет его генетические свойства и является носителем генетической информации. Феномен трансформации воспроизводится в опытах с разными патогенными и непатогенными бактериями: стрептококками, менингококками и др. С донорной ДНК в реципиентную клетку обычно передается только один ген. Это связано с протяженностью трансформирующего фрагмента ДНК, который может проникнуть в реципиентную клетку. Обычно он не превышает 1/100 длины бактериальной хромосомы, т.е. включает один или несколько сцепленных генов. Эффективно трансформация происходит в опытах с бактериями одного и того же вида, имеющих разный генотип.
Процесс трансформации бактерий можно подразделить на несколько фаз:
1. адсорбция ДНК-донора на клетке-реципиенте;
2. проникновение ДНК внутрь клетки-реципиента;
3. соединение ДНК с гомологичным участком хромосомы реципиента с последующей рекомбинацией.
После проникновения внутрь клетки трансформирующая ДНК деспирализуется. Затем происходит физическое включение любой из двух нитей ДНК донора в геном реципиента.
Эффективность спаривания трансформирующей ДНК с соответствующим участком хромосомы реципиента зависит от степени гомологичности ДНК донора и реципиента. Чем выше гомологичность, тем эффективнее спаривание, что определяет конечный результат трансформации, т.е. количество формирующихся рекомбинантов (трансформантов). Отсюда ясно, почему межвидовая трансформация происходит гораздо реже, чем внутривидовая
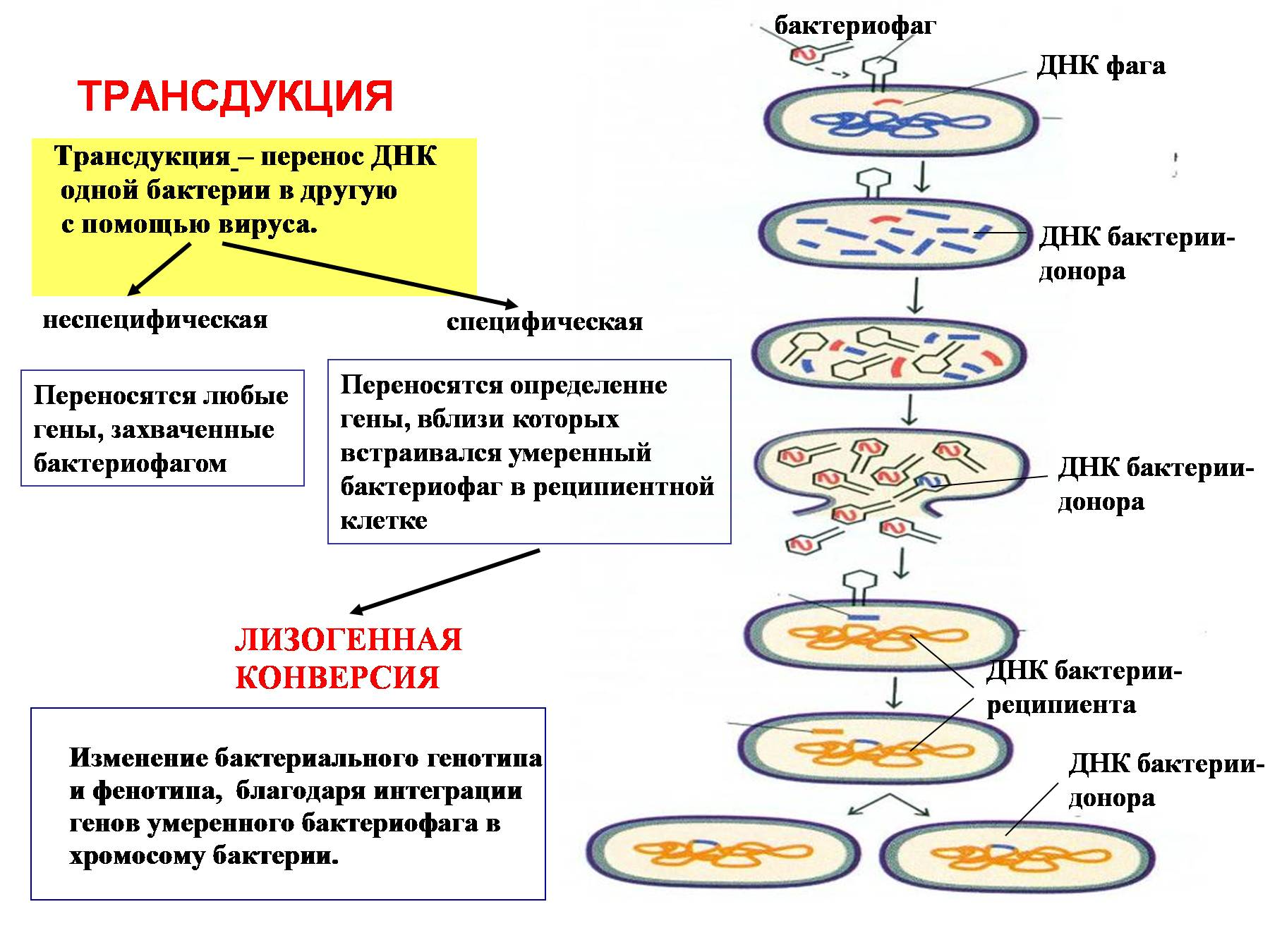
Трансдукция – перенос генетической информации от донора к реципиенту при помощи умеренного бактериофага. Есть специфическая (когда кусок профага образует новую ДНК для следующего поколения фагов) и неспецифическая/общая (когда при формировании нового поколения фагов в капсулу попадает не фаговая генетическая информация, а бактериальная)
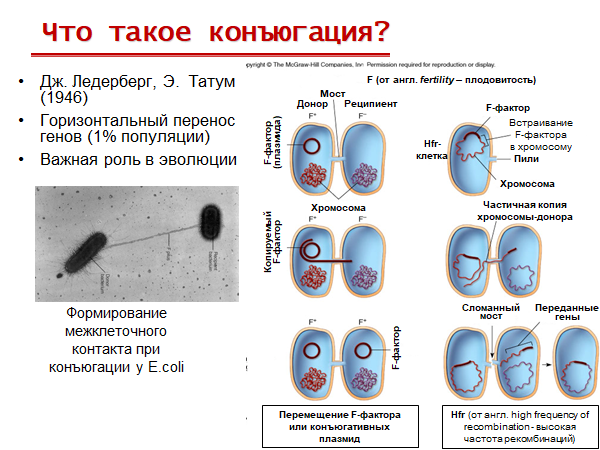
Конъюгация – «половой процесс» у бактерий, при котором в результате физического контакта через sex-пили может происходить передача ДНК от донора к реципиенту и рекомбинация. Для неё нужна F-плазмида (на ней кодируется специальный белок, который может разрезать 1 из 2 цепей основной ДНК и перетащить её по половым пили к реципиенту, тогда оставшаяся цепь восстановит ту, что у неё забрали, а та, которая ушла реципиенту, может стать плазмидой, также восстановившись). F-плазмида переходит к реципиенту вместе с транспортируемы участком по наследству.
Этапы конъюгации:
1. Первым этапом конъюгации является прикрепление клетки-донора к реципиентной клетке с помощью половых ворсинок (sex pili).
2. Затем между обеими клетками образуется конъюгационный мостик, через который из клетки-донора в клетку-реципиент могут передаваться F-фактор и другие плазмиды, находящиеся в цитоплазме бактерии-донора в автономном состоянии.
Для переноса бактериальной хромосомы необходим разрыв одной из цепей ДНК, который происходит в месте включения F-плазмиды при участии эндонуклеазы.
3. Проксимальный конец ДНК через конъюгационный мостик проникает в клетку-реципиент и сразу же достраивается до двунитевой структуры. Оставшаяся в клетке донора нить ДНК является матрицей для синтеза второй нити. Следовательно, при конъюгации передается только одна нить ДНК-донора, а вторая, оставшаяся комплементарная, цепь достраивается в реципиентной клетке.