
- •1. Аллергические пробы in vivo и in vitro, их сущность, применение.
- •2. Анатоксины. Получение, применение. Антитоксический иммунитет
- •3. Антибактериальные препараты. Классификация. Механизмы антибактериального действия. Механизмы возникновения и распространения устойчивости.
- •Классификация, которую Козлова указала у себя в презентации:
- •3)По типу взаимодействия с микробной клеткой:
- •4)По кислотоустойчивости антимикробные препараты классифицируются на:
- •5. Бактериологический метод диагностики. Требования к выращиванию бактерий в искусственных условиях.
- •6. Бактериоскопический метод диагностики, его задачи и возможности. Методы микроскопии и их применение.
- •7. Бактериофаги. Взаимодействие фага с бактериальной клеткой. Умеренные и вирулентные бактериофаги. Лизогения.
- •8. Бактериофаги. Получение, титрование. Практическое применение в диагностике, профилактике и лечение
- •9. Вакцины Вакцинопрофилактика и вакцинотерапия
- •10. Внутривидовое типирование бактерий. Методы. Использование в практике
- •11. Врожденный иммунитет. Фагоцитоз. Показатели фагоцитоза
- •14 Грибы. Строение клетки. Классификация грибов по морфологии таллома.
- •15. Действие физических и химических факторов на микроорганизмы. Использование в практике.
- •16. Дисбиозы. Препараты для восстановления микробиоты
- •17 Иммунодиагностика (серодиагностика) инфекционных заболеваний. Принципы и диагностические критерии.
- •18. Иммунопрофилактика, иммунотерапия. Осложнения: анафилактический шок, сывороточная болезнь. Их предупреждение
- •19. Иммуноферментный анализ, иммуноблоттинг. Принципы методов, используемые реагенты и оборудование, применение.
- •20. История микробиологии. Этапы развития. Современные задачи.
- •21. Культивирование бактерий in vitro. Требования к условиям культивирования. Питательные среды, их классификация. Требования, предъявляемые к питательным средам
- •Условия культивирования бактерий:
- •Требования к питательным средам:
- •Классификация
- •Примеры сред
- •22. Методы культивирования вирусов. Вирусологический метод, основные этапы.
- •23. Методы микроскопического исследования (световая, люминесцентная, темнопольная, фазово-контрастная, электронная микроскопия)
- •24. Методы определения чувствительности бактерий к антибиотикам. Мпк (мик) и мбк. Критерии определения бактериальных изолятов как чувствительные, устойчивые, умеренно чувствительные
- •Достоинства метода
- •Недостатки метода
- •28. Механизмы формирования и распространения устойчивости к антибактериальным препаратам бактерий – возбудителей инфекционных болезней
- •29. Микробиота желудочно-кишечного тракта человека
- •30. Микробиота урогенитального тракта человека
- •31. Моноклональные антитела. Получение. Использование
- •32. Морфология микроорганизмов. Морфологические группы бактерий
- •33. Нагрузочные серологические реакции. Реакции непрямой гемагглютинации. Компоненты. Применение
- •34. Наследственность и изменчивость у бактерий. Механизмы обеспечения и передачи дочерним клеткам генетической информации. Механизмы изменчивости
- •35. Органеллы бактериальной клетки. Функциональное назначение органелл
- •Особенности клеточной стенки грамположительных бактерий
- •Особенности клеточной стенки грамотрицательных бактерий
- •5. Жгутики
- •36. Особенности биологии вирусов. Принципы классификации вирусов
- •37. Особенности противовирусного иммунитета
- •38. Отличительные черты риккетсий. Методы культивирования. Риккетсиозы, общая характеристика.
- •39. Патогенность и вирулентность бактерий. Факторы вирулентности. Генетические основы распространения факторов вирулентности среди бактерий.
- •40. Понятие о морфологических свойствах микроорганизмов. Морфологические группы бактерий.
- •41.Понятие об инфекции. 3 участника инфекционного процесса. 3 звена эпидемической цепи
- •3 Участника инфекционного процесса:
- •3 Звена эпидемической цепи:
- •42. Предмет и задачи медицинской микробиологии и иммунологии. Вклад российских ученых в развитии микробиологии и иммунологии.
- •43. Предмет и современные задачи санитарной микробиологии. Санитарно-показательные микроорганизмы. Их значение для оценки безопасности объектов окружающей среды и продуктов питания
- •44. Принципы классификации инфекционных заболеваний.
- •45. Противогрибковые препараты.
- •46. Различия в строении микроорганизмов прокариот и эукариот
- •47. Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
- •48. Реакция иммунофлюоресценции. Механизм, типы, компоненты, применение для индикации антигенов и иммунодиагностики
- •49. Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки, применение
- •51.Роль врожденного и приобретенного иммунитета в развитии инфекции
- •52. Рост и размножение бактерий в искусственных условиях. Фазы размножения
- •53. Спирохеты. Характеристика. Особенности строения. Роль в патологии человека
- •54. Стерилизация, способы, аппаратура
- •Физические:
- •Химические:
- •Механические:
- •55. Строение бактериального генома. Хромосомные и внехромосомные элементы. Подвижные элементы. Умеренные бактериофаги и их роль в изменчивости генома
- •56. Структура и функции клеточной стенки бактерий. Особенности строения клеточной стенки грамположительных и грамотрицательных бактерий.
- •57. Тинкториальные свойства бактерий. Цели и методы окраски
- •Источник: Mikrobiologia_Zverev, khoroshie_lektsii_po_mikre
- •58. Типы и механизмы питания бактерий. Классификация бактерий по используемым источникам углерода и энергии. Прототрофы и ауксотрофы
- •59. Токсины бактерий, их природа и свойства. Получение и применение экзо- и эндотоксинов.
- •60. Транспорт веществ в бактериальную клетку. Экскреция высокомолекулярных соединений из бактериальной клетки
- •Секреция продуктов жизнедеятельности бактериальной клеткой
- •61. Ферменты бактерий. Роль ферментов в патогенности бактерий Идентификация бактерий по ферментативной активности
- •62. Чистые культуры микроорганизмов. Принципы и методы выделения
- •63. Энергетический метаболизм у бактерий. Типы энергетического метаболизма. Типы дыхания.
- •64. Этапы взаимодействия вирусов с чувствительными клетками и факторы, способные их нарушить. Формы вирусной инфекции.
- •1. Аденовирусная инфекция. Характеристика возбудителей. Лабораторная диагностика.
- •4. Вирусы герпеса. Классификация, значение в патологии человека. Профилактика
- •5. Вирусы экхо и Коксаки, вызываемые ими заболевания. Лабораторная диагностика энтеровирусных инфекций.
- •Коксаки Coxsackievirus
- •Экхо есно (Enteric Cytopathic Human Orphan)
- •7. Возбудители анаэробной газовой инфекции. Характеристика. Лабораторная диагностика. Специфическая и неспецифическая профилактика. Принципы лечения
- •Характеристика возбудителей
- •C. Septicum (палочка Гона-Сакса)
- •Эпидемиология
- •Патогенез
- •Клиника
- •Иммунитет
- •Лабораторная диагностика
- •Профилактика
- •Лечение
- •8. Возбудители бруцеллеза. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •9.Возбудители брюшного тифа и паратифов. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •10. Возбудители возвратных тифов. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения
- •11. Возбудители гнойно-септических инфекций. Принципы лабораторной диагностики.
- •Возбудители гси
- •Принципы лабораторной диагностики гси, вызванных аэробными и факультативно-анаэробными бактериями
- •Лабораторная диагностика анаэробных инфекций
- •Аэробные грамположительные кокки
- •12.Возбудители гриппа. Характеристика. Лабораторная диагностика. Специфическая профилактика.
- •Характеристика
- •Вирус гриппа а
- •1.Геном.
- •2.Морфология
- •5.Методы культивирования.
- •6.Резистентность
- •Лабороторная диагностика.
- •Специфическая профилактика
- •Вирус гриппа в
- •Вирус гриппа с
- •13. Возбудители кишечного иерсиниоза и псевдотуберкулеза. Характеристика. Лабораторная диагностика. Профилактика
- •14. Возбудители коклюша и паракоклюша. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •15. Возбудители микобактериозов. Морфология, особенности строения микобактериальной клетки). Распространенность. Лабораторная диагностика
- •16. Возбудители микозов кожи и ее придатков
- •Дерматофиты
- •Возбудители разноцветного лишая и других поверхностных микозов
- •17. Возбудители орви. Общая характеристика. Принципы диагностики, профилактики и лечения.
- •18. Возбудители пищевых токсикоинфекций. Лабораторная диагностик.
- •19. Возбудители сальмонеллезных гастроэнтеритов. Характеристика возбудителей. Лабораторная диагностика. Профилактика. Принципы лечения
- •20. Возбудители пищевых токсикоинфекций. Лабораторная диагностика.
- •21. Возбудители туберкулеза. Классификация. Особенности микобактериальной клетки. Распространенность.
- •22. Возбудители хламидиозов. Характеристика. Лабораторная диагностика. Принципы лечения
- •23. Возбудители шигеллезов. Характеристика. Лабораторная диагностика. Специфическая профилактика и принципы лечения
- •24. Возбудители эшерихиозов. Характеристика. Лабораторная диагностика эшерихиозов
- •25. Возбудитель бешенства. Характеристика. Патогенез. Специфическая профилактика.
- •26. Возбудитель ботулизма. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •Источник: лекции 21 года и Коваленко
- •28. Возбудитель кампилобактериоза. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения.
- •29. Возбудитель клещевого энцефалита. Характеристика
- •30. Возбудитель кори. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •Профилактика. Для профилактики кори используют вакцины:
- •31. Возбудитель краснухи. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •32. Возбудитель Ку-лихорадки. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •33. Возбудитель паротита. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •34. Возбудитель сибирской язвы. Характеристика. Лабораторная диагностика. Специфическая профилактика Принципы лечения
- •35. Возбудитель сифилиса. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения.
- •38. Возбудитель чумы. Характеристика. Лабораторная диагностика. Специфическая профилактика Принципы лечения
- •39. Гонококки. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения
- •40. Классификация микозов по локализации инфекционного процесса
- •41. Криптококкоз. Возбудители. Лабораторная диагностика криптококкоза
- •43. Микологический метод диагностики микозов. Методы идентификации дрожжей и нитчатых грибов.
- •44. Микоплазмы. Биологические свойства, особенности строения. Роль в патологии человека. Принципы диагностики и лечения
- •Возбудители урогенитальных микоплазмозов и уреаплазмоза.
- •45. Микоплазмы. Биологические свойства, особенности строения. Роль в патологии человека. Принципы диагностики и лечения.
- •46. Общая характеристика рода Candida. Методы и критерии диагностики.
- •Основные свойства грибов рода Candida:
- •Лабораторная диагностика
- •47. Патогенные и условно-патогенные грибы. Классификация грибов по группам патогенности.
- •49 Стафилококки.Характеристика. Лабораторнаядиагностика стафилококковых инфекций. Стафилококковое носительство
- •50. Стрептококки. Характеристика. Лабораторная диагностика стрептококковых инфекций.
- •1. Назовите возбудителя гриппа.
- •2. Таксономическое положение возбудителя.
- •3. Какова морфология возбудителя?
- •4. Эпидемиология гриппа (источник инфекции, механизм, пути передачи инфекции).
- •5. Каковы основные звенья патогенеза гриппа?
- •Задача 2
- •Задача 3.
- •1. Назовите возбудителя коклюша.
- •2. Назовите факторы вирулентности возбудителя коклюша.
- •3. Эпидемиология коклюша (источник инфекции, механизм, пути передачи инфекции).
- •4. Какие периоды болезни выделяют и какие методы диагностики будут эффективны в каждом? Периоды болезни.
- •5. Профилактика коклюша
- •Задача 4.
- •Задача 5.
- •1. Назовите возбудителя сифилиса. К какой морфологической группе относится возбудитель сифилиса?
- •2. Как называется первичный аффект при сифилисе и место его локализации.
- •3. Опишите морфологические, тинкториальные и культуральные свойства возбудителя сифилиса.
- •4. Эпидемиология сифилиса: источник инфекции, механизм и пути передачи инфекции.
- •Задача 6.
- •Задача 7.
- •1. Кто из обследованных сотрудников хирургического отделения является носителем патогенного стафилококка?
- •2. По каким признакам проводится идентификация s.Aureus?
- •3. С какой целью проводилось фаготипирование s.Aureus?
- •4. Кто из обследованных лиц мог быть источником послеоперационных осложнений у больных?
- •5. Какие меры необходимо срочно принять для прекращения распространения данной внутрибольничной инфекции?
- •Задача 8.
- •Задача 9.
- •1. Какой микроорганизм чаще всего вызывает данное заболевание?
- •3. Основной метод диагностики гси? Какой материал может использоваться для исследования?
- •4. Какие препараты помимо антибиотиков можно применять для специфической терапии?
- •5. Какие другие заболевания еще может вызывать данный возбудитель: специфические и неспецифические?
- •Задача 10.
- •Задача 11.
- •Задача 12.
- •1. Назовите возбудителя названного заболевания, его таксономическое положение, морфологические и тинкториальные свойства.
- •2. Эпидемиология менингита: источник инфекции, входные ворота, механизм, факторы и пути передачи инфекции.
- •3. Какие формы инфекции существуют и их эпидемиологическое значение?
- •4. Какой материал нужно взять для микробиологического исследования? Основные методы микробиологического исследования?
- •5. Проводится ли специфическая профилактика названного заболевания?
- •Задача 13.
- •1. Назовите род и вид основного возбудителя туберкулеза у человека.
- •2. Морфологические и тинкториальные свойства возбудителя туберкулеза.
- •3. В чем особенность строения клеточной стенки возбудителя туберкулеза, и какую они играют роль в диагностических приемах?
- •4. Какой метод окраски применяется для выделения возбудителя туберкулеза?
- •5. Профилактика туберкулеза.
- •Задача 14
- •Задача 15.
- •Задача 16
- •Задача 17.
- •1. К какой группе микробов относится возбудитель краснухи?
- •2. К чему приводит заражение женщин в первые 4 месяца беременности?
- •3. Эпидемиология краснухи (источник инфекции, механизм, пути передачи инфекции).
- •4. Методы лабораторной диагностики краснухи и характер исследуемого материала.
- •5. Специфическая профилактика краснухи.
- •Задача 18.
- •Задача 19
- •1. Назовите возбудителя и инфекционного паротита.
- •2. Какое лабораторное исследование было назначено?
- •3. Эпидемиология данного заболевания (источник инфекции, механизм, пути передачи инфекции).
- •4. Какие осложнения данного заболевания?
- •5. Какова профилактика данного заболевания?
- •Задача 20.
- •1. Какое/ие инфекционное заболевание можно предположить в данном случае?
- •2. С чем необходимо дифференцировать заболевание?
- •3. Какие дополнительные исследования следует провести для уточнения этиологического диагноза?
- •4. Нужно ли в данном случае назначить антифунгальные препараты?
- •5. Нужна ли изоляция больного для предотвращения распространения инфекции?
- •Задача 22. (эту задачу я еще уточню у преподавателя)
- •5. Каковы принципы лечения инфекции?
- •Задача 23.
- •Задача 24.
- •Задача 25.
- •1. Назовите возбудителя/лей газовой гангрены
- •2. Особенности биологии возбудителя.
- •3. Какова причина возникновения подобного осложнения?
- •4. Какие факторы способствуют развитию газовой гангрены?
- •5. Какой материал необходимо взять на исследование и какие лабораторные методы могут применяться для диагностики данного заболевания?
- •Задача 26.
- •1. Как называется группа микроорганизмов, в норме населяющих тело человека?
- •2. При каких условиях микроорганизмы данной группы могут вызывать заболевания у человека?
- •3. Какой главный критерий диагностики при выделении данных микроорганизмов?
- •4. Какова роль микроорганизмов этой группы в возникновении внутрибольничных инфекций?
- •5. Какими особенностями обладают госпитальные штаммы микроорганизмов?
- •Задача 27
- •Задача 28.
- •1. Назовите возбудителя скарлатины?
- •2. Факторы вирулентности данного микроорганизма, чем он отличается от представителей того же вида?
- •3. Каковы основные осложнения нелеченой скарлатины?
- •4. Каковы принципы лечения скарлатины?
- •5. Назовите основные методы диагностики скарлатины.
- •Задача 29.
- •Задача 30.
- •1. Что содержится в препарате?
- •2. Как получен препарат?
- •3. Показания к применению и способ применения.
- •4. Механизм противовирусного действия препарата.
- •5. Клинический эффект от применения препарата.
- •Задача 31.
- •Задача 32.
- •1. Что содержится в препарате?
- •2. Как получают нистатин?
- •3. Показания и способ применения
- •4. Механизм действия
- •5.Клинический эффект применения нистатина
- •Задача 33.
- •1. К какой группе относится препарат флуконазол?
- •2. Как получают флуконазол?
- •3. Механизм действия флуконазола на клетки грибов.
- •4. Показания и способы применения препарата
- •5. Клинический эффект от применения препарата.
- •Задача 34.
- •1. Что содержит препарат?
- •2. Как получен биопрепарат?
- •3. Что означает адсорбированный?
- •4. Для чего используется данный препарат?
- •Задача 35.
- •Задача 36.
- •Задача 37.
- •1. Для чего он используется препарат? Что он содержит?
- •2. Как получен биопрепарат?
- •3. Механизм действия препарата.
- •4. Дайте характеристику иммунитета при введении данного препарата.
- •5. Схема введения вакцины?
- •Задача 38.
- •5. О чем говорит отрицательный, положительный и гиперергический результат пробы?
- •Задача 39.
- •Задача 40.
- •Задача 41
- •Задача 42.
- •Действующее вещество:
- •5. Объясните достигаемый эффект после введения препарата.
- •Задача 43
- •Задача 44
- •1. К какой группе относится данный препарат?
- •2. Что содержит препарат?
- •3. Каков механизм действия препарата?
- •4. Как применяют препарат?
- •5. Укажите противопоказания к применению препарата
- •2. При нарушении функции почек
- •Задача 45.
- •5. Опишите достигаемый эффект после введения препарата.
- •Задача 48.
- •Задача 49.
- •Задача 50.
- •Задача 51.
- •Задача 52
- •Задача 53.
- •1. К какой группе относится данный препарат?
- •2. Что содержит данный препарат?
- •3. Как получен данный препарат?
- •4. Какова причина, по Вашему мнению, состояния больного?
- •5. В чем состоит профилактика последствий подобных травм?
- •Задача 54.
- •Задача 55.
- •1. Какой препарат следует назначить для коррекции данного дисбиотического состояния? к какой группе он относится?
- •2. Что содержит данный препарат?
- •3. Как получен и как применяется данный препарат?
- •4. Объясните предполагаемый механизм действия препарата.
- •5. Какие еще группы препаратов могут применяться при коррекции дисбиозов?
- •Задача 56.
- •Задача 57.
- •1. К какой группе относится данный биопрепарат?
- •2. Что содержит данный биопрепарат?
- •3. Как получен данный препарат?
- •4. Кому рекомендуют вакцинацию «Пневмо – 23»?
- •5. Дайте характеристику иммунитета, возникающего после введения данной вакцины.
- •Задача 58.
- •1. К какой группе относится данный препарат?
- •2. Что содержит данный препарат?
- •3. Как получен препарат?
- •4. Каковы показания для вакцинации, схема вакцинации?
- •Задача 59.
- •Задача 60.
- •Задача 61.
- •Задача 62.
- •1. К какой группе относится данный биопрепарат?
- •2. Что содержит биопрепарат?
- •3. Как получен биопрепарат?
- •4. Для чего применяется препарат?
- •5. Схема использования и учета результата
- •Задача 63
- •1)К какой группе относится препарат «интести-бактериофаг»?
- •2)Что содержит препарат«интести-бактериофаг»?
- •3)Как получен«интести-бактериофаг»?
- •4)Для чего используется «интести-бактериофаг»?
- •5)Возможный способ введения препарата?
- •Задача 64.
- •Задача 65.
- •Задача 66
- •Задача 67.
- •1. Какой (какие) возбудитель(и) при данной патологии Вы предполагаете?
- •2. Факторы вирулентности возбудителя?
- •3. Какой материал, помимо мокроты, можно взять для исследования?
- •Задача 68.
- •Задача 69
- •1. Какой (какие) возбудитель(и) при данной патологии Вы предполагаете?
- •2. Факторы вирулентности возбудителя.
- •3. Особенности подготовки мокроты для микроскопии.
- •4. Какие лабораторные методы исследования должны применяться в этом случае?
- •5. Профилактика данной инфекции
- •Задача 70.
- •1. Какой возбудитель, кроме мбт, при данной патологии Вы предполагаете?
- •2. Факторы вирулентности возбудителя.
- •3. Особенности подготовки мокроты для микроскопии.
- •4. Какие лабораторные методы исследования должны применяться в этом случае?
- •5. Профилактика данной инфекции
- •Задача 71.
- •Задача 72.
- •Задача 73.
- •4. Какие лабораторные методы исследования должны применяться в этом случае?
- •5. Профилактика туберкулеза
- •Задача 74.
- •Задача 75.
- •Задача 76.
- •1. Какие методы лабораторного исследования следует применить для подтверждения диагноза?
- •2. Каковы меры профилактики заболевания у контактных с ним детей?
- •3. Каковы особенности эпидемиологии гепатита а?
- •4. Существует ли специфическая профилактика гепатита а?
- •5. Какой еще гепатит может передаваться таким же механизмом?
- •Задача 77
- •Задача 78
- •1. Какой возбудитель при данной патологии Вы предполагаете?
- •2. Какой диагностический материал может быть исследован в этом случае?
- •3. Факторы вирулентности данного возбудителя.
- •4. Методы лабораторной диагностики.
- •5. Какие осложнения, кроме гломерулонефрита, может вызвать данный возбудитель?
24. Методы определения чувствительности бактерий к антибиотикам. Мпк (мик) и мбк. Критерии определения бактериальных изолятов как чувствительные, устойчивые, умеренно чувствительные
МПК – минимальная концентрация, подавляющая видимый рост исследуемого микроорганизма в бульонной культуре или на плотной среде.
МБК – минимальная бактерицидная концентрация – минимальная концентрация антимикробного препарата, вызывающая при исследовании in vitro полную гибель бактерий в стандартных условиях опыта.
Хорошие лекции:
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ
Определение чувствительности выделенных культур возбудителя к антибиотикам, является необходимым элементом бактериологического исследования и обязательным условием антибиотикотерапии.
А. Метод стандартных бумажных дисков.
Величины зон задержки роста:
· диаметр от 0 мм до 6 мм – устойчивые;
· диаметр от 7 до 15мм – слабочувствительные;
· диаметр от 16 мм до 24 мм – чувствительные;
· диаметр от 25 мм и более – высокочувствительные.
Метод дает только качественную характеристику, однако прост и доступен в исполнении.
Б. Метод серийных стандартных разведений – позволяет определять минимальную подавляющую (ингибирующую) концентрацию антибиотика.
В. Экспрессный рэдокс-метод – основан на улавливании изменения ОВП питательной среды микроорганизмами по изменению цвета индикатора, добавленного в питательную среду (подолжительность определения 3-5 часов).
Д. ПЦР – выявление у микроорганизма генов устойчивости.
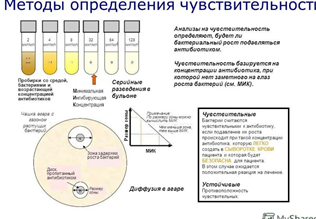
Г. Е-тест – применяют бумажные полоски, пропитанные рядом убывающих концентраций определённого антибиотика (128, 64, 32, 16, 8... мкг/мл), после инкубирования вокруг полоски образуется эллипсовидная зона задержки роста.
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ АНТИБИОТИКОВ В БИОЛОГИЧЕСКИХ ЖИДКОСТЯХ.
Для определения концентрации антибиотиков в моче, крови и других биологических жидкостях используют метод, основанный на способности антибиотиков диффундировать в агар, зараженный тест-микробом и подавлять рост последнего. Зона подавления роста тест-микроба зависит от концентрации антибиотика в изучаемом субстрате. Диаметры полученных зон сравнивают с величиной зон, образующихся при нанесении на агар известных количеств стандартного препарата (стандартами служат специально приготовленные очищенные образцы антибиотиков, активность которых установлена по международным стандартам).
Зверев:
Для определения чувствительности бактерий к антибиотикам (антибиотикограммы) обычно применяют:
• Метод диффузии в агар. На агаризованную питательную среду засевают исследуемый микроб, а затем вносят антибиотики. Обычно препараты вносят или в специальные лунки в агаре, или на поверхности посева раскладывают диски с антибиотиками («метод дисков»). Учет результатов проводят через сутки по наличию или отсутствию роста микробов вокруг лунок (дисков). Метод дисков — качественный и позволяет оценить, чувствителен или устойчив микроб к препарату.
• Методы определения минимальных ингибирующих (МИК) и бактерицидных концентраций (МБК), т. е. минимального уровня антибиотика, который позволяет in vitro предотвратить видимый рост микробов в питательной среде или полностью ее стерилизует. Это количественные методы, которые позволяют рассчитать дозу препарата, так как концентрация антибиотика в крови должна быть значительно выше минимальной ингибирующей концентрации для возбудителя инфекции. Введение адекватных доз препарата необходимо для эффективного лечения и профилактики формирования устойчивых микробов. Есть ускоренные способы, с применением автоматических анализаторов.
· Молекулярно-генетические методы (ПЦР и др) позволяет исследовать геном микробов и обнаружить гены резистентности
· Метод пограничных значений (мудл)
· Метод разведений в жидкой среде (мудл)
· Метод градиентных полосок (Е-тест) (мудл)
Определение чувствительности бактерий к антибиотикам методом дисков.
Исследуемую бактериальную культуру засевают газоном на питательный агар или среду АГВ в чашке Петри.
Среда АГВ: сухой питательный рыбный бульон, агар-агар, натрий фосфат двузамещенный. Среду готовят из сухого порошка в соответствии с инструкцией.
На засеянную поверхность пинцетом помещают на одинаковом расстоянии друг от друга бумажные диски, содержащие определенные дозы разных антибиотиков. Посевы инкубируют при 37 °С до следующего дня.
По диаметру зон задержки роста исследуемой культуры бактерий судят о ее чувствительности к антибиотикам.
Для получения достоверных результатов необходимо применять стандартные диски и питательные среды, для контроля которых используются эталонные штаммы соответствующих микроорганизмов.
Метод дисков не дает надежных данных при определении чувствительности микроорганизмов к плохо диффундирующим в агар полипептидным антибиотикам (например, полимиксин, ристомицин).
Если эти антибиотики предполагается использовать для лечения, рекомендуется определять чувствительность микроорганизмов методом серийных разведений.
Мудл:
После наложения диска на засеянную "газоном" культуру начинается диффузия препарата в агар, при этом его концентрация в агаре уменьшается по мере удаления от диска. Испытуемая культура может расти на агаре только там, где концентрация антибиотика не подавляет ее роста. Вокруг диска образуется зона задержки роста, коррелирующая с устойчивостью (чувствительностью) штамма к препарату.
Диаметры зон задержки роста содержатся в оценочных таблицах и позволяют разделить штаммы на чувствительные (S), устойчивые (R) и промежуточные (I).
Достоинства метода
· Простота постановки теста и учета результатов
· Низкая стоимость
· Доступность для любой диагностической лаборатории
Недостатки
· Результат носит качественный характер
· Может быть использован не для всех препаратов (особенности диффузии некоторых препаратов в агаре)
· Большое влияние "человеческого фактора" на конечный результат
Определение чувствительности бактерий к антибиотикам методом серийных разведений.
Данным методом определяют минимальную концентрацию антибиотика, ингибирующую рост исследуемой культуры бактерий.
Вначале готовят основной раствор, содержащий определенную концентрацию антибиотика (мкг/мл или ЕД/мл) в специальном растворителе или буферном растворе.
Из него готовят все последующие разведения в бульоне (в объеме 1 мл), после чего к каждому разведению добавляют 0,1 мл исследуемой бактериальной суспензии, содержащей 106—107 бактериальных клеток в 1 мл. В последнюю пробирку вносят 1 мл бульона и 0,1 мл суспензии бактерий (контроль культуры).
Посевы инкубируют при 37 °С до следующего дня, после чего отмечают результаты опыта по помутнению питательной среды, сравнивая с контролем культуры.
Последняя пробирка с прозрачной питательной средой указывает на задержку роста исследуемой культуры бактерий под влиянием содержащейся в ней минимальной ингибирующей концентрации (МИК) антибиотика.
Оценку результатов определения чувствительности микроорганизмов к антибиотикам проводят по специальной готовой таблице, которая содержит пограничные значения диаметров зон задержки роста для устойчивых, умеренно устойчивых и чувствительных штаммов, а также значения МИК антибиотиков для устойчивых и чувствительных штаммов.
К чувствительным относятся штаммы микроорганизмов, рост которых подавляется при концентрациях препарата, обнаруживаемых в сыворотке крови больного при использовании обычных доз антибиотиков.
К умеренно устойчивым относятся штаммы, для подавления роста которых требуются концентрации, создающиеся в сыворотке крови при введении максимальных доз препарата.
Устойчивыми являются микроорганизмы, рост которых не подавляется препаратом в концентрациях, создаваемых в организме при использовании максимально допустимых доз.
Посев испытуемых культур производят на чашки с различными концентрациями антибиотика. После инкубации определяют минимальную концентрацию препарата, при которой подавляется рост штамма - минимальная ингибирующая концентрация (МИК). (мудл)
Достоинства метода
· Количественная характеристика резистентности
· Возможно отслеживать нарастание резистентности в популяции микроорганизмов
· Одномоментное определение резистентности большого количества штаммов к большому количеству препаратов (при использовании штампа-репликатора)
Недостатки метода
· Высокая трудоемкость, большой объем подготовительной работы.
· Не удобен для работы с единичными штаммами

Мудл:
Метод пограничных значений (break-point method)
Для реализации метода проверяют способность культуры к росту при двух (реже одной) концентрациях препарата. Указанные концентрации определяются на основании оценки резистентности циркулирующих штаммов.
Штамм, не способный к росту при меньшей концентрации, считается чувствительным (S), растущий при большей концентрации - устойчивым (R). Рост микроорганизма при меньшей концентрации препарата и подавляемый большей концентрацией позволяет отнести его к промежуточным (I). Использование только одной пограничной концентрации позволяет разделить микроорганизмы на устойчивые и резистентные, без выделения промежуточной группы.
Достоинства метода
· Экономичность
· Малая зависимость от квалификации персонала
· Применим в случаях, когда препарат плохо диффундирует в агаре (метод стандартных дисков неприменим)
Недостатки метода
· Определение носит качественный характер
Метод разведений в жидкой среде
Испытуемый штамм засевают в серию пробирок с бульоном, содержащим различные концентрации антибиотика. После инкубации учитывают результат. О наличии роста судят по помутнению среды (в некоторых случаях - по изменению окраски).
Определение проводят в обычных пробирках (макрометод) или в 96-ти луночных панелях (микрометод).
Достоинства метода
· Количественная оценка резистентности
· Простота учета
· Возможность автоматизации постановки и учета при использовании 96-луночных панелей
Недостатки
· Высокая трудоемкость (особенно при использовании макрометода)
Метод градиентных полосок (Е-тест)
На специальную полоску последовательно нанесены разведения антибиотика, что позволяет создать градиент его концентрации в агаре. Образующаяся зона задержки роста "пересекает" тест-полоску в той точке, которая соответствует минимальной ингибирующей концентрации препарата.
В настоящее время различные фирмы выпускают аналогичные тест-системы, отличающиеся технологией создания градиента. Наиболее инвестны E-test (bioMerieux), которые являются родоначальниками данного метода.
