
- •Кафедра патофизиология, клиническая патофизиология, 3курс, лечебный факультет, перечень экзаменационных вопросов
- •1. Патофизиология как теоретическая и методологическая база медицины. Предмет и задачи патофизиологии. Основные особенности патофизиологии как научной и учебной дисциплины. Роль эксперимента в развитии патофизиологии и медицины.
- •2. Здоровье и болезнь – основные понятия нозологии. Переходные состояния организма между здоровьем и болезнью (предболезнь).
- •3. Болезнь как диалектическое единство повреждения и адаптивных реакций организма.
- •4. Этиология. Роль причин и условий в возникновении болезней, их диалектическая взаимосвязь. Понятие о внешних и внутренних причинах и факторах риска.
- •5. Патогенез. Причинно-следственные связи в развитии болезни. Понятие о порочном круге патогенеза. Единство функциональных и структурных изменений в патогенезе заболевания.
- •6. Повреждение как начальное звено патогенеза. Проявления повреждения на разных уровнях интеграции организма. Защитные, компенсаторные и восстановительные реакции организма.
- •7. Болезнетворное воздействие факторов внешней среды: действие электрического тока на организм человека.
- •10. Гипоксия. Определение, общая характеристика, классификация гипоксических состояний. Этиология и патогенез различных видов гипоксии.
- •https://docs.google.com/file/d/1L1k9VNrYG_6Rpq-KfVDVvRuDf0T11oxo/edit?filetype=msword
- •11. Защитно-приспособительные реакции при гипоксии. Механизмы срочной и долговременной адаптации к гипоксии. Нарушение обмена веществ и физиологических функций при гипоксии.
- •13. Молекулярные наследственные болезни углеводного и аминокислотного, белкового обмена. Галактоземия, гликогенозы. Фенилкетонурия, альбинизм.
- •15. Нарушение периферического кровообращения. Артериальная гиперемия. Причины, виды, механизмы развития, последствия.
- •16. Нарушение периферического кровообращения. Венозная гиперемия. Причины, виды, механизмы развития, последствия.
- •19. Воспаление. Сущность явления. Причины воспаления. Защитная роль воспаления. Теории воспаления.
- •20. Воспаление. Первичная и вторичная альтерация. Молекулярные механизмы повреждения.
- •22. Воспаление. Сосудистые реакции при воспалении. Экссудация, механизмы развития, роль медиаторов. Значение экссудации.
- •23. Сравнительная патология воспаления (И.И. Мечников). Эмиграция лейкоцитов (L) в очаг воспаления. Фагоцитоз.
- •24. Диалектика защиты и повреждения в процессе развития воспаления.
- •26. Характеристика понятия «ответ острой фазы». Основные цитокины РООФ, их происхождение и биологические эффекты.
- •27. Лихорадка как типовая патологическая реакция. Этиология, патогенез. Изменение теплопродукции и теплоотдачи в разные стадии лихорадки.
- •28. Лихорадка как компонент РООФ. Классификация пирогенов. Механизм реализации эндопирогенов. Биологическое значение лихорадки.
- •29. Отличие лихорадки от экзогенного перегревания и других видов гипертермий.
- •30. Тромботический синдром. Причины, механизмы развития, последствия (тромбоэмболическая болезнь). Патогенез тромбофилий.
- •Причины:
- ••Повреждение стенок сосудов и сердца, приводящее к снижению ее тромборезистентности.
- •Механизмы развития:
- •Механизм тромбофилии состоит в нарушении фибрин-опосредованной активации плазминогена (точнее, усиления его активации тканевым плазминоген-активирующим фактором).
- •К основным механизмам развития тромбофилии относят:
- •Последствия гиперкоагуляции и тромбоза:
- •Патогенез тромбофилий:
- •31. Геморрагический синдром: ангиопатии. Виды, причины, механизмы развития, последствия.
- •33. Геморрагический синдром: коагулопатии. Нарушения свертывания крови в 1,2,3 фазе коагуляции Причины, механизмы развития, последствия.
- •34. Синдром диссеминированного внутрисосудистого свертывания (синдром ДВС). Причины, механизмы развития, стадии, последствия. Принципы патогенетической терапии.
- •35. Гипо- и гипергликемии. Виды, причины, и механизмы развития, последствия.
- •36. Этиология и патогенез сахарного диабета I и II типа. Экспериментальный сахарный диабет. Патогенез острых и хронических осложнений сахарного диабета.
- •37. Метаболический синдром и его характеристика. Общее ожирение. Виды, причины и механизмы развития. Последствия.
- •38. Энергетический обмен организма в состояниях положительного энергетического баланса. Энергетический обмен организма в состояниях отрицательного энергетического баланса.
- •39. Голодание. Виды голодания, стадии полного голодания. Гормоно-субстратные изменения в разные периоды полного голодания.
- •41. Нарушения водно-солевого обмена. Обезвоживание. Причины, механизмы развития, последствия. Роль профессиональных факторов в развитии обезвоживания.
- •42. Гипергидратация. Виды. Патогенез отеков при сердечной недостаточности.
- •43. Отеки. Патогенетические механизмы развития отеков. Патогенез токсического, голодного и почечного отеков.
- •44. Гипо- и гиперволемии. Причины, механизмы развития, последствия.
- •45. Респираторный ацидоз. Причины, механизмы развития. Роль буферных систем и органов в компенсации. Изменение показателей КОБ. Характеристика нарушений при некомпенсированной форме ацидоза.
- •49. Этиология опухолевого процесса. Виды канцерогенов. Эндо- и экзогенные канцерогены (физические, химические, биологические). Механизмы их воздействия.
- •50. Онковирусы. Их классификация. Роль вирусов в канцерогенезе.
- •51. Молекулярные механизмы канцерогенеза. Значение онкогенов в канцерогенезе.
- •52. Механизмы активации протоонкогенов. Роль онкобелков в канцерогенезе. Классификация онкобелков.
- •53. Опухолевый процесс. Определение понятия. Виды опухолей, признаки малигинизации. Понятие о предопухолевом состоянии.
- •54. Атипизм опухолевой ткани. Морфологический, биохимический, функциональный атипизм.
- •55. Механизмы антиканцерогенеза. Механизмы противоопухолевой резистентности организма.
- •56. Механизмы взаимодействия опухоли и организма. Опухолевая кахексия. Паранеопластические синдромы.
- •57. Молекулярные механизмы атеросклероза. Атерогенные дислипопротеидемии. Роль рецепторов к липопротеидам в регуляции обмена холестерина и в атерогенезе.
- •58. Атеросклероз. Значение нарушений нейроэндокринной регуляции в этиологии и патогенезе атеросклероза. Роль социальных факторов в развитии атеросклероза.
- •59. Нейрогенная теория атеросклероза (П.С. Хомуло). Этиология и патогенез. Эмоциональная реакции и эмоциональный стресс. Влияние эмоционального стресса на атерогенез.
- •60. Общая патология нервной системы. Формирование генератора патологически усиленного возбуждения как основной механизм патологической функциональной системы.
- •61. Функциональные нарушения высшей нервной деятельности. Экспериментальные неврозы. Значение типов нервных систем в возникновении неврозов (И.П. Павлов).
- •62. Эмоции и эмоциональные расстройства. Роль психоэмоционального напряжения в развитии соматической патологии.
- •65. Патология щитовидной железы. Классификация функциональных состояний. Эутиреоидное состояние щитовидной железы . Гипо- и гиперфункция щитовидной железы. Причины, признаки, механизмы развития.
- •66. Патология коры надпочечников. Гипо- и гиперфункция. Первичный и вторичный альдостеронизм. Причины, признаки, механизмы развития.
- •68. Значение и механизмы формирования срочной и долговременной адаптации.
- •69. Общий адаптационный синдром. Роль желез внутренней секреции в развитии общего адаптационного синдрома. Стадии стресса.
- •70. Стресс-факторы, стресс-реализующие системы. Механизмы стрессогенного повреждения различных органов и систем.
- •71. Адаптивные и дизадаптивные эффекты гормонов стресса (катехоламины, глюкокортикоиды). Болезни адаптации.
- •72. Стресс-лимитирующие системы. Виды, эффекты.
- •73. Понятие психоэмоционального стресса. Определение, причины, механизмы развития, роль в патогенезе психосоматических заболеваний.
- •74. Иммунодефицитные состояния и аллергия как типовые иммунопатологические процессы. Взаимосвязь аллергии и воспаления, аллергии и иммунитета.
- •75. Первичные (наследственные и врожденные) иммунодефициты. Виды, патогенез, проявления, последствия. Вторичные (приобретенные) иммунодефицитные состояния. Этиология, патогенез, последствия. СПИД, этиология, пути инфицирования, патогенез.
- •76. Аллергия и иммунитет. Общность и различия. Классификация аллергических реакций.
- •2. Патогенная роль реакций цитотоксического типа - реакция из иммунной переходит в аллергическую, повреждает и разрушает ткани, если направлена против клеток, которые стали аутоантигенными.
- •82. Лекарственная аллергия. Условия и механизмы развития.
- •83. Сердечная недостаточность. Определение, причины, классификация, механизмы развития. Интракардиальные механизмы компенсации сердечной недостаточности.
- •84. Недостаточность системы кровообращения. Определение, виды. Гемодинамическая характеристика видов недостаточности кровообращения.
- •85. Компенсаторные механизмы сердца. Понятие о гиперфункциях, виды, механизмы развития. Физическая нагрузка и гиперфункция сердца.
- •86. Острая левожелудочковая сердечная недостаточность. Клинические проявления. Виды, причины, механизмы развития.
- •87. Хроническая сердечная недостаточность. Клинические признаки и механизмы. Механизмы развития сердечной недостаточности при мио-, эндо- и перикардитах. Механизмы развития сердечной недостаточности при эндокринопатиях.
- •88. Коронарная недостаточность. Определение, классификация, причины, клинические проявления.
- •89. Инфаркт миокарда. Причины, механизмы развития, осложнения. ИБС. Определение. Стенокардия, классификация по патогенезу, механизмы развития.
- •93. Хроническая сосудистая недостаточность, гипотоническая болезнь. Определение, классификация, причины, механизмы развития.
- •95. Дизэритропоэтические анемии (железодефицитная, апластическая, сидероахрестическая). Причины, механизмы развития, картина крови.
- •96. Гемолитические анемии. Принципы классификации. Приобретенные и наследственные гемолитические анемии. Причины, механизмы развития, картина крови.
- •97. Острая кровопотеря. Механизмы компенсации. Постгеморрагические анемии (острые, хронические), механизмы развития, картина крови.
- •98. Лейкоцитозы. Классификация. Причины, механизмы развития. Сдвиги лейкоцитарной формулы.
- •99. Лейкемоидные реакции. Виды, этиология, патогенез. Отличие от лейкоза. Значение для организма.
- •100. Лейкозы. Классификации. Этиопатогенез, картина костного мозга и крови при острых и хронических лейкозах.
- •101. Лейкопении. Виды, причины, механизмы развития. Изменения в лейкоцитарной формуле (процентное содержание различных форм к общему числу лейкоцитов).
- •102. Патология внешнего дыхания. Механизм компенсации при нарушении внешнего дыхания. Одышка. Виды. Периодическое и терминальное дыхание. Причины, виды, механизмы развития.
- •103. Хроническая обструктивная болезнь легких (ХОБЛ). Эмфизема легких. Виды. Патогенез нарушения внешнего дыхания при эмфиземе.
- •104. Рестриктивные причины нарушения внешнего дыхания. Пневмоторакс. Виды. Патогенез нарушений внешнего дыхания при пневмотораксе.
- •105. Обструктивные причины нарушения внешнего дыхания. Ателектаз. Виды. Патогенез нарушений внешнего дыхания при ателектазе.
- •106. Нарушение секреторной и моторной функции желудка. Причины, механизмы развития, последствия.
- •107. Нарушение пищеварения в тонком кишечнике. Пристеночное пищеварение и его нарушения. Причины, механизмы развития, последствия.
- •Характеристика билирубинового обмена
- •113. Нефротический синдром. Причины, механизмы развития, последствия, профилактика.
- •114. Острая почечная недостаточность. Формы, этиология, механизмы развития, последствия.
- •115. Хроническая почечная недостаточность. Причины, стадии, механизмы развития. Уремия.
- •116. Гломерулонефриты. Патогенетическая классификация. Клинические проявления, принципы лечения.
- •118. Кома. Виды комы. Этиология, патогенез. Нарушение функций организма при коматозных состояниях.
- •Патогенез и нарушение функции
- •Задача №20
- •Задача №26
- •Задача №44
- •Задача №54
- •Задача №55
Выступают в роли модуляторов и ограничивают эффекторные повреждающие механизмы гормонов на клеточно-молекулярном уровне.
Простагландины гр Е – их продукция возрастает при стресс-реакции, тк глюкокортикоиды вызывают активацию ПОЛ и выход лизосомальных ферментов, в тч фосфолипазы А2, которая участвует в образовании арахидоновой кислоты. ПГ Е снижают чувствительность тканей к действию катехоламинов (за счет уменьшения конц-ции свободных адренорецепторов).
Антиоксидантная система -при действии глюкокортикоидов активируется ПОЛ, в рез-те образуются свободные радикалы. Антиоксиданты: супероксиддисмутаза, витамин Е останавливают свободнорадикальные процессы в клетке.
73. Понятие психоэмоционального стресса. Определение, причины, механизмы развития, роль в патогенезе психосоматических заболеваний.
Психоэмоциональный стресс является защитно-приспособительной реакцией, мобилизующей организм на преодоление разнообразных, нарушающих жизнедеятельность, препятствий, при возникновении многих конфликтных ситуаций, в которых субъект ограничен в возможностях удовлетворения своих основных жизненно важных биологических и социальных потребностей.
Причины развития.
1.Постоянная нагрузка на эмоциональную сферу – непрерывное повторяющееся действие стрессоров, требующих устранения их действия. Например, информационные перегрузки высшего медицинского образования.
2.Невозможность удовлетворения потребности в конкретных условиях, особенно если потребность для человека имеет жизненно важное значение. Например, невозможность поступить в медицинский ВУЗ человеку с медицинским призванием.
3.Неправильно принятое решение, на основании которого сформирована система, не способная удовлетворить доминирующую мотивацию. Например, нелюбимая профессия.
4.Неблагоприятный прогноз удовлетворения потребности в силу слабости системы или недостаточной информации. Например, отсутствие сведений о семье во время полярной зимовки.
5.Неспособность ЦНС создать функциональную систему адаптации вследствие слабости нервных процессов, особенно, недостаточности торможения. Например, низкие интеллектуальные способности при чрезмерном честолюбии.
Механизм развития.
1.Вначале происходит возбуждение дорсомедиальной части миндалевидного ядра (одного из центральных образований лимбической системы).
2.Из миндалевидного ядра поток импульсов идет к эрготропным ядрам гипоталамуса, оттуда импульсация направляется к грудному отделу спинного мозга, а затем к мозговому слою надпочечников.
3.В ответ происходит выброс адреналина и норадреналина, в результате возрастает АД, увеличивается сердечный выброс, снижается кровоток в неработающих мышцах и органах, возрастает уровень свободных жирных кислот (активация липолиза), уровень триглицеридов, холестерина, глюкозы.
Адренокортикальный механизм включает в себя следующую цепь событий: активация неокортекса, септальногипоталамического комплекса (выделение кортиколиберина), передней доли гипофиза (выделение АКТГ, стимуляция коры надпочечников и выделение глюкокортикоидов и частично минералокортикоидов (альдостерона). Глюкокортикоиды вызывают повышение энергетических запасов:
возрастает уровень глюкозы (за счет глюконеогенеза) и свободных жирных кислот.
Однако чрезмерное выделение глюкокортикоидов приводит одновременно и к нежелательным эффектам (это называют платой за адаптацию). Наблюдается триада морфологических проявлений: гипертрофия коры надпочечников, инволюция тимико-лимфатической системы и временное появление язв желудка и двенадцатиперстной кишки.
В развитии общего адаптационного синдрома (стресс-реакции) отмечается последовательное развитие стадий тревоги, резистентности и истощения.
I. Стадия тревоги - кратковременная стадия (от 6 до 48 ч), обусловленная перестройкой эндокринной функции организма, связана с увеличенным выбросом в кровь адреналина и глюкокортикоидов, преобладанием катаболических процессов. Уменьшаются размеры тимуса, селезенки, лимфоузлов, количества жировой ткани, появляются эрозии в ЖКТ, снижается содержание эозинофилов в крови и липидов в коре надпочечников.
II. Стабильно увеличенная концентрация адреналина и глюкокортикоидов в крови свидетельствует о наступлении стадии резистентности. Наступает гипертрофия надпочечников. Эта стадия и определяет адаптивный эффект стресс-реакции.
III. Если стрессор был чрезвычайно сильным или его действие не прекращалось длительное время, может развиться 3 стадия - стадия истощения. Она связана с функциональной недостаточностью надпочечников. При этом возвращаются симптомы, характерные для I стадии (фаза шока), но теперь они носят необратимый характер, что может привести к гибели организма. Во внутренней среде происходит не только нарушение гомеостаза, но и
развивается полиорганная недостаточность с преобладанием катаболических и некротических изменений в органах и тканях.
Продолжительное эмоциональное напряжение опасно, так как создаются условия для патогенного влияния содержания эмоций на ЦНСневрозы, психозы и на вегетативную нервную системуисточник различных соматических заболеванийгипертоническая болезнь, ишемическая болезнь сердца и мозга, сахарный диабет, язвенная болезнь.
Примеры:
Механизм стрессогенного повреждения миокарда: перегрузка клеток Са ++ и увеличение свободнорадикальных форм жирных кислот приводит к повреждению клеточных мембран и нарушению структуры и функции клеток. Механизм стрессогенных язв в ЖКТ: Длительная мобилизация энергетического и пластического материала при перераспределительном характере кровотока создает условия для ишемических повреждений «неработающих органов».
Длительный ведет к развитию стрессогенного иммунодефицита (глюкокортикоиды обладают иммунодепрессивным эффектом), который в сочетании с экспрессией протоонкогенов может являться одним из механизмов онкогенного эффекта стресса.
Доп про психосоматические заболевания: К таким заболеваниям относят: ишемическую болезнь сердца, артериальную гипертонию, язвенную болезнь желудка и двенадцатиперстной кишки, бронхиальную астму, неспецифический язвенный колит, ревматоидный артрит, нейродермит, тиреотоксикоз, сахарный диабет и некоторые другие.
Как пример экзаменатору рассказать при ИБС, ЯБЖ и ДПК, ГБ (это описано в вопросе 70)
74.Иммунодефицитные состояния и аллергия как типовые иммунопатологические процессы. Взаимосвязь аллергии и воспаления, аллергии и иммунитета.
Основу иммунопатологии составляет неспособность иммунной системы выполнять присущие ей в норме защитные функции. Нарушения ее функций могут проявляться в виде гипер-, гипо-, дисфункции, в изменениях толерантности к антигенам.
Классификация типовых нарушений иммунологической реактивности:
·иммунодефициты;
·аллергия;
·аутоиммунные заболевания;
·патологическая толерантность;
·реакция «трансплантат против хозяина».
1.Гиперфункция иммунной системы может развиваться: при поступлении в организм стимуляторов иммунного ответа; при наследственных изменениях синтеза антител, обусловливающих усиленный иммунный ответ на какой-либо антиген; при нарушении регуляторных влияний внутри иммунной системы, а также при формировании опухолей из клеток иммунокомпетентной ткани.
2.При гипофункции иммунной системы развиваются иммунодефицитные состояния. Иммунодефициты — это состояния, обусловленные функциональной недостаточностью иммунной системы вследствие отсутствия либо снижения уровня одного или нескольких факторов иммунной системы. Одним из наиболее частых проявлений иммунодефицита являются рекуррентные и/или оппортунистические инфекции. Про них подробно в 75 вопросе
3.При дисфункции иммунной системы в организме создаются условия для развития аллергии.
Дисфункция может развиваться вследствие нарушения дифференцирования или кооперации лимфоцитов и АГ-представляющих клеток.
Определение из лекции: Аллергия — типовая иммунопатологическая реакция сенсибилизированного организма, проявляющаяся в виде повреждения клеток и вызванных им патологических реакций в ответ на повторный контакт с аллергеном (АГ) и образование комплекса АГ+АТ. Подробно про нее в 76 вопросе.
Для проведения взаимосвязи между аллергией и воспалением и аллергией и иммунитетом, как просят в билете, наверное лучше всего запомнить эту схему (давалась в лекции):
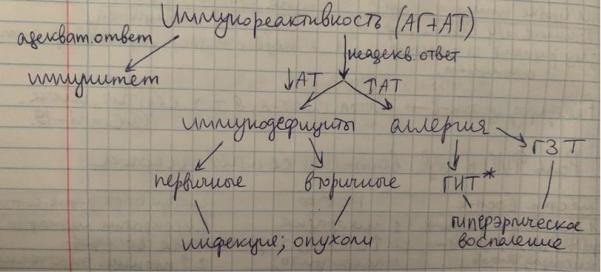
Под * я расшифровывала, что ГНТ-гиперчувствительность немедленного типа, а ГЗТзамедленного.
Аллергия и иммунитет имеют защитный характер и направлены на поддержание гомеостаза организма, при этом на стадии сенсибилизации они имеют общие механизмы развития.
Условия перехода иммунной реакции в аллергию:
1.Нарушение барьерной функции покровных тканей в сенсибилизированном организме.
2.Изменение количественного/качественного характера иммунного ответа (примердисбаланс соотношения АГ и АТ, гиперпродукция IgE, IgG4).
3.Особенности молекул и биохимических процессов в иммунных клетках (примервыделение медиаторов или дисбаланс цитокинов при реагиновой аллергии).
4.Нарушение нейроэндокринных механизмов регуляции иммунной системы (примервзаимодействие гипоталамо-гипофиз-надпочечниковой системы с иммунной системой)
Отличие аллергии от иммунитета заключается в том, что аллергия является патологической формой иммунологической реактивности, это патологическое течение иммунного ответа, которое сопровождаетс повреждением тканей организма.
75. Первичные (наследственные и врожденные) иммунодефициты. Виды, патогенез, проявления, последствия. Вторичные (приобретенные) иммунодефицитные состояния. Этиология, патогенез, последствия. СПИД, этиология, пути инфицирования, патогенез.
С прошлого вопроса мы уже знаем, что иммунодефициты — это изменения иммунного статуса, обусловленные дефектом одного или нескольких механизмов иммунного ответа. При них происходит снижение функциональной активности основных компонентов иммунной системы, что ведет к нарушению защиты организма от микробов и проявляется в
повышенной инфекционной заболеваемости. Различают первичные (наследственные) и
вторичные (приобретенные) иммунодефицитные состояния. ПЕРВИЧНЫЕ ИММУНОДЕФИЦИТЫ (ИД)
Первичные ИД связаны с генетическими дефектами в развитии иммунной системы, которые рано или поздно приводят к тем или иным проявлениям иммунологической недостаточности.
В зависимости от локализации дефекта в том или ином звене системы иммунитета выделяют следующие первичные ИД:
1.Дефицит гуморального иммунитета: сцепленная с Х-хромосомой гипо-, агаммаглобулинемия (Брутона); общий вариабельный иммунодефицит и тд.
2.Дефицит клеточного звена иммунитета: синдром Ди Джорджи (гипо-, аплазия тимуса); хронический генерализованный кандидоз кожи и слизистых оболочек.
3.Комбинированные Т- и В-иммунодефициты: тяжелый комбинированный иммунодефицит; атаксия-телеангиэктазия (синдром Луи-Бар).
4.Нарушения неспецифической резистентности: дефицит системы фагоцитов (хронический
гранулематоз); дефицит системы комплемента (врожденный ангионевротический отек). Клиническая картина первичных ИД имеет общие черты:
·рецидивирующие и хронические инфекции дыхательных путей, придаточных пазух носа, кожи, слизистых оболочек, ЖКТ, вызываемые условно-патогенными микроорганизмами, простейшими, грибами, имеющие тенденцию к генерализации, септицемии;
·гнойно-воспалительные заболевания;
·нарушения в периферической крови: лейко-, тромбоцитопении, анемии;
·аутоиммунные расстройства: артриты, склеродермия, хронический активный гепатит, тиреоидит;
·аллергические реакции в виде экземы, отека Квинке;
·опухоли и лимфопролиферативные заболевания;
·пороки развития;
·расстройства пищеварения, диарейный синдром, синдром мальабсорбции.
ВТОРИЧНЫЕ ИММУНОДЕФИЦИТЫ Вторичные ИД — это нарушения в иммунной системе, не являющиеся результатом генетических
дефектов. Иммунологическая недостаточность развивается вследствие эндо- и экзогенных воздействий на нормальную иммунную систему.
I. По скорости развития вторичные ИД подразделяются на следующие: – острые (обусловлены острым инфекционным заболеванием, травмой, интоксикацией и др.); – хронические (развиваются на фоне хронических воспалительных заболеваний, аутоиммунных нарушений, опухолей и т. д.).
II. По локализации дефекта: 1) нарушение клеточного иммунитета (Т-звена); 2) нарушение гуморального иммунитета (В-звена); 3) нарушение системы фагоцитов; 4) нарушение системы комплемента; 5) комбинированные дефекты.
Этиология и патогенез вторичных иммунодефицитов
Инфекционные заболевания: – вирусные инфекции (СПИД, корь, краснуха, грипп, эпидемический паротит, инфекционный мононуклеоз, ветряная оспа, герпес, вирусные гепатиты); – бактериальные инфекции (стафилококковая, пневмококковая, менингококковая, туберкулез и др.); – протозойные инвазии и гельминтозы (малярия, токсоплазмоз, лейшманиоз, трихинеллез, аскаридоз и т. д.).
При бактериальных инфекциях экзо- и эндотоксины микроорганизмов способны подавлять фагоцитоз, влиять на внутриклеточные биохимические процессы.
Наиболее активное воздействие на иммунную систему оказывают вирусные инфекции, около 90 % которых сопровождается транзиторной иммунодепрессией. Некоторые вирусы могут непосредственно поражать лимфоциты (вирус Эпштейна–Барр, ВИЧ, цитомегаловирусная инфекция).
Важную роль в развитии вторичных ИД при инфекционных заболеваниях играет нарушение механизмов иммунорегуляции. Нарушения питания: – дефицит белка (голодание, недостаточное содержание в пище, нарушение всасывания, нефротический синдром); – дефицит микроэлементов (железо, цинк, медь, селен); – дефицит витаминов (ретинол, аскорбиновая кислота, альфатокоферол, фолиевая кислота):
·При недостаточном поступлении с пищей белков, витаминов, минеральных веществ может наблюдаться снижение количества лимфоцитов и уровня Ig, нарушение функции Т-лимфоцитов, угнетение фагоцитарной активности.
·Дефицит железа приводит к нарушению выработки лимфокинов Т-лимфоцитами, подавлению активности миелопероксидазы нейтрофилов, снижению продукции гидроксильных радикалов и появлению наклонности к рецидивирующим инфекциям.
·При недостаточном поступлении в организм цинка снижается пролиферативная активность лимфоцитов. Этот микроэлемент необходим для нормального функционирования гранулоцитов и NKклеток.
·При нехватке меди может наблюдаться снижение фагоцитарной активности, нейтропения.
·Дефицит селена и магния может стать причиной снижения уровня иммуноглобулинов.
Прочие факторы:
·Травмы и хирургические вмешательства.
·Нарушение функции барьеров (кожа) и фагоцитирующих клеток.
·Эндогенные интоксикации (почечная и печеночная недостаточность). У больных с нефротическим синдромом потеря иммуноглобулинов и белков комплемента увеличивает частоту бактериальных инфекций.
·Экзогенные интоксикации (хронический алкоголизм). Длительное употребление этанола приводит к подавлению всех видов и реакций иммунитета.
·Физические факторы (ионизирующие, электромагнитные, ультрафиолетовые излучения, высокая и низкая внешняя температура).
·Пестициды: – хлорорганические соединения вызывают лимфопению;
·Фосфорорганические соединения вызывают атрофию вилочковой железы, уменьшают активность T- лимфоцитов, подавляют образование антител;
·Содержащие металлы органические соединения: – метилированная ртуть угнетает активность системы комплемента
·Тяжелые металлы: подавляют кроветворение в костном мозге, вызывают лимфопению;
·Ятрогенные факторы. Угнетение функции иммунной системы может быть следствием применения химиопрепаратов, цитостатиков, кортикостероидной терапии.
·Стрессовые воздействия (психические травмы, физические перегрузки). При стрессовых воздействиях надпочечники выделяют большие количества гормонов, которые подавляют функцию иммунной системы.
·Наиболее выраженное снижение иммунитета наблюдается в случае злокачественных заболеваний крови (лейкозы, лимфомы, тимома, лимфогранулематоз и др.).
·Нарушения обмена веществ (сахарный диабет, ожирение). При сахарном диабете снижаются адгезивные и бактерицидные свойства лейкоцитов, нарушается хемотаксис, недостаточность микроциркуляции приводит к изъязвлению кожных покровов, вследствие чего развивается предрасположенность к грибковым и бактериальным инфекциям.
·Снижение иммунной защиты у лиц старческого возраста, беременных женщин и детей.
СПИД
Вспомним микробиологию) Возбудитель ВИЧ инфекции из подсемейства лентивирусов, семейства ретровирусов. В настоящее время различают 2 вида: ВИЧ-1 и ВИЧ-2. Вирус состоит из белковой оболочки, на которой находятся рецепторы. Основной рецептор гликопротеид 120 (gp-120). Внутри оболочки находится ядро, состоящее из 2 молекул РНК и фермента ревертазы (обратная транскриптаза). Вирус живёт и размножается только в живой клетке. Неустойчив во внешней среде. При температуре +70 +80 погибает через 10 минут. При кипячении погибает через 1-2 минуты. При воздействии дезинфицирующих средств погибает через 10 минут. Ферменты ЖКТ, слюна и пот инактивируют вирус. У инфицированного человека вирус находится во всех биологических жидкостях, во всех тканях и органах, но наибольшая концентрация находится: в крови, сперме, во влагалищном содержимом, в ликворе, в костном мозге, в молоке кормящей матери. Источником заражения является только человек ВИЧ инфицированный или больной.
Факторы передачи ВИЧ/СПИД:
·Биологические жидкости человека.
·Мед инструмент инфицированный вирусом.
·Предметы личной гигиены: бритвенные приборы, маникюрные наборы, зубные щётки и зубочистки, расчёски.
Пути передачи ВИЧ/СПИД:
·Половой
·Парентеральный
·Вертикальный от инфицированной матери к ребёнку через плаценту во время беременности,
во время родов при прохождении через родовые пути, при кормлении грудью. Патогенез ВИЧ/СПИД:
Вирус ВИЧ проникает в организм только через повреждённые кожные покровы и слизистые оболочки. Вирус в основном поражает Т-4 лимфоциты потому, что рецептор Т-4 лимфоцитов сходен по структуре с рецептором вируса. Благодаря этому сходству вирус беспрепятственно проникает в Т-4 лимфоциты. В результате происходит размножение вируса, а лимфоциты погибают.
У здорового человека количество Т-4 лимфоцитов составляет от 800 до 1200 клеток в одном мкл крови. При снижении Т-4 лимфоцитов от 700 клеток до 500 иммунная система ослабевает, и всё же может справится с инфекцией. При количестве Т-4 лимфоцитов от 499-200 клеток иммунная система резко ослабевает, в любой момент возможно развитие любой оппортунистической инфекции. При снижении Т-4 лимфоцитов меньше 200 клеток иммунная система полностью блокирована, человек беззащитен перед любой инфекцией или опухолью.
1.Инкубационный период длится с момента проникновения вируса в организм человека и до образования антител. Длительность его от 2-3 недель до 1 года, в среднем 2-3 месяца.
2.Острая фаза отмечается у половины ВИЧ инфицированных. Это первичный ответ на образование антител. Основной симптом - лимфаденопатия. Слабость, ночная потливость, длительный субфебрилитет. Также могут быть различные высыпания на слизистой оболочке и кожных покровах, напоминающие инфекционный мононуклеоз или краснуху. Могут быть артралгии, миалгии, кандидоз полости рта. Острая фаза длится от нескольких недель до 2-3 месяцев, иногда дольше.
3.Бессимптомная стадия. Человек чувствует себя хорошо, и не считает себя больным. Единственный симптом, может быть, увеличение лимфоузлов, если они были увеличены в острую
