
- •Охарактеризувати предмет, завдання та основні методи психології вищої школи
- •2. Обґрунтувати навчально-професійну діяльність студента як провідну.
- •3. Пояснити суперечливості та кризи студентського віку
- •4. Розкрити адаптацію студента до навчання у вищій школі, та психологічні умови її ефективності
- •5. Пояснити зміст поняття творчості як умови самореалізації особистості у вищій школі
- •6. Пояснити психологічні особливості управління навчально-виховним процесом у закладах вищої освіти
- •7. Проаналізувати психологічні особливості студентської групи та її структуру
- •8. Проаналізувати психологічні бар’єри в професійно-педагогічному спілкуванні викладачів і студентів
- •9. Пояснити психологічний зміст і основні прояви професійного стресу та синдрому «професійного вигорання» учасників освітнього процесу закладів вищої освіти
- •10. З’ясувати психологічні передумови успішності та неуспішності студентів у навчально-професійній діяльності
- •11. Андрагогіка як галузь педагогічної науки
- •Мета підготовки фахівця у вищій школі. Мета виховання у вітчизняній і зарубіжній педагогіці
- •Українська етнопедагогіка як джерело розвитку педагогічної науки і практики
- •Поняття і завдання дидактики вищої школи
- •Сутність процесу навчання у вищій школі
- •Методи і засоби навчання у вищому навчальному закладі
- •Формування (виховання, розвиток) фахівця
- •Виховальні відносини викладача і студентів у вищій школі, засоби їх забезпечення
- •Методи і форми виховання у вищому навчальному закладі
- •Тьюторський підхід у діяльності викладача
- •21. Зміст навчання хімії у старшій і вищій школі.
- •22.Методи навчання хімії у старшій і вищій школі.
- •23. Програмоване навчання хімії у старшій і вищій школі.
- •24.Організаційні форми навчання хімії у старшій і вищій школі.
- •25. Лабораторний практикум і його роль в навчанні хімії у старшій і вищій школі.
- •26. Самостійна робота здобувачів освіти у навчанні хімії.
- •27. Засоби навчання хімії.
- •28. Контроль за засвоєнням хімічних знань у старшій і вищій школі.
- •29. Інноваційні технології навчання хімії.
- •30. Сучасні форми і методи оцінювання у старшій і вищій школі.
- •31. Будова атома. Будова матерії.
- •32. Будова молекул і хімічний зв’язок.
- •33. Симетрія молекул.
- •34. Кислоти і основи.
- •35. Окиснення і відновлення. Окисно-відновні потенціали.
- •36. Стереоізомерія.
- •37. Енергетика хімічних реакцій.
- •38. Механізми хімічних реакцій.
- •39. Фізико-хімічні методи дослідження речовин.
- •40. Будова атома Карбону.
- •41. Природа хімічних зв'язків.
- •42. Сучасні уявлення про взаємний вплив атомів у молекулі. Індукційний ефект.
- •Індуктивний (індукційний)ефект
- •43. Мезомерний ефект.
- •44. Ізомерія органічних сполук.
- •45. Кислотно-основні властивості органічних сполук
- •46. Ароматичність
- •47. Гетероциклічні ароматичні системи.
- •48. Основи теорії хімічних перетворень
- •49. Заміщення біля атому Карбону.
- •50. Електрофільне і нуклеофільне заміщення в ароматичному ряду.
- •Електрофільне заміщення в ароматичних сполуках проходить у три етапи.
- •51.Поняття хімічної номенклатури
- •52. Номенклатура неорганічних сполук.
- •53. Номенклатура iupac органічних сполук.
- •54. Сучасний хіміко-аналітичний контроль
- •55. Пробовідбір і пробопідготовка.
- •56. Концентрація і розподіл як стадії пробопідготовки.
- •57. Аналіз вод.
- •58. Аналіз повітря
- •59. Аналіз грунтів та донних відкладень.
- •60.Визначення екотоксикантів
- •61. Аналіз біологічних матеріалів.
- •62. Аналіз геологічних об'єктів.
- •63. Аналіз харчових і сільськогосподарських продуктів.
- •64.Відмінності якісного та кількісного аналізу органічних сполук від аналізу неорганічних речовин
- •65. Підготовка речовини до аналізу
- •66. Визначення фізичних констант
- •67. Елементний аналіз.
- •68.Ідентифікація органічних речовин
- •69. Якісний функціональний аналіз
- •70. Кількісний функціональний аналіз
- •71. Основи класичної теорії хімічної будови
- •72. Фундаментальні складові матеріальних об’єктів
- •73. Симетрія молекулярних систем
- •74. Поляризація молекул
- •75. Електричні та магнітні властивості атомів і малих молекул
- •76. Двохатомні молекули. Багатоатомні молекули
- •77. Будова і властивості твердих тіл
- •78. Математична модель хімічних перетворень
- •79. Молекулярна енергетика горіння
- •80. Каталіз та каталізатори. Вивчення впливу неорганічних каталізаторів та ферментів на перебіг хімічних реакцій.
- •81. Біогенний обмін речовин у біосфері
- •82. Жива речовина біосфери та її біогеохімічні функції
- •83.Газова функція живої речовини та біогенний кугооіг води
- •84. Концентраційна функція живої речовини
- •85. Окисно-відновна функція живої речовини
- •86. Значення хімічних елементів у житті живих організмів
- •87. Вплив геохімічного середовища на розвиток та хімічний склад рослин.
- •88. Біогеохімічне районування
- •89. Біологічний та біогеохімічний кругообіги елементів у біосфері
- •90. Ноосфера як етап розвитку біосфери
67. Елементний аналіз.
За зовнішнім виглядом не завжди можна відрізнити органічні речовини від неорганічних. Для попереднього визначення використовують прожарювання. Органічні речовини за прожарювання перетворюються на газуваті сполуки й повністю випаровуються. Більшість неорганічних речовин за прожарювання утворюють сухий залишок.Після одержання органічну речовину перевіряють на чистоту(за фізичними константами) та проводять якісний елементний аналіз. Визначивши якісний склад, а потім кількісний, виводять найпростішу формулу сполуки.. Потім за допомогою якісних реакцій визначають функціональні групи.
В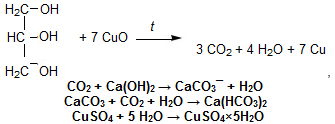 ідкриття
Карбону і Гідрогену. У
суху пробірку з газовідвідною трубкою
вносять суміш досліджуваної речовини
(гліцерол) з купрум(ІІ) оксидом і
закріплюють її горизонтально. Кінець
газовідвідної трубки занурюють у другу
пробірку, заповнену вапняною або
баритовою водою. Спочатку суміш нагрівають
повільно, потім дужче. Помутніння
вапняної води свідчить про наявність
СО2. Надлишок СО2 розчинює осад. Якщо
досліджувана речовина містить Гідроген,
то утворюється вода, яку можна визначити,
пропускаючи пару у пробірку робірку з
безводним CuSO4.
Утворюється мідний купорос голубого
кольору .
ідкриття
Карбону і Гідрогену. У
суху пробірку з газовідвідною трубкою
вносять суміш досліджуваної речовини
(гліцерол) з купрум(ІІ) оксидом і
закріплюють її горизонтально. Кінець
газовідвідної трубки занурюють у другу
пробірку, заповнену вапняною або
баритовою водою. Спочатку суміш нагрівають
повільно, потім дужче. Помутніння
вапняної води свідчить про наявність
СО2. Надлишок СО2 розчинює осад. Якщо
досліджувана речовина містить Гідроген,
то утворюється вода, яку можна визначити,
пропускаючи пару у пробірку робірку з
безводним CuSO4.
Утворюється мідний купорос голубого
кольору .
В ідкриття
Нітрогену. в)
загальний метод відкриття Нітрогену
(проба Ласеня) можна використовувати
для будь-якихсполук. Дослід проводити
у витяжній ша-фі!Упробірку вміщують
~0,1 г досліджуваної речовини (сечовини,
амінокислоти або ін.) та шматочок (з
півгорошини) очищеного від гасу
металічного натрію. Суміш обережно
нагрівають на газовому пальнику до
появи білого диму, потім пробірку
забирають з полум’я(проходить бурхлива
реакція). Після реакції пробірку ще
трохи нагрівають, а потім охолоджують,
суміш розчиняють у 3…4 мл дистильованої
води, доливають свіжопрокип’ячений
насичений розчин FeSO4
і підкислюють соляною кислотою. Утворення
берлінської лазурі (синього кольору)
після додавання 2…3 крапель FeCl3
свідчить про наявність Нітрогену в
сполуці. Реакції, які протікають при
цьому, схематично можна записати так:
ідкриття
Нітрогену. в)
загальний метод відкриття Нітрогену
(проба Ласеня) можна використовувати
для будь-якихсполук. Дослід проводити
у витяжній ша-фі!Упробірку вміщують
~0,1 г досліджуваної речовини (сечовини,
амінокислоти або ін.) та шматочок (з
півгорошини) очищеного від гасу
металічного натрію. Суміш обережно
нагрівають на газовому пальнику до
появи білого диму, потім пробірку
забирають з полум’я(проходить бурхлива
реакція). Після реакції пробірку ще
трохи нагрівають, а потім охолоджують,
суміш розчиняють у 3…4 мл дистильованої
води, доливають свіжопрокип’ячений
насичений розчин FeSO4
і підкислюють соляною кислотою. Утворення
берлінської лазурі (синього кольору)
після додавання 2…3 крапель FeCl3
свідчить про наявність Нітрогену в
сполуці. Реакції, які протікають при
цьому, схематично можна записати так:
Відкриття Сульфуру. б) загальний метод, придатний для всіх сульфурвмісних сполук, базується на спалюванні речовини в присутності металічного натрію. При цьому утворюється натрій сульфід.У суху пробірку кладуть ~0,1 г досліджуваної речовини і шматочок(з півгорошини) очищеного від гасу та сполуки окиснення металічного натрію. Суміш нагрівають у витяжній шафі. Пробірку охолоджують. Одержаний залишок, який містить Na2S, розчиняють у 3…4 мл дистильованої води. Розчин розливають у дві пробірки і в одній з них відкривають Сульфур плюмбум(ІІ) ацетатом, у другій – натрій нітропрусидом.Відкриття галогенів. загальний метод дає можливість відкривати Хлор, Бром, Йод. Він ґрунтується на сплавленні речовини з металічним натрієм. Утворюється натрій галогенід, який відкривають за допомогою арґентум) (нітрату (утворення осаду):NaHal + AgNO3 ® AgHal ¯ + NaNO3У суху пробірку вміщують ~0,1 г досліджуваної речовини та шматочок (з півгорошини) очищеного металічного натрію. Суміш обережно нагрівають на газовому пальнику у витяжній шафі. Пробірку охолоджують, розплав, який містить галогенід натрію, розчиняють у 2…3 мл води і додають НNO3. У пробірку наливають розчин арґентум) нітрату(І , з’являються помутніння або осад арґентум)(І галогеніду: AgCl – білий, AgBr – жовтуватий, AgІ – жовтий.
