
- •Ферменты
- •Методы разделения смесей белков. Значение хроматографического иэлектрофоретическогоисследованиябелковплазмыкрови.Белковыефракцииплазмыкрови,причиныих изменения.
- •Электрофорезбелков
- •Значение
- •5.Ферменты:строение,(рольвитаминовиминералов).Отличие
- •Составфермента
- •Механизмдействияфермента.
- •Теорияфермент-субстратногокомплекса.
- •Основныевидырегуляцииактивностиферментовмедленныйтипрегуляции
- •Быстрыйтипрегуляции
- •Аллостерия
- •Ковалентная,химическаямодификация
- •Ингибированиеиактивацияферментов,механизмы.Примерыингибиторовиактиваторов.Ограниченныйпротеолиз.
- •Какие ферменты необходимо определить в крови для контроля засостояниемздоровьялиц,контактирующихсокислителями,
- •Значение определения активности аминотрансфераз, принципыопределения.
- •Другиеиндикаторныеферментыплазмы:
- •Значениеопределенияизоферментногоспектравдиагностике
- •9.Использованиеферментативныхтестоввдиагностике.Принципидиагностическое значение определения активности холинэстераз.
- •Необратимого действия). Ингибиторы, как лекарственныепрепараты.
- •Дляизученияактивностихолинэстеразыиспользуютразличныеспособы:
- •Клинико-диагностическоезначение
- •Ингибиторыхолинэстераз.
- •Ингибиторыкаклекарственныесредства.
- •Значение определения активности дегидрогеназ в крови. Примерыспецифических ингибиторов дегидрогеназ и механизмы их действия.Принципметода определенияактивностидегидрогеназ.
- •Такжеиспользуетсядля:
- •ДляисследованияразличныхдегидрогеназиспользуютметодНахласавмодификациях, основанный на реакции восстановления солей тетразолия и выпаденияосадкадиформазанасинегоцветавместах активностиферментов.
- •Активность каких ферментов и белков плазмы крови следуетопределить для диагностики инфаркта миокарда? Значениеизмененияэтих показателейвдинамике.
- •Времяпослеинфаркта
- •ВитаминыгруппыВ:в1,в2,в6,рр(в3),биотин,пантотеноваякислота(в5),строение,биохимическаяфункциякаждого витамина.
- •ВитаминРр(никотиноваякислота,никотинамид,витаминB3)
- •Пантотеноваякислота(витаминB5)
- •ВитаминВ6(пиридоксин,пиридоксаль,пиридоксамин)
- •Биотин(витаминН)
- •ВитаминС,егоформы.БиохимическиефункциивитаминаС.Клиника авитаминоза.
- •Жирорастворимыевитамины,строение,биохимическиефункции.Жирорастворимыевитаминыкакантиоксиданты.
- •ВитаминыгруппыD(кальциферолы)
- •ВитаминыгруппыЕ(токоферолы)
- •Токоферолыпредставляютсобоймаслянистуюжидкость,хорошорастворимуюворганическихрастворителях.
- •ВитаминыК(нафтохиноны)
- •Примеры:
- •Вкачествепромежуточныхпереносчиковэлектроноввыступаютубихинон(коэнзимQ)ицитохромс.
- •Субстратное и окислительное фосфорилирование. Привестипримерыреакции,биологическаяроль.СинтезАтф.Рольмагниявпроцессах сучастиемАтф
- •Сахаразо-изомальтазныйкомплекс
- •Гликоамилазныйкомплекс
- •Совместноедействиевсехперечисленныхферментовзавершаетперевариваниепищевыхолиго-иполисахаридовсобразованиеммоносахаридов,основнойизкоторых
- •Формулысубстратов:
- •Мальтоза
- •18.Этапыаэробногодихотомическогоокислениеглюкозы.Характеристика и биологическая роль каждого процесса.Регуляцияаэробногодихотомическогоокисленияглюкозы.
- •Энергетическаяценностьаэробногоокисленияглюкозы:
- •19. Дихотомический анаэробный путь окисления углеводов, его этапы,биологическая роль. Написать соответствующие реакции. Механизмразвитияацидозапригипоксии.
- •Ацидозпригипоксии.
- •Путиобразованияииспользованияоксалоацетатавклетке.
- •Глюконеогенез.Напишитереакции.СвязьсгликолизомиЦтк.Биологическаяроль.Гормональнаярегуляцияпроцесса.
- •Распадгликогенадопирувата,биологическаяроль,регуляцияпроцесса.
- •Затемдальнейшеепревращениеглюкозывпируватидетвгидролизе.
- •Цикл трикарбоновых кислот, биохимические функции. Связь сорнитиновымциклом.Пластическая,энергетическаяфункцииЦтк.
- •ФункцииЦтк
- •25.Взаимосвязьуглеводногоибелковогообменов(наличиеобщихметаболитов,путиих превращения).
- •Апотомическоеокислениеглюкозы(написатьреакциидостадииобразованияпентоз).Биохимическаяфункция.Связьсантиоксидантнойидетоксицирующейсистемами.
- •Пентозофосфатныйпутьвыполняетворганизмедвеважнейшиеметаболическиефункции:
- •Какие биохимические изменения характерны для сахарного диабета?Биохимическиетесты,используемыедлядифференциальнойдиагностики инсулинзависимого и инсулиннезависимого сахарногодиабета.
- •Инсулинзависимыйсахарныйдиабет
- •Инсулинонезависимыйсахарныйдиабет
- •Диагностика:
- •Классификациялипидов.Строениеибиологическаярольфосфолипидов.Синтезфосфолипидов.Пищевыефакторы,необходимыедляполноценногосинтезафосфолипидоввклеткахорганизма.
- •Классификациялипидов
- •Состав.
- •Биороль:
- •Полиненасыщенные жирные кислоты, строение,- 6 и- 3 жирныекислоты,образованиеэйкозаноидов.Путибиотрансформацииарахидоновойкислотыи3-жирныхкислотворганизме,биологическаяроль.
- •Источники
- •Полиненасыщенныежирныекислотыобладаютвесьмаширокимифункциями:
- •Перевариваниеивсасываниелипидоввжелудочно-кишечномтракте. Роль желчных кислот. Ресинтез липидов в стенке кишечника.Транспортэндогенныхлипидов.
- •Эмульгированиежиров
- •Гормоны,активирующиеперевариваниежиров.
- •Желчныекислоты,образование,строение,рольворганизме.
- •Рольжелчи
- •Этапыокисленияжирныхкислот
- •Регуляциялипогенеза.
- •ЧелночныймеханизмпереносаАцетил-КоА.
- •Такимобразом,переносодноймолекулыацетилКоАизмитохондриив
- •Регуляциясинтеза
- •Ингибирование.
- •35.Липопротеиныплазмыкрови.Методыразделения.Классификация,строение,биологическаяроль.Апопротеины,ихроль.Обратный
- •Биосинтезтриацилглицериновифосфолипидов.
- •Перекисноеокислениелипидов,этапы.Рольактивныхформ
- •Стадииперекисногоокислениялипидов
- •Выясняется,чтоАфКпринимаютнепосредственноеучастиевформированииразнообразных физиологических ответов клеток на тот или иной молекулярный Рольактивныхформкислорода.
- •Переваривание белков в желудочно-кишечном тракте. Какимибиохимическимитестамиможнообнаружитьнарушенияперевариваниябелковвжелудочно-кишечномтракте? Перевариваниебелковвжелудке
- •Образованиеирольсолянойкислоты
- •Механизмактивациипепсина
- •Возрастныеособенностиперевариваниябелковвжелудке
- •Перевариваниебелковвкишечнике
- •Активацияпанкреатическихферментов
- •Специфичностьдействияпротеаз
- •Диагностиканарушенийпереваривания.
- •Аминокислотный фонд клетки, пути использования аминокислот вклетке.Реакцииметаболизмааминокислот,ихзначениеваминокислотномобмене.Роль витаминов.
- •Тканевойобменаминокислот
- •Метаболизмаминокислот.
- •Дезаминированиеаминокислот
- •Окислительноедезаминирование
- •Непрямоедезаминирование(трансдезаминирование)
- •Декарбоксилированиеаминокислотиихпроизводных
- •Балансаминокислотвклетке.Энергетическоеипластическое
- •Азотистыйбаланс
- •Трансаминирование
- •Дезаминированиеаминокислот
- •Окислительноедезаминирование
- •Непрямоедезаминирование(трансдезаминирование)
- •Декарбоксилированиеаминокислотиихпроизводных
- •Биосинтезмочевины.
- •ОрнитиновыйциклКребса
- •РольсвободныхАк
- •Образование других аминокислот также возможно при наличиисоответствующих α-кетокислот,
- •Гистамин
- •Физиологическиеэффекты
- •Серотонин
- •РеакциясинтезаГамк
- •Регуляциясинтезаисекреции
- •Небелковыеазотсодержащиекомпонентыкрови.Причиныихизменения.Диагностическое значение.
- •Клинико-диагностическоезначение определения креатина икреатининавкровиимоче.Характеризмененияпоказателейприразнойпатологии.
- •Взаимосвязь белкового и липидного обменов (примеры общихметаболитов,реакциипереходаотодноговидаметаболизмакдругому).
- •Днк,строение,рольвбиосинтезебелка.СистемаРнк-днк-белок. Биосинтезбелков
- •ТретичнаяструктураДнк(суперспирализацияДнк)
- •Химическиемеханизмывозникновениямутацийисистемаантимутагеннойзащиты.
- •Генныемутации.Последствиямутаций.Методывыявлениягенныхмутаций
- •Инициация
- •Элонгация
- •Терминация
- •ПосттранскрипционныепревращенияРнк.
- •Основныеэтапыбиосинтезабелкавклетке.Генетическийкод,его
- •Свойствагенетическогокода:
- •Элонгация
- •Терминация
- •Трансляция.
- •Инициация
- •Элонгация
- •Существуетдваглавныхспособапередачисигналавклетки-мишениотсигнальныхмолекулсмембранныммеханизмомдействия:
- •Аденилатциклазнаясистема.
- •Регуляциясинтезаисекреции
- •Механизмдействия.
- •Инсулин,строение,местосинтеза,строениеинсулиновогорецептора,биологическая роль инсулина(механизм действия). Микроэлементы,участвующиевметаболизмесучастиеминсулина.
- •Строение
- •Механизмдействия
- •Активацияинсрецептора
- •Микроэлементы
- •Глюкагон,строение,схемарецептора,молекулярныемеханизмы
- •Гормоныкорынадпочечников,строение,биологическаяроль,клиникагиперигипофункции.
- •Кортизол
- •Изменениесодержаниякортизолавкрови
- •Тестостерон
- •Альдостерон.
- •Функции
- •Гормоныщитовиднойжелезы:ихстроение,молекулярныемеханизмывлиянияна обменвеществ,Клиникагипо-игиперфункции.
- •Эндемическийзоб
- •Тиреотропин,лютеинизирующийгормонифолликулостимулирующийгормон
- •Кортикотропин
- •Гормонызаднейдолигипофиза
- •Гемоглобин,строение,физиологическиеипатологические
- •Гемоглоби́н — сложныйжелезосодержащийбелокживотных, обладающихкровообращением,способныйобратимосвязыватьсяскислородом,обеспечиваяегопереносвткани.
- •СтроениегемоглобинаА
- •Нормальныеформыгемоглобина
- •Патологическиеформыгемоглобина
- •Роль2,3-дифосфоглицерата
- •ИзменениерНсреды
- •Строениеисинтезгема
- •Регуляциясинтезагема
- •Лечение
- •Антиоксидантная система / аос /клетки. Ферменты аос.НизкомолекулярныеАо.Основныезвеньяантиоксидантнойсистемы.Природныеантиоксиданты(перечислитьклассы).
- •67. Как связано состояние антиоксидантной системы с углеводнымобменом?Какиебиохимическиетестыможноиспользоватьдляоценкиантиоксидантнойсистемыклетки?
- •Образованиеаммиакавнервнойткани
- •Энергетическийобменвнервнойткани
- •Гликолиз,гликогенолиз.
- •Преимущества.
- •Синтезкреатинаикреатинфосфата.
- •Компонентымежклеточногоматрикса.Строение,рольбелковколлагенаиэластина,протеогликановигликозамингликанов.
- •МежклеточныйматрикскостнойизубнойтканиНеорганическаячасть
- •Органическаячасть
- •Mежклеточныйматрикссуставногохряща
- •Mежклеточныйматрикскожнойткани
- •Коллаген.
- •Эластин
- •Минеральныекомпонентыпищи.Классификация.Биохимическаяфункция. Биоусвояемые формы. Биохимическая функция цинка,селенаихрома,меди,железа.
- •Железо.
- •Макро-имикроэлементы.Ролькальциявметаболизмеикостнойсистеме(обосноватьрольвитаминовидругихминералов).
- •Биогенныеэлементы
- •Кальций.
- •Стадии.
- •Микросомальноеокисление
- •Сульфотрансферазы
- •Глутатионтрансферазы
- •Ацетилтрансферазы,метилтрансферазы
- •Спомощьюкакихбиохимическихтестовможнооценитьфункциональноесостояниепечени?
- •Аланинаминотрансфераза(алт)
- •Аспартатаминотрансфераза(аст)
- •Щелочнаяфосфатаза(щф)
- •Гамма-глутамилтрансфераза(ггт)
- •Патологическиекомпонентымочи,ихпроисхождение.Диагностическое значение определения патологических компонентовмочи.
Транслокация- третья стадия элонгации. К рибосоме присоединяется фактор элонгацииEF-2 и за счѐт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу. Врезультате дипептидил-тРНК, которая не меняет своего положения относительно мРНК, изА-центра перемещается в Р-центр. Свободная от метионина тРНКiМет покидает рибосому, авобласть А-центрапопадает следующийкодон
Современныепредставленияосигнальныхмолекулах.Биохимическиемеханизмы действия гормонов и передачи сигнала в клетку(катехоламины,стероидныегормоны,инсулин).Цикло-АМФ-зависимый,инозитол-фосфатидныйиСа++-зависимыйпутипередачисигналав
клетку.
Сигнальныемолекулы-гормоны,медиаторы,эйконазоиды,факторыроста,оксидазота(NO)
Сигнальнымимолекуламимогутбытьнеполярныеиполярныевещества.Неполярныевещества, например стероидные гормоны, проникают в клетку, проходя через липидныйбислой.Полярныесигнальныемолекулывклеткунепроникают,носвязываютсяспецифическимирецепторамиклеточныхмембран.Такоевзаимодействиевызываетцепьпоследовательных событий в самой мембране и внутри клетки. К полярным сигнальныммолекуламотносятбелковыегормоны(например,глюкагон,инсулин,паратгормон),нейромедиаторы (например, ацетилхолин, глицин, γ-аминомасляная кислота), факторы роста,цитокины,эйкозаноиды.
Существуетдваглавныхспособапередачисигналавклетки-мишениотсигнальныхмолекулсмембранныммеханизмомдействия:
аденилатциклазная(илигуанилатциклазная)системы;
фосфоинозитидныймеханизм.
Са+2
Аденилатциклазнаясистема.
Основныекомпоненты:мембранныйбелок-рецептор,G-белок,ферментаденилатциклаза,гуанозинтрифосфат,протеинкиназы.
Крометого,длянормальногофункционированияаденилатциклазнойсистемы,требуетсяАТФ.
Белок-рецептор, G-белок, рядом с которым располагаются ГТФ и фермент (аденилатциклаза)встроены вмембрануклетки.
До момента действия гормона эти компоненты находятся в диссоциированнном состоянии, апослеобразованиякомплексасигнальноймолекулысбелком-рецепторомпроисходятизменения конформации G-белка. В результате одна из субъединиц G-белка приобретаетспособностьсвязываться сГТФ.
Комплекс "G-белок-ГТФ" активирует аденилатциклазу. Аденилатциклаза начинает активнопревращатьмолекулы АТФвц-АМФ.
ц-АМФ обладает способностью активировать особые ферменты - протеинкиназы, которыекатализируютреакциифосфорилированияразличныхбелковсучастиемАТФ.Главнымрезультатомэтогопроцессафосфорилированияявляетсяизменениеактивностифосфорилированногобелка.Врезультатереакциифосфорилированиябелкимогутстановятсяфункционально активнымиилинеактивными.
Такие процессы будут приводить к изменениям скорости биохимических процессов в клетке-мишени.
Инозитолтрифосфат-этовещество,котороеявляетсяпроизводнымсложноголипида-инозитфосфатида.Онообразуетсяврезультатедействияспециальногофермента-
фосфолипазы"С",которыйактивируетсяврезультатеконформационныхизмененийвнутриклеточногодоменамембранногобелка-рецептора.
Этотферментгидролизуетфосфоэфирнуюсвязьвмолекулефосфатидил-инозитол-4,5-бисфосфатаиврезультатеобразуютсядиацилглицериниинозитолтрифосфат.
Известно, что образование диацилглицерина и инозитолтрифосфата приводит к увеличениюконцентрации ионизированного кальция внутри клетки. Это приводит к активации многихкальций-зависимыхбелковвнутриклетки,втомчислеактивируютсяразличныепротеинкиназы. И здесь, как и при активации аденилатциклазной системы, одной из стадийпередачи сигнала внутри клетки является фосфорилирование белков, которое в приводит кфизиологическомуответуклеткинадействиегормона.
Са2+
В работе фосфоинозитидного механизма передачи сигналов в клетке-мишени принимаетучастие специальный кальций-связывающий белок - кальмодулин. Это низкомолекулярныйбелок (17 кДа), на 30 % состоящий из отрицательно заряженных аминокислот (Глу, Асп) ипоэтомуспособныйактивносвязыватьСа+2.Однамолекулакальмодулинаимеет4кальций-связывающих участка. После взаимодействия с Са+2 происходят конформационныеизменения молекулы кальмодулина и комплекс "Са+2-кальмодулин" становится способнымрегулировать активность (аллостерически угнетать или активировать) многие ферменты -аденилатциклазу,фосфодиэстеразу,Са+2,Мg+2-АТФазуиразличныепротеинкиназы.
Катехоламины, адреналин, его строение, схема синтеза. Механизмдействия гормона. Влияние адреналина на процессы обмена веществ.Катехоламины-дофамин,норадреналиниадреналинпредставляют собой 3,4-дигидроксипроизводные фенилэтиламина. Они синтезируются главным образом вхромаффинныхклеткахмозговогослоянадпочечников.
Регуляциясинтезаисекреции
Активируют:стимуляциячревногонерва,стресс.
Уменьшают:гормоныщитовиднойжелезы.
Механизмдействия.
Катехоламиныдействуютнаклетки-мишеничерезрецепторы,локализованныевплазматической мембране. Выделяют 2 главных класса таких рецепторов: α-адренергическиеиβ-адренергические.Всерецепторыкатехоламинов-гликопротеины,которыеявляютсяпродуктами разных генов, различаются сродством к агонистам и антагонистам и передаютсигналы в клетки с помощью разных вторичных посредников. Это определяет характер ихвлияниянаметаболизмклеток-мишеней.
Адреналинвзаимодействуеткаксα-,такисβ-рецепторами;норадреналинвфизиологическихконцентрацияхглавнымобразомвзаимодействуетсα-рецепторами.
Взаимодействие гормона с β-рецепторами активирует аденилатциклазу, тогда как связываниес α2-рецептором еѐ ингибирует. При взаимодействии гормона с α1-рецептором происходитактивацияфосфолипазыСистимулируетсяинозитолфосфатныйпутьпередачисигнала
Эффект
Фосфорилирование белковc-АМР-зависимой протеинкиназойобусловливает многиебиохимические эффекты адреналина. В мышцах и в меньшей степени в печениадреналинстимулируетгликогенолизпутемактивациипротеинкиназы,котораявсвоюочередь активируетфосфорилазный каскад.
Фосфорилированиегликогенсинтазы,напротив,ослабляетсинтезгликогена.Действуянасердце, адреналин увеличивает минутный объем в результате повышения силы(инотропный эффект) и частоты (хронотропный эффект) сокращений, что такжесвязанос увеличением содержаниясАМР.
ВжировойтканиадреналинповышаетсодержаниесАМР,поддействиемкоторого
чувствительнаякгормонамлипазапревращаетсявактивную(фосфорилированную)форму.
Этот фермент усиливает липолиз и высвобождениежирных кислотв кровь. Жирныекислоты используются в качестве источника энергии в мышцах и, кроме того, могутактивироватьглюконеогенезвпечени.
Инсулин,строение,местосинтеза,строениеинсулиновогорецептора,биологическая роль инсулина(механизм действия). Микроэлементы,участвующиевметаболизмесучастиеминсулина.
 Инсули́н—гормонпептидной
природы,
образуетсявбета-клеткахостровковЛангергансаподжелудочнойжелезы.Оказываетмногогранноевлияниенаобменпрактическивовсехтканях.Основноедействиеинсулиназаключаетсяв
снижении
Инсули́н—гормонпептидной
природы,
образуетсявбета-клеткахостровковЛангергансаподжелудочнойжелезы.Оказываетмногогранноевлияниенаобменпрактическивовсехтканях.Основноедействиеинсулиназаключаетсяв
снижении
концентрацииглюкозывкрови.
Строение
Молекулаинсулинаобразованадвумяполипептиднымицепями,содержащими
51аминокислотныйостаток:A-цепьсостоитиз 21аминокислотногоостатка,B-цепьобразована30аминокислотнымиостатками.Полипептидныецеписоединяютсядвумядисульфиднымимостикамичерезостаткицистеина,третьядисульфиднаясвязьрасположенавA-цепи.
Синтез
Инсулинобразуетсяизпрепроинсулинаврезультатепосттрансляционноймодификации.Генпрепроинсулина в геноме человека представлен единственной копией. В настоящее времяинтенсивно изучаются строение промоторной области и механизмы регуляции генаинсулина.
Синтез препроинсулина происходит на полирибосомах, связанных с эндоплазматическимретикулумом. Препроинсулин проникает в люмен ретикулума, где от него отщепляетсялидирующая последовательность - N-концевой фрагмент, содержащий 24 аминокислотныхостатка. Образовавшийся проинсулин перемещается в люмене к аппарату Гольджи, гдеупаковывается в секреторные гранулы. В аппарате Гольджи и секреторных гранулахпроисходит превращение проинсулина в инсулин. В этом участвуют две эндопептидазы:прогормонконвертазы2и3.ЭтиферментырасщепляютсвязиАрг32-Глу33иАрг65-Гли66.ЗатемС-концевые остаткиАргиЛизотщепляютсякарбоксипептидазойЕ.
Механизмдействия
Подобнодругимгормонамсвоѐдействиеинсулиносуществляетчерезбелок-рецептор.
Инсулиновый рецептор представляет собой сложный интегральный белок клеточноймембраны,построенныйиз2субъединиц(aиb),причѐмкаждаяизнихобразованадвумяполипептиднымицепочками.
Инсулин с высокой специфичностью связывается и распознаѐтся а-субъединицей рецептора,которая при присоединении гормона изменяет свою конформацию. Это приводит кпоявлениютирозинкиназнойактивностиусубъединицыb,чтозапускаетразветвлѐннуюцепьреакцийпоактивацииферментов,котораяначинаетсясаутофосфорилированиярецептора.
Активацияинсрецептора
Активация инсулинового рецептора запускает внутриклеточный механизм, которыйнапрямуювлияетнапоступлениеглюкозывклеткупутѐмрегуляцииколичестваиработымембранныхбелков,переносящихглюкозувклетку.
Внаибольшейстепениотинсулиназависиттранспортглюкозывдвухтипахтканей:мышечнаяткань(миоциты)ижироваяткань(адипоциты)—этот.н.
инсулинозависимыеткани.Составляявместепочти2/3всейклеточноймассычеловеческоготела,онивыполняют ворганизметакиеважныефункции как
движение,дыхание,кровообращениеит.п.,осуществляютзапасаниевыделеннойизпищи

энергии.
Микроэлементы
Медьусиливаетгипогликемическийэффектинсулина.
Предполагают,чтомарганецучаствуетвпроцессахсинтезаилиметаболизмаинсулина.
Глюкагон,строение,схемарецептора,молекулярныемеханизмы
влияниянаобменвеществ
Глюкагон—гормональфа-клетокостровковЛангергансаподжелудочнойжелезы.Похимическомустроению глюкагонявляетсяпептиднымгормоном.
Молекулаглюкагонасостоитиз29аминокислот.Глюкагонсинтезируетсявосновномвα-клетках панкреатических островков поджелудочной железы, а также в ряде клетоккишечника
Механизм действияглюкагона обусловлен его связыванием со специфическимиглюкагоновымирецепторамиклетокпечени.ЭтоприводиткповышениюопосредованнойG-белком активностиаденилатциклазыи увеличению образованияцАМФ. Результатомявляетсяусилениекатаболизмадепонированноговпеченигликогена(гликогенолиза)
Рецепторглюкагона(GLUR)представляетсобойрецептор(GPCR)семействасекретина,содержащийсемьтрансмембранныхдоменовисопряженныйсG-белком.
При связывании с GLUR лиганда, природного гормона глюкагона, происходит активацияаденилатциклазыиодновременноеувеличениепродуцированияцАМФ.УвеличениеуровняцАМФ вызывает активацию гликогенфосфорилазы, что приводит к увеличениюпродуцированияглюкозывпечени.

Гормоныкорынадпочечников,строение,биологическаяроль,клиникагиперигипофункции.
Надпо́чечники—парныеэндокринныежелезыпозвоночныхживотныхичеловека.
Вкоренадпочечниковсинтезируетсяболее40различныхстероидов,различающихсяпоструктуре и биологической активности. Биологически активные кортикостероидыобъединяютв3основныеклассавзависимостиотихпреобладающегодействия.
Глюкокортикоиды,С21-стероиды, играют важную роль в адаптации к стрессу. Ониоказываютразнообразныеэффекты,нонаиболееважный-стимуляцияглюконеогенеза.Основнойглюкокортикоидчеловека-кортизол.
Минералокортикоиды,С21-стероиды,необходимыдляподдержанияуровняNa+иК+.Самыйактивный гормонэтого класса-альдостерон
Андрогены- С19-стероиды. В коре надпочечников образуются предшественникиандрогенов,изкоторыхнаиболееактивный-дегидроэпиандростерон(ДЭА)ислабый -андростендион.Самыймощныйандрогеннадпочечниковтестостеронсинтезируетсяв
надпочечникахвнебольшомколичестве.
Общимпредшественникомкортикостероидовслужитхолестерол

Кортизол
Функциикортизола
Свободныйкортизолвлияетнамногиеобменныеифизиологическиепроцессы,регулируясинтезклеточныхферментов.
Стимулируетбиосинтезбелкавпечени,нотормозитеговлимфатическойсистеме.
Положительновлияетнапроцессобразованиягликогенавпечени,
увеличивает количество натрия в крови (способствует образованию отеков) иуменьшаетколичествокалия,чтоможетотрицательносказатьсянаработесердца.
Онтакжеснижаетвсасываниекальциявкишечнике,способствуяеговыходуизкостейи повышая его выведение почками, в результате чего кости становятся хрупкими,частоломаются (явления остеопороза).
Изменениесодержаниякортизолавкрови
ПовышенноевыделениекортизолаведеткразвитиюболезниИценко-Кушинга.Приэтомучеловека появляются слабость, повышенная утомляемость, депрессия, отеки, нарушаетсядеятельностьсердечно-сосудистойсистемы,повышаетсяартериальное
давление.Больнойчеловекимеетхарактерныйвид:ожирениевобластителаилица(лицолунообразное)всочетаниисхудымиконечностями.
Пониженное содержаниекортизола может вызвать надпочечниковую недостаточность(Аддисонову болезнь). Признаки Аддисоновой болезни: слабость, быстрая утомляемость,похудание,нарастающаяпигментациякожи(отцветазагарадобронзовой),тошнота,рвота,понос,боливживоте.
Тестостерон
Тестостеронучаствуетвразвитиимужскихполовыхорганов,вторичныхполовыхпризнаков;
регулируетсперматогенезиполовоеповедение
оказываетвлияниенаазотистыйифосфорныйобмен.
Гипофункция:Гипогонадизм-патологическоесостояние,обусловленноенедостаточнойсекрециейандрогенов.Мочеполовыерасстройства:
снижениелибидо
эректильнаядисфункция
расстройстваоргазма
снижениеоплодотворяющейспособностиэякулята
учащенноемочеиспускание
Вегетососудистыерасстройства:
внезапнаяпокраснениелица,шеи,верхнейчаституловища
чувствожара("приливы")
колебанияуровняартериальногодавления
боливсердце
головныеболи
головокружение
чувствонехваткивоздуха
Психоэмоциональныерасстройства:
повышеннаяраздражительность
быстраяутомляемость
ослабленияпамятиивнимания
бессонница
депрессивныесостояния
снижениеобщегосамочувствияиработоспособности
Соматическиерасстройства:
уменьшениеколичествамышечноймассыисилы
снижениеплотностикостнойткани
увеличениегрудныхжелез
увеличениемассыжировойткани
уменьшениеовоосениянаголове,теле,лобке
истончениеиатрофиякожи
Альдостерон.
Первичныйальдостеронизм(синдромКона)—этодостаточноредкоезаболевание,прикоторомсекрецияальдостеронаувеличенаиз-заопухолинадпочечников.
Гипоальдостеронизм(т.е.пониженнаявыработкаальдостерона)приводиткуменьшениюсодержаниянатрияихлоридоввплазмекрови,повышениюуровнякалия.
Концентрацияальдостеронавплазменизкая,аренина,наоборот,высокая.
Функции
Поддействиемальдостеронапроисходитзадержканатрияихлорапочечнымиканальцами,чтоприводиткуменьшениювыделенияжидкостисмочой,потом,слюнойиодновременноспособствует выведению из организма калия. Альдостерон влияет на поддержаниеартериальногодавления,повышениеегоуровнявкровиприводиткобразованиюотеков
иповышениюдавления,снижениюмышечноготонуса,судорогам,нарушениямсердечногоритма.
Гормоныщитовиднойжелезы:ихстроение,молекулярныемеханизмывлиянияна обменвеществ,Клиникагипо-игиперфункции.
 Гормо́ныщитови́днойжелезы́представленыдвумяразличнымиклассамибиологическиактивных
веществ:
йодтиронинами иполипептиднымгормоном
-кальцитонином.
Этиклассы
веществ выполняют разные физиологические
функции: йодтиронины
регулируютсостояниеосновногообмена,акальцитонинявляетсяоднимизфакторовростаивлияетнасостояние
кальциевого обмена, а также участвует
в процессах роста и развития
костногоаппарата.
Гормо́ныщитови́днойжелезы́представленыдвумяразличнымиклассамибиологическиактивных
веществ:
йодтиронинами иполипептиднымгормоном
-кальцитонином.
Этиклассы
веществ выполняют разные физиологические
функции: йодтиронины
регулируютсостояниеосновногообмена,акальцитонинявляетсяоднимизфакторовростаивлияетнасостояние
кальциевого обмена, а также участвует
в процессах роста и развития
костногоаппарата.
Вщитовиднойжелезесинтезируютсягормоны-йодированныепроизводныетирозина.Ониобъединены общим названием йодтирони-ны. К ним относят 3,5,3'-трийодтиронин(трийодтиронин,Т3)и3,5,3',5'-тетрайодтиронин(Т4),илитироксин.

Клетки-мишени йодтиронинов имеют 2 типа рецепторов к этим гормонам. Основныеэффектыйодтиронинов-результатихвзаимодействиясвысокоспецифичнымирецепторами,которые в комплексе с гормонами постоянно находятся в ядре и взаимодействуют сопределѐннымипоследовательностямиДНК,участвуяврегуляцииэкспрессиигенов.
Другие рецепторы расположены в плазматической мембране клеток, но это не те же самыебелки,чтовядре.Ониобладаютболеенизкимсродствомкйодтиронинами,вероятно,обеспечиваютсвязываниегормоновдляудержанияихвнепосредственнойблизостикклетке.При физиологической концентрации йодтиронинов их действие проявляется в ускорениибелковогосинтеза,стимуляциипроцессовростаиклеточнойдифференцировки.
Метаболические эффекты йодтиронинов относят в основном к энергетическомуметаболизму,чтопроявляетсявповышениипоглощенияклеткамикислорода.Этотэффектпроявляетсяво всехорганах, кромемозга, РЭСи гонад.
ВразныхклеткахТ3стимулируетработуNа+,К+-АТФ-азы,начтозатрачиваетсязначительнаячастьэнергии,утилизируемой клеткой.
В печени йодтиронины ускоряют гликолиз, синтез холестерола и синтез жѐлчных кислот. Впечени и жировой ткани Т3повышает чувствительность клеток к действию адреналина икосвенностимулируетлиполизвжировойтканиимобилизациюгликогенавпечени.ВфизиологическихконцентрацияхТ3увеличиваетвмышцахпотреблениеглюкозы,стимулируетсинтезбелковиувеличениемышечноймассы,повышаетчувствительностьмышечных клеток к действиюадреналина.
Гипотиреозуноворождѐнныхприводиткразвитиюкретинизма,которыйпроявляетсямножественными врождѐнными нарушениями и тяжѐлой необратимой задержкойумственногоразвития.
Гипотиреозразвиваетсявследствиенедостаточностийодтиронинов.Обычногипотиреозсвязанснедостаточностьюфункциищитовиднойжелезы,номожетвозникатьипри
заболеванияхгипофизаигипоталамуса.
Наиболеетяжѐлыеформыгипотиреоза,сопровождающиесяслизистымотѐкомкожииподкожнойклетчатки,обозначаюттермином"микседема".
Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость,сонливость,непереносимостьхолода, сухостькожи.
Гипотиреозможетбытьтакжерезультатомнедостаточногопоступленияйодаворганизм-
Эндемическийзоб
Гипертиреозвозникаетвследствиеповышеннойпродукциийодтиронинов. Диффузныйтоксическийзоб (базедоваболезнь,болезньГрейвса)-наиболеераспространѐнноезаболеваниещитовиднойжелезы.Приэтомзаболеванииотмечаютувеличениеразмеровщитовидной железы (зоб), повышение концентрациийодтиронинов в 2-5 разиразвитиетиреотоксикоза.
Характерныепризнакитиреотоксикоза:увеличениеосновногообмена,учащениесердцебиений,мышечнаяслабость,снижениемассытела(несмотрянаповышенныйаппетит),потливость,повышениетемпературытела,тремориэкзофтальм(пучеглазие).
Гормоныгипофизаихстроение,молекулярныемеханизмывлиянияна обменвеществ,Клиника гипо-игиперфункции.
Гипофиз секретирует большое количество гормонов, участвующих в регуляцииразличных биохимических процессов и физиологических функций.В переднейдолегипофиза (аденогипофизе) синтезируются так называемые тропныегормоны, стимулирующие синтез и секрецию гормонов других эндокринныхжелѐз или оказывающие влияние на метаболические реакции в других тканях-мишенях.
Задняя доля гипофиза, или нейрогипофиз, секретирует гормоны,регулирующиевосновном водныйбаланси лактацию.
 Гормонроста,пролактин
Гормонроста,пролактин
Гормонростасинтезируетсявсоматотроф-ныхклетках,наиболеемногочисленныхвпереднейдолегипофиза.Представляетсобойодноцепочечныйпептидсостоящийиз191аминокислотногоостаткаиимеющий2 внутримолекулярныедисульфидныесвязи.
Гормонростаобразуетсяизпрогормона
Первичныеэффектыгормонаростакратковременныиинсулиноподобны.Онипроявляютсявосновномвотношенииобменажировиуглеводов.Вжировой
тканиусиливаетсяпотреблениеглюкозыилипогенез,вследствиечегопроисходит снижение концентрации глюкозы в крови. Однако в дальнейшемпроявляютсяболеемедленныеэффекты:усиливаетсялиполизвжировойткани,увеличиваетсяконцентрацияжирныхкислотвкрови,авслучаенедостаточностиинсулинаувеличиваетсясодержаниекетоновыхтелвкрови.
Акромегалия-патологическоеувеличениеотдельныхчастейтела,связанноесповышеннойвыработкойсоматотропного гормона (гормона роста) передней долей гипофиза. Возникает у взрослых людей и проявляетсяукрупнениемчертлица(носа,ушей,губ,нижнейчелюсти),увеличениемстопикистейрук,постояннымиголовнымиболямииболямивсуставах,нарушением половойирепродуктивнойфункцийумужчиниженщин.
Гипофизарныйнанизм (карликовость)—этозадержкаростаи физическогоразвития,вызваннаянедостаточнымколичествомсоматотропногогормона(СТГ,гормонроста) в организме
Пролактинсинтезируетсялактотрофнымиклеткамипереднейдолигипофизаввидепрогормона.
Онсостоитиз199аминокислотныхостатков,образующиходнуполипептиднуюцепьстремя дисульфиднымисвязями.
Рецепторыпролактинаприсутствуютвклеткахмногихтканей:впечени,почках,надпочечниках,яичках,яичниках,маткеидругихтканях.
Основнаяфизиологическаяфункцияпролактина-стимуляциялактации.Пролактин индуцирует синтез α-лактальбумина и казеина, активирует синтезфосфолипидови ТАГ.
Тиреотропин,лютеинизирующийгормонифолликулостимулирующийгормон
Тиреотропин,ЛГиФСГ-гликопротеины.Тиреотропин(TIT)синтезируетсявтиреотрофных клетках передней долигипофиза.
Стимуляциясекреции тиреотропина происходит под влиянием тиреолиберина,аосновноеингибирующеедействиеоказываетповышениеуровнятиреоидныхгормонов.
Основная биологическая функция тиреотропина- стимуляция синтеза исекрециийод-тиронинов(Т3иТ4)вщитовиднойжелезе.Трансдукциясигналатиреотропина в клетки щитовидной железы происходит через рецепторыплазматическоймембраныиактивациюаденилатциклазы.
Рецептор тиреотропинасостоит из 2 доменов, один из которых представляетсобой гликопротеин, а второй - ганглиозид (гликолипид, содержащий сиаловуюкислоту).Дляпроявлениябиологическогодействиянеобходимосвязываниетиреотропинасобоимидоменамирецептора.
Кортикотропин
Кортикотрошш(АКТГ)-пептидныйгормон;состоитиз39аминокислотныхостатков; синтезируется в клетках передней доли гипофиза под влияниемкортиколиберина.
Кортикотропинсекретируетсявимпульсивномрежиме. Пристрессе(травма,
ожог, хирургическое вмешательство, интоксикация химическими веществами,кровотечение,боль,психическаятравма)концентрацияАКТГвкровивозрастаетвомногораз.
Механизм действия АКТГ включает взаимодействие с рецепторомплазматической мембраны клеток, активацию аденилатциклазы ифосфорилированиебелков,участвующихвсинтезекортикостероидов.Этиэффектыусиливаются вприсутствииионовСа2+.
Гормонызаднейдолигипофиза
Задняядолягипофиза,илинейрогипофиз,сек-ретирует2активныхгормона-вазопрессин,илиантидиуретическийгормон(АДГ),иокситоцин.
Обагормонаобразуютсявгипоталамусевнейронахразныхгипоталамическихядер в форме прогормонов, из которых в результате посттрансляционноймодификации образуются гормон и транспортный пептид нейрофизин. Впроцессе транспорта в клетки задней доли гипофиза гормоны остаютсянековалентносвязаннымисо своимитранспортнымипептидами.
Основные биологические эффекты вазопрессинапроявляются черезвзаимодействие с 2 типами рецепторов. V1-рецепторы расположены в клеткахгладкой мускулатуры сосудов в комплексе с фосфолипазой С. Результаттрансдукции сигнала в эти клетки - сокращение сосудов. V2-рецепторырасположены в клетках почечных канальцев. Взаимодействие вазопрессина сV2-рецепторамиактивируетаденилатциклазнуюсистему,увеличиваявклеткахконцентрациюцАМФиактивностьпротеинкиназыА.
Окситоцинстимулируетсокращениегладкоймускулатурыматки,атакжеиграет важную роль в стимуляции лактации. Он вызывает сокращениемиоэпителиальных клеток молочных желѐз, в результате чего происходитперераспределениемолокаизальвеолярныхпротоковвобластьсоска.
Строение биологических мембран. Структурные факторыформированиялипидногобислоя.Важнейшиебелки,ферментыилипидымембраны. Написать соответствующие формулы. Функции мембранныхбелков. Особенности строения эритроцитарной мембраны. Транспортныесистемымембран.
Состав и строение биологических мембран.Биологические мембранысостоят из белков и липидов. Углеводы присутствуют лишь в качествесоставныхчастейсложныхбелков(гликопротеинов)исложныхлипидов(гликолипидов).
Липидымембран представлены четырьмя основными группами: фосфолипидами (основнаядоля),сфинголипидами,гликолипидамиистероидами.
Фосфолипиды– это сложные эфиры фосфатидной кислоты. Основнымифосфолипидами являются фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит ифосфатидилхолин.
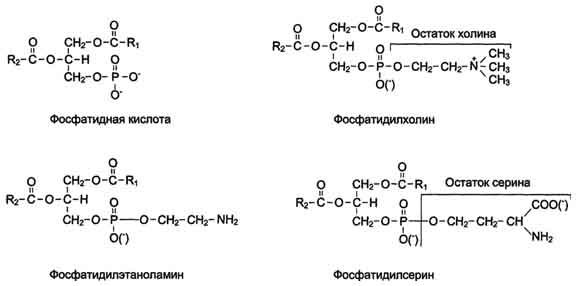
 Сфинголипиды,которыеявляютсяпроизводнымицерамидаимонофосфорныхэфировразличныхспиртов,представленывосновномсфингомиелином.
Сфинголипиды,которыеявляютсяпроизводнымицерамидаимонофосфорныхэфировразличныхспиртов,представленывосновномсфингомиелином.
Гликолипиды– гликозильные производные церамида – представлены какнейтральнымицереброзидами,такиихкислымисульфоэфирами –сульфатидами.
Стероидыпредставленыхолестерином.

Основумембранысоставляетдвойнойлипидныйслой,вформированиикоторогоучаствуютфосфолштиды и гликолипиды. Липидный бислой образован двумя рядами липидов,гидрофобныерадикалыкоторыхспрятанывнутрь,агидрофильныегруппыобращенынаружуи контактируют с водной средой. Белковые молекулы как бы "растворены" в липидномбислое. Мембранные липиды -амфифильные(амфипатические)молекулы,т.е. в молекулеесть как гидрофильные группы (полярные "головки"), так и алифатические радикалы(гидрофобные"хвосты"), самопроизвольноформирующиебислой
Функциимембранныхбелков.
Белки мембран различаются по своему положению в мембране . Они могут глубокопроникатьвлипидныйбислойилидажепронизыватьего -интегральныебелки,либоразнымиспособамиприкреплятьсяк мембране-поверхностныебелки.
Поверхностныебелки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральнымибелкамиили поверхностнымиучасткамилипидного слоя.
Белки,образующиекомплексысинтегральнымибелкамимембраны
Рядпищеварительныхферментов,участвующихвгидролизекрахмалаибелков,прикрепляетсякинтегральнымбелкаммембранмикроворсиноккишечника.
Примерами таких комплексов могут быть са-хараза-изомальтаза и мальтаза-гликоамилаза .Связьэтихпищеварительныхферментовсмембранойпозволяетсвысокойскоростьюгидролизоватьсубстратыи усваиватьпродуктыгидролизаклеткой.
Белки,связанныесполярными«головками»липидовмембран
Полярныеилизаряженныедоменыбелковоймолекулымогутвзаимодействоватьсполярными "головками" липидов, образуя ионные и водородные связи. Иногда связываниебелка--необходимоеусловие проявленияферментативнойактивности.Ктаким белкам,например,относятпротеинкиназуС,факторысвѐртывания крови.
Закреплениеспомощьюмембранного"якоря"
"Якорем"можетбытьнеполярныйдоменбелка,построенныйизаминокислотсгидрофобными радикалами. Примером такого белка может служить цитохром b5мембраныЭР.Этотбелокучаствуетвокислительно-восстановительныхреакциях,какпереносчикэлектронов
Трансмембранные(интегральные)белки
Некоторыеизтрансмембранныхбелковпронизываютмембрануодинраз(гликофорин),другиеимеютнесколькоучастков(доменов),последовательнопересекающихбислой
Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали.Полярныеостаткиаминокислотобращенывнутрьглобулы,анеполярныеконтактируютсмембраннымилипидами.
Гликозилированныебелки
Поверхностныебелкиилидоменыинтегральныхбелков,расположенныенанаружнойповерхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могутбыть присоединены через амидную группу аспарагина или гидроксильные группы серина итреонина.
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандовили адгезии.
Латеральнаядиффузиябелков
Некоторыемембранныебелкиперемещаютсявдольбислоя (латеральнаядиффузия) илиповорачиваютсявокругоси,перпендикулярноегоповерхности.
Особенностистроенияэритроцитарноймембраны.
Мембранаэритроцитовотражаетособенностибиохимическогостроениямембранразличныхтканей,аименнопредставляетпластичнуюмолекулярнуюмозаику,состоящуюизбелков,
липо- и гликопротеинов и, возможно, чисто липидных участков . В липидном бислоесодержатся холестерин, фосфотидилсерин, фосфотидилэтаноламин, фосфотидилхолин,сфингомиелин,цереброзидыидругиелипиды.Липидывмембранеэритроцитанаходятсяисключительноввидебислоя.
Белкивэритроцитарноймембранерасположенынеравномерно.Основнаячастьмембранныхбелков располагается на внутренней (цитоплазматической) стороне мембраны и образуетсетьфиламентов,котораяслужитдляподдержаниядвояковогнутойформыэритроцита.
Углеводнаясоставляющаяэритроцитарныхмембранпредставленаввидеолигосахаридныхцепей, ковалентно присоединенных к белкам (гликопротеины) и в меньшей степени клипидам(гликолипиды)
Фактор стабильности липидного бислоя определяется липидными порами. Эти порыобразуютсявместахдефектовжидкокристаллическойструктурылипидногобислоя
Транспортныесистемымембраны.
Транспортныесвойствамембраныхарактеризуютсяполупроницаемостью:некоторыесоединениямогут проникатьчерез нее,адругие—нет:
Однаизглавныхфункциймембран—регуляцияпереносавеществ.Существуютдваспособапереноса веществчерез мембрану:пассивныйиактивныйтранспорт:
Пассивныйтранспорт.Есливеществодвижетсячерезмембрануизобластисвысокойконцентрацией в сторону низкой концентрации (т.е. по градиенту концентрации этоговещества)беззатратыклеткойэнергии,тотакойтранспортназываетсяпассивным,
илидиффузией.Различаютдватипадиффузии:простуюиоблегченную.
Простая диффузияхарактерна для небольших нейтральных молекул (H2O, CO2, O2), атакже гидрофобных низкомолекулярных органических веществ. Эти молекулы могутпроходитьбезкакого—либовзаимодействиясмембраннымибелкамичерезпорыиликаналымембраныдотех пор,покабудетсохранятьсяградиентконцентрации.
Облегченнаядиффузия.Характернадлягидрофильныхмолекул,которыепереносятсячерезмембрану также по градиенту концентрации, но с помощью специальных мембранныхбелков—переносчиков.
Активный транспортимеет место в том случае, когда перенос осуществляется противградиента концентрации. Такой перенос требует затраты энергии клеткой. Активныйтранспорт служит для накопления веществ внутри клетки. Источником энергии частоявляется АТР. Для активного транспорта кроме источника энергии необходимо участиемембранныхбелков.Однаизактивныхтранспортныхсистемвклеткеживотныхотвечаетзаперенос ионов Na+ и K+ через клеточную мембрану. Эта система называется Na+ — K+ —насос.
Гемоглобин,строение,физиологическиеипатологические
производныегемоглобина,рольворганизме.Регуляциясвязываниякислорода с гемоглобином в тканях, схема Бора, роль 2,3-бифосфоглицерата. Синтез гема, роль микроэлементов, регуляцияпроцесса.
Гемоглоби́н — сложныйжелезосодержащийбелокживотных, обладающихкровообращением,способныйобратимосвязыватьсяскислородом,обеспечиваяегопереносвткани.
Строениегемоглобина
Гемоглобинпредставляетсобойбелок,включающий4 гемсодержащие белковые субъединицы. Междусобой протомеры соединяются гидрофобными,ионными, водородными связями по принципукомплементарности.Приэтомонивзаимодействуютне произвольно, а определенным участком -контактнойповерхностью
Белковые субъединицы в нормальном гемоглобинемогут быть представлены различными типамиполипептидныхцепей:α,β,γ,δ,ε,ξ(соответственно,греч. - альфа, бета, гамма, дельта, эпсилон, кси). Всостав молекулы гемоглобина входят подвецепидвухразныхтипов.

СтроениегемоглобинаА
Гем соединяется с белковой субъединицей, во-первых, через остатокгистидинакоординационнойсвязьюжелеза,во-вторых,черезгидрофобныесвязипиррольныхколецигидрофобныхаминокислот.
Нормальныеформыгемоглобина
Существуетнескольконормальныхвариантовгемоглобина:
HbР–примитивныйгемоглобин,содержит2ξ-и2ε-цепи,встречаетсявэмбрионемежду7-12 неделямижизни,
HbF–фетальныйгемоглобин,содержит2α-и2γ-цепи,появляетсячерез12недельвнутриутробногоразвития и является основнымпосле3 месяцев,
HbA–гемоглобинвзрослых,долясоставляет98%,содержит2α-и2β-цепи,уплодапоявляетсячерез3месяцажизниикрождениюсоставляет80%всегогемоглобина,
HbA2–гемоглобинвзрослых,долясоставляет 2%,содержит2α-и2δ-цепи,
HbO2–оксигемоглобин,образуетсяприсвязываниикислородавлегких,влегочныхвенахего94-98%отвсегоколичествагемоглобина,
HbCO2–карбогемоглобин,образуетсяприсвязыванииуглекислогогазавтканях,ввенознойкровисоставляет15-20%отвсегоколичествагемоглобина.
Патологическиеформыгемоглобина
HbS–гемоглобинсерповидно-клеточнойанемии.
MetHb–метгемоглобин,формагемоглобина,включающаятрехвалентныйионжелезавместо двухвалентного. Такая форма обычно образуется спонтанно, в этом случаеферментативных мощностейклеткихватаетнаего восстановление
Hb-CO–карбоксигемоглобин,образуетсяприналичииСО(угарныйгаз)вовдыхаемомвоздухе.Онпостоянноприсутствуетвкровивмалыхконцентрациях,ноегодоляможетколебатьсяотусловийи образажизни.
HbA1С–гликозилированныйгемоглобин.Концентрацияегонарастаетприхроническойгипергликемиииявляетсяхорошимскрининговымпоказателемуровняглюкозыкровизадлительныйпериод времени.
связываниекислородагемоглобиномрегулируетсяспецифическимикомпонентами
внутренней среды, а именно Н+, С02 и органическими фосфорными соединениями. Этирегуляторыоказываютсильнейшеевлияниенаспособностьгемоглобинасвязыватькислород,несмотрянаточтоониприсоединяютсякбелкувучастках,отстоящих далекоотгема.
Роль2,3-дифосфоглицерата
2,3-Дифосфоглицератобразуетсявэритроцитахиз1,3-дифосфоглицерата,промежуточногометаболитагликолиза,вреакциях,получивших названиешунтРаппопорта.
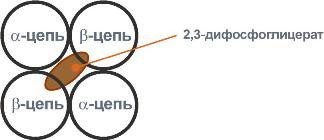 2,3-Дифосфоглицератрасполагаетсявцентральнойполоститетрамерадезоксигемоглобинаи
связывается с β-цепями, образуя поперечный
солевой мостик между атомами
кислорода2,3-дифосфоглицератаи
аминогруппами концевоговалинаобеих
β-цепей, такжеаминогруппамирадикаловлизинаигистидина.
2,3-Дифосфоглицератрасполагаетсявцентральнойполоститетрамерадезоксигемоглобинаи
связывается с β-цепями, образуя поперечный
солевой мостик между атомами
кислорода2,3-дифосфоглицератаи
аминогруппами концевоговалинаобеих
β-цепей, такжеаминогруппамирадикаловлизинаигистидина.
Функция2,3-дифосфоглицератазаключаетсявснижениисродствагемоглобинаккислороду.Этоимеетособенноезначениеприподъеменавысоту,принехваткекислородавовдыхаемомвоздухе.
ИзменениерНсреды
ВлияниерНнасродствогемоглобинаккислородуноситназваниеэффектаБора.Призакислениисредысродствоснижается,призащелачивании–повышается.
Приповышенииконцентрации протонов (закисление среды)в тканяхвозрастаетосвобождениекислородаизоксигемоглобина.Влегкихпослеудаленияугольнойкислоты(ввидеСО2)изкровииодновременномувеличенииконцентрациикислородавысвобождаютсяионыН+из гемоглобина.
Втканяхионыводородаприсоединяютсякостаткамгистидина,образуявосстановленныйгемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород"вытесняет"ионводородаизсвязисостаткомгистидинагемоглобиновоймолекулы.
Строениеисинтезгема
Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек,слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием?-аминолевулинат-синтазы(греч. ? - "дельта") происходит в митохондриях. Следующаяреакцияприучастииаминолевулинатдегидратазы(порфобилиноген-синтазы)протекаетвцитозоле.

После синтеза порфобилиногена четыре его молекулы конденсируются в тетрапиррол.Различаютдвавидатетрапирролов-уропорфириногентипаIиуропорфириногентипа
III. В синтезе обоих видов порфиринов принимает участиеуропорфириноген I-синтаза, вобразования уропорфириногена III дополнительно принимает участие ферментуропорфириногенIII-косинтаза.
Далее уропорфириногены превращаются в соответствующиекопропорфириногены.КопропорфириногенIIIокисляетсявпротопорфириногенIXидалеевпротопорфиринIX.Последнийпослесвязываниясжелезомобразуетгем,реакциюкатализируетферрохелатаза(гемсинтаза).
Регуляциясинтезагема
Скоростьсинтезаглобиновыхцепейзависитотналичиягема,онускоряетбиосинтез"своих"белков.
Основнымрегуляторнымферментомсинтезагемаявляетсяаминолевулинатсинтаза.
Положительныммодуляторомаминолевулинатсинтазыслужитгипоксиятканей,котораявэритропоэтическихтканяхиндуцируетсинтез фермента.
Впечениповышениеактивностиаминолевулинатсинтазывызываютсоединения,усиливающие работу микросомальной системы окисления– при этом возрастаетпотреблениегемадля образованияцитохрома Р450
Порфирии.Причиныиметаболическиенарушения,возникающиеприпорфириях. Диагностикапорфирий.
Порфирины.В норме моча содержит лишь очень малые количествапорфириновIтипа(до300мкгвсуточномколичестве).Однаковыделение
порфириновможетрезковозрасти(в10–12раз)призаболеванияхпечениипернициознойанемии.
ПОРФИРИНЫ,прир.макрогетероциклич.пигменты,содержащиевмолекулециклпорфина
(цитохромы,каталаза,пероксидаза)
Порфирии—этогруппанаследственныхзаболеваний,восновекоторыхлежитнарушениебиосинтеза гема, приводящее к избыточному накоплению в организме порфиринов и ихпредшественников.При порфирии из-за нарушения синтеза тема снимается механизмобратнойсвязи,прекращаетсяингибированиескорость-лимитирующегоферментаАЛК-
синтетазы,Припорфирииврожденнаямутацияводномизгенов,отвечающихзасинтезопределенного фермента, приводит к дефициту фермента и накоплению порфиринов ворганизме.Порфириныприсутствуютворганизмелюбогочеловека,однако,уздоровыхлюдейони ненакапливаются.
Диагностика:
-моча:исследуетсянасодержаниеобщихпорфиринов,ихпредшественников—порфобилиногеновиδ-аминолевулиновойкислоты.
Внормеобщих порфириноввмоченеболее0.15мг/л;порфобилиногена— 2 мг/л;
δ-аминолевулиновойкислоты—4.5мг/л.
кал:исследуетсянасодержаниеобщихпорфиринов.Нормальноеколичество—неболее200нмоль/г.
Исследованияпроводятсяметодомвысокоэффективнойжидкостнойхроматографии.
Кровь(плазмаиэритроциты):определяетсяколичествообщихпорфиринов.
Симптомы.
Для заболевания свойственно образование на коже травматических или актиническихпузырейчрезмерноеповышениесодержаниявмочеуропорфириновпосравнениюснормой,некоторое повышение содержания копропорфиринов, наши чие в печени различного родафункциональныхи органическихизменений.
Механизмобразованияметгемоглобинемий,биохимическиепринципы,лежащиевосновелечениеметгемоглобинемий.
Метгемоглобинемиихарактеризуютсяповышеннымсодержаниемвкровиуровняметгемоглобина, представляющего собой одну из форм окисленного гемоглобина.Этиологияи патогенез
В эритроцитах имеется комплекс факторов, участвующих в восстановлении метгемоглобинав гемоглобин, среди которых важную роль играет метгемоглобин-редуктаза. У здоровых лицметгемоглобинобразуетсявсегда,новнезначительномколичестве(0,1—1%)подвлияниемокислящих веществ, появляющихся в результате обмена веществ. При некоторыхзаболеваниях (легких, сердца) количество его может достигать 3—4 %. Метгемоглобин вотличие от оксигемоглобина содержит трехвалентное железо, стойко связывается скислородомвлегкихинеотдаетеготканям,чтообусловливаетразвитиетканевойгипоксии.
Некоторыехимическиевеществамогутизменятьструктуругемоглобина,вызываясиндромы,которые называют по образующемуся при этом пигменту. К ним относитсяметгемоглобинемия: окисленный гемоглобин, содержащий трехвалентное железо вместодвухвалентного.
Лечение
Приобретеннаяметгемоглобинемияпроходитсамостоятельнопослепрекращенияконтактасвызвавшим ее веществом. Однако содержание метгемоглобина порядка 30-40% опасно дляжизни и требует введенияметиленового синего, 1-2 мг/кг в/в. Этот краситель резкоповышает активностьНАДФН-метгемоглобинредуктазыи приводит к быстромувосстановлениюметгемоглобинавгемоглобин
Процессипродуктыраспадагемоглобина,обменжелчныхпигментов,рольвдифференциальнойдиагностикежелтух.
Главнымиорганами,вкоторыхпроисходятразрушениеэритроцитовираспадгемоглобина,являютсяпечень,селезенкаикостный мозг.
Распадгемоглобинавпечениначинаетсясразрываα-метиновойсвязимеждуIиIIкольцами
порфириновогокольца.ЭтотпроцесскатализируетсяНАДФ-содержащейок-сидазойиприводиткобразованиюзеленогопигментавердоглобина
(холеглобина):
Дальнейший распад вердоглобина, вероятнее всего, происходит спонтанно сосвобождением железа, белка-глобина и образованием одного из желчных пигментов –биливердина. Спонтанный распад сопровождается перераспределением двойных связей иатомовводородавпиррольныхкольцахиметиновыхмостиках.Образовавшийсябиливердинферментативным путем восстанавливается в печени в билирубин, являющийся основнымжелчнымпигментом учеловекаиплотоядныхживотных.
ПослеэтогобилирубинвступаетвовзаимодействиесдиазореактивомЭрлиха.
При этом к билирубину присоединяются 2 остатка глюкуроновой кислоты собразованиемсравнительноиндифферентногокомплекса–билирубин-диглюкуронида,хорошорастворимоговводеидающегопрямуюреакциюсдиазореактивом.
Дальнейшая судьба желчных пигментов, точнее билирубина, связана с ихпревращениямивкишечникеподдействиембактерий.Сначалаглю-куроноваякислотаотщепляется от комплекса с билирубином и освободившийся билирубин подвергаетсявосстановлениювстеркобилиноген,которыйвыводитсяизкишечника.
Диагностика.
В моче определяется два типа желчный пигментов: билирубин и уробилиноиды.Желчныепигментыобразуютсявпечениприфизиологическомраспадегемоглобина.
Далее из печени пигменты попадают в желчный пузырь, затем в кишечник. Из кишечникапигменты часть пигмента выделяется с калом, а часть всасывается в кровь. С током кровипопадаетвпочки,изкоторыхвыводитсявместесмочой.Пигментыокрашиваютмочуикалвтемныйцвет.
Билирубин присутствует в моче в небольшом количестве, его увеличениесвидетельствуетозаболеванияхпечени(гепатите)илизастойныхявлениях,напримерприжелчекаменнойболезни.
При гепатитах (из-за нарушения функции печени) уробилиноиды неперерабатываются и их количество в крови возрастает. Следовательно, и увеличивается ихколичествовмоче.Повышениеуробилиноидоввмочевозникаетнанесколькоднейраньше,чем билирубина, что помогает предположить гепатит на ранних стадиях еще до появленияжелтухи.
Надпеченочные желтухиобусловлены повышенным распадом эритроцитов и, какследствие,повышеннымобразованиембилирубина,недостаточностьюфункциизахватабилирубинапеченью.
Печеночныежелтухиобусловленыпоражениемгепатоцитови,понекоторымданным,холангиол.Поведущемумеханизмуможновыделитьнескольковариантовпеченочных
желтух.Воднихслучаяхпеченочнаяжелтухасвязанаснарушениемэкскрецииизахватабилирубина, регургитацией билирубина. циррозе печени. В других случаях нарушаютсяэкскрециябилирубинаиего регургитация.
Подпеченочные желтухивозникают в результате нарушения проходимости желчныхпротоков,ведущиммеханизмомприэтомявляетсянарушениеэкскрецииирегургитациибилирубина.
Антиоксидантная система / аос /клетки. Ферменты аос.НизкомолекулярныеАо.Основныезвеньяантиоксидантнойсистемы.Природныеантиоксиданты(перечислитьклассы).
Синергизмдействияантиоксидантов.ЗначениеАОСвответнойреакцииорганизманавредныефакторыокружающейсреды.
Для обеспечения максимальной защиты от окислительного стресса клетки имеют хорошоразвитуюантиоксидантнуюсистему,котораясодержитразныенизко-ивысокомолекулярныесоединения,способные―перехватывать‖свободныерадикалыилинейтрализовать источник извозникновения.
Квысокомолекулярнымантиоксидантамотносятмембраносвязанныеицитозольныеферменты (супероксиддисмутаза, каталаза, глутатионзависимые пероксидазы итрансферазы).
Низкомолекулярныеантиоксидантыразделяютнажирорастворимые
(токоферолы,каротиноиды,убихинон) та водорастворимые (аскорбиновая кислота,глутатион,тиоредоксин,билирубин,ураты).Следуетотметить,чтоантиоксидантыбываютвнутрии внешнеклеточные.
Ферментыантиоксидантнойсистемы
Все ферменты антиоксидантной системы содержат в активном центре ионы металлов спеременнойвалентностью,которыевзависимостиотусловийвыступаюткакокислитель,таки восстановитель.
Супероксиддисмутазакатализируетреакциюдисмутациисупероксидныханион–радикалов:О2.-+О2.-=О2+Н2О2
В ходе реакции образовался пероксид водорода, он способен инактивировать СОД,поэтомусупероксиддисмутазавсегда«работает»впарескаталазой,котораябыстроиэффективнорасщепляетпероксидводороданаабсолютнонейтральныесоединения.
Каталаза(КФ1.11.1.6)–гемопротеин,которыйкатализируетреакциюобезвреживанияпероксидаводорода,образующегосяврезультатереакциидисмутациисупероксидногорадикала:
2H2O2=2H2O+O2
Природныеантиоксиданты—токоферолы(витаминыЕ),нордигидрогваяретовуюкислотуидр. — и синтетические антиоксиданты — пропиловый и додециловый эфирыгалловойкислоты,бутилокситолуол(ионол) идр
Классификацияантиоксидантов,являющихсяпопроисхождениюлекарственными
препаратами:
Субстратысвободнорадикальногоокисления—препаратыненасыщенныхжирныхкислот.
Природные антиоксиданты - препараты аминокислот, белков, нуклеиновых кислот иихпроизводных,которыереагируютспродуктамисвободнорадикальногоокисления.
Биоантиоксиданты—препаратывитаминов,гормонов,флавоноидов.
Модуляторысвободнорадикальногоокисления—препараты,содержащиемикроэлементы.
Механизм действия наиболее распространѐнных антиоксидантовсостоит в обрывереакционных цепей: молекулы антиоксиданта взаимодействуют с активными радикалами собразованием малоактивных радикалов. Окисление замедляется также в присутствиивеществ, разрушающих гидроперекиси. В этом случае падает скорость образованиясвободных радикалов. Даже в небольшом количестве антиоксиданты уменьшают скоростьокисления, поэтому в течение некоторого периода времени продукты окисления необнаруживаются.Впрактикеторможенияокислительныхпроцессовбольшоезначениеимеетявлениесинергизма— взаимного усиления эффективности антиоксидантов в смеси, либо вприсутствиидругихвеществ.
67. Как связано состояние антиоксидантной системы с углеводнымобменом?Какиебиохимическиетестыможноиспользоватьдляоценкиантиоксидантнойсистемыклетки?
Состояние углеводного обмена при сахарном диабете характеризуется компенсацией идекомпенсацией.Компенсация–этосостояние,прикоторомподвлияниемлечениядиабетадостигнутынормогликемияиаглюкозурия.
Декомпенсация– течение диабета, при котором количество глюкозы в сыворотке кровипревышает13,9ммоль/л(более250мгна100мл),ав моче–более50 гвсуткиприналичииразличнойстепени ацетонурии (кетоза).
Нарядусповышениемобразованияколичествасвободныхрадикаловприсахарномдиабетеснижается активность антиоксидантной системы, представленной глютатионом,супероксиддисмутазой,витаминами Е и С.
Диагностика
определениемсодержанияотдельныхантиоксидантоввплазме[10,13,48,50,346]иклетках
крови [10, 51, 105, 122] используют показатель, обозначаемый как антиоксидантнаяактивность (АОА) плазмы крови. АОА плазмы (сыворотки) крови - это интегральныйпоказатель, отражающий ее способность противодействовать развитиюсвободнорадикальных реакций [84, 162]. Основными компонентами тест-систем дляопределенияАОАплазмыкровиявляются:системагенерациирадикаловисубстратилимолекула-мишень, которая подвергается свободнорадикальному окислению [267, 290].Добавление в модельную систему плазмы крови, содержащей различные водо- ижирорастворимые антиоксиданты, приводит к уменьшению образования радикалов иторможениюокислениясубстрата.
Особенностиметаболизманервнойткани.Липидныекомпонентыибелкинервнойткани.Нейромедиаторы,строение,биосинтез.
Липидынервнойткани
Особенностьюнервнойтканиявляетсяиспользованиелипидоввкачествепластического(структурного)материала,втовремякаквдругихтканяхэтуфункциювыполняютбелки.
Липидыпредставленыцереброзидами,ганглиозидами,сфингомиелинами,плазмалогенами,фосфатидилсеринами,фосфатидилхолинами,фосфатидилинозитами,
фосфатидилэтаноламинамиихолестерином.Миелиновыемембраныимеют3слоябелкаи2слоялипидов
Белкиипептидынервнойткани
СпецифическимибелкамиявляютсябелокS-100,белок14-3-2,нейрофизин,нейротубулин,нейростенин.
Пептиды:карнозин,анзерин,гомокарнозин,гомоанзерин,энкефалины,эндорфины,пептидсна
Особенностиобменааминокислотвнервнойткани
В нервной ткани концентрация свободных аминокислот в 8 раз больше, чем в плазме крови.Центральноеместовобменепринадлежитглутаминовойкислоте,глутамину,аспарагиновойкислоте, ацетиласпарагиновой кислоте, у-аминомасляной кислоте. Глутаминовая кислотанейтрализирует аммиак в нервной ткани, превращаясь в глутамин, который удаляется черезГЭБ в кровь. у-Аминомасляная кислота образуется путем декарбоксилированияглутаминовой кислоты. Ацетиласпарагиновая кислота — это запасная форма храненияаминокислотвнервнойткани.
Образованиеаммиакавнервнойткани
Образование аммиака происходит в пуриновом цикле: путем гидролитическогодезаминирования АМФ образуется ИМФ и аммиак. ИМФ, далее конденсируясь саспарагиновойкислотой,образуетаденилосукцинат,который,расщепляясь,образуетвновьАМФ(и фумарат).
Энергетическийобменвнервнойткани
Глюкоза — основной источник энергии, так как через ГЭБ в нервные клетки поступаеттолько глюкоза, которая, расщепляясь в аэробном гликолизе, образует ПВК,превращающуюся с помощью пируватдегидрогеназного комплекса в ацетил-КоА, которыйвступаетвЦТК,даваявосстановленные эквивалентыдляокислительногофосфорилирования,приводящегокобразованиюАТФ.Вотличиеотдругихтканейорганизмачеловека ВЖК не проникают через ГЭБ и не могут быть использованы в качествеэнергетическогоматериала.
Медиаторы нервной системыСвязь миллиардов нейронов в нервной системе осу-ществляетсяпосредствоммедиаторов:ацетилхолина,норадреналина,дофамина,серотонина,гистамина,глицина,у-аминомаслянойкислоты.

ацетилхолин,сложныйэфирхолинаиуксуснойкислоты.Кнейромедиаторамотносятсянекоторые аминокислоты, а также биогенные амины, образующиеся придекарбоксилированииаминокислот.Известныенейромедиаторыпуриновогоряда—
производныеаденина.Самуюбольшуюгруппуобразуютпептидыибелки.
69.Белкимышечнойткани,особенностистроения.Механизмымышечногосокращенияскелетных и гладких мышц. Роль минеральных факторов вмышечномсокращении.
Белкиделятсянатриосновныхгруппы:
Саркоплазматическиебелки(35%);
Миофибриллярныебелки(45%);
Белкисарколемы(стромы).
Энергообеспечениемышечнойткани.Синтезкреатинаикреатинфосфата.
Источникиэнергииследующие.
Специальныереакциисубстратногофосфорилирования.
Гликолиз,гликогенолиз.
Окислительноефосфорилирование.
Специальныереакциисубстратногофосфорилирования.
Участие специальных реакций субстратного фосфорилирования в обеспечении энергиеймышечнойклеткиразлична-этозависитотинтенсивности,продолжительности,мощностиидлительностимышечной работы.
Креатинфосфокиназнаяреакция.
Креатин~фосфат +АДФ←→АТФ+креатин.
Это самый быстрый способ ресинтеза АТФ. Запасов креатинфосфата хватает дляобеспечениямышечной работывтечение20с.
Максимальноэффективен. Нетребуетприсутствиякислорода,недаетпобочныхнежелательных продуктов, включается мгновенно. Его недостаток - малый резерв субстрата(хватаеттолькона20сработы).ОбратнаяреакцияможетпротекатьвмитохондрияхсиспользованиемАТФ,образовавшейсявпроцессеокислительногофосфорилирования.
Мембрана митохондрий хорошо проницаема как для креатина, так и для креатин-фосфата, акреатинфосфокиназаестьивсаркоплазме,ивмежмембранномпространствемитохондрий.
Миокиназнаяреакция.Протекаеттольковмышечнойткани!2АДФ.миокислота→АТФ+АМФ
Реакциякатализируетсямиокиназой(аденилаткиназой).
ГлавноезначениеэтойреакциизаключаетсявобразованииАМФ-мощногоаллостерическогоактиватораключевыхферментовгликолиза,гликогенолиза,ГБФ-пути.Необходимоотметить,чтоувеличениеконцентрацииАМФвсаркоплазмеоказываетактивирующеевлияниенаферментыгликолиза
Гликолиз,гликогенолиз.
Не требуют присутствия кислорода (анаэробные процессы). Обладают большим резервомсубстратов. Используется гликоген мышц (2 % от веса мышцы) и глюкоза крови, полученнаяизгликогенапечени.
Недостаткиследующие.
1.Небольшаяэффективность:3АТФнаодинглюкозныйостатокгликогена.2.Накоплениенедоокисленныхпродуктов(лактат).
Гликолизначинаетсянесразу-толькочерез10-15спосленачаламышечнойработы.
Окислительноефосфорилирование.
Преимущества.
Этонаиболееэнергетическивыгодныйпроцесс-синтезируется38молекулАТФприокисленииодноймолекулыглюкозы.
Имеетсамыйбольшойрезервсубстратов:можетиспользоватьсяглюкоза,гликоген,глицерин,кетоновыетела.
Продуктыраспада(CO2иH2O)практическибезвредны.
Недостаток:требуетповышенныхколичествкислорода.
Важную роль в обеспечении мышечной клетки кислородом играет миоглобин, у которогосродство к кислороду больше, чем у гемоглобина: при парциальном давлении кислорода,равном30 мм.рт.ст.,миоглобиннасыщаетсякислородом на100 %,а гемоглобин-всего на 30
%.Поэтомумиоглобинэффективноотнимаетугемоглобиндоставляемыйимкислород.
Синтезкреатинаикреатинфосфата.
 Креатин
– вещество скелетных мышц, миокарда,
нервной ткани. В
видекреатинфосфатакреатинявляется"депо"макроэргическихсвязей,используетсядлябыстрогоресинтезаАТФвовремя
работы клетки.
Креатин
– вещество скелетных мышц, миокарда,
нервной ткани. В
видекреатинфосфатакреатинявляется"депо"макроэргическихсвязей,используетсядлябыстрогоресинтезаАТФвовремя
работы клетки.
Особенно показательна роль креатина вмышечнойткани.КреатинфосфатобеспечиваетсрочныйресинтезАТФвпервыесекундыработы(5-10сек),когданикакиедругиеисточникиэнергии (анаэробный гликолиз,аэробное окисление глюкозы,β-окисление жирных кислот)ещенеактивированы,икровоснабжениемышцы не увеличено.
ПримышечнойработеионыСа2+,высвободившиесяизсаркоплазматическогоретикулума,являютсяактиваторамикреатинкиназы
 Около3%креатинфосфатапостоянновреакциинеферментативногодефосфорилированияпревращаетсявкреатинин
Около3%креатинфосфатапостоянновреакциинеферментативногодефосфорилированияпревращаетсявкреатинин
Синтезкреатинаидетпоследовательновпочкахипеченивдвухтрансферазныхреакциях.Поокончаниисинтезакреатинстокомкровидоставляетсявмышцыилимозг.

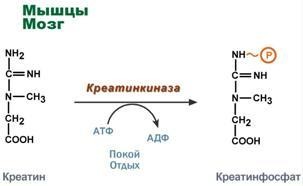 ЗдесьприналичииэнергииАТФ(вовремяпокояилиотдыха)онфосфорилируетсясобразованиемкреатинфосфата.
ЗдесьприналичииэнергииАТФ(вовремяпокояилиотдыха)онфосфорилируетсясобразованиемкреатинфосфата.
Компонентымежклеточногоматрикса.Строение,рольбелковколлагенаиэластина,протеогликановигликозамингликанов.
межклеточный матрикс -супрамолекулярный комплекс, образованный сложной сетьюсвязанных между собой макромолекул. В организме человека межклеточный матриксформируеттакиевысокоспециализированныеструктуры,какхрящ,сухожилия,базальныемембраны,атакже(привторичномотложениифосфатакальция)костиизубы.
МежклеточныйматрикскостнойизубнойтканиНеорганическаячасть
В состав костейвходит 99% всего кальция организма, 87% фосфора, ~ 60% магния и -25%натрия. Кальций в костях находится в форме минерала гидроксиапатита, В костной тканисодержитсямногомикроэлементов,такихкакмедь,стронций,барий,цинк,фторидр.,которые играют важную роль в обмене веществ в организме. Минеральная часть костейвключаеттакжекарбонаты, гидроксидыицитраты.
Минеральныйсоставзубаразличенвразныхегочастях.Твѐрдыечастизуба(эмаль,дентини цемент) содержат от 70% (цемент и дентин) до 96 - 97% (эмаль) неорганических веществ.Основную часть этих веществ составляют фосфат кальция, входящий в состав кристалловгидроксиапатита(75%),атакжекарбонатифторид кальция.
Органическаячасть
Органические вещества костного матрикса представлены белками, липидами инебольшимколичествомпротеогликанов.
Основной белок костной ткани - коллаген I типа (90 - 95%). Кроме него, в матриксе костейприсутствуют такие белки, как коллаген V типа, остеонектин, остеокальцин, так называемыеморфогенетические белки кости (BMP) и ферменты - щелочная фосфатаза (в остеобластах) икислая фосфатаза (в остеокластах). Оба эти фермента служат маркѐрами соответствующихклетоккостной ткани.
Главный компонент органических веществ зубной ткани- коллаген I типа. Углеводы илипидыприсутствуютвнебольшихколичествах.Содержаниеорганическихвеществвтвѐрдых частяхзубаварьируетот2%(эмаль)до30%(дентиницемент).
Mежклеточныйматрикссуставногохряща
Основныекомпонентымежклеточногохрящевогоматрикса-коллагенIIтипа,агрекан,гиалуроноваякислотаивода.Кромених,вмат-риксенаходятсямалыепротеогликаны,коллагеныVI,IX,XIтипов,связывающийбелок,другиенеколлагеновыебелки,разнообразныеростовыефакторы."Эндоскелет"хрящевогоматриксаобразованфибриллярной сетью, которая состоит из коллагенов II, IX и XI типов и придаѐт хрящупрочность.
Коллаген XI типа находится внутри фибрилл, образованных коллагеном II типа, он играетопределѐннуюрольвсборкеэтихфибрилл.КоллагенIXтипаантипараллельноприсоединяетсякфибрилламколлагенаIIтипа.Микрофибриллы,которыеобразуютсятетрамерамиколлагенаVIтипа,присоединяютсякфибрилламколлагенаIIтипаикгиалуроновойкислоте.
Mежклеточныйматрикскожнойткани
Основнойорганизующийкомпонентматриксакожнойткани-коллагенVIIтипа.
Пучкифибрилл,образованныедимерамиэтогоколлагена,своимиС-концамимогутприсоединятьсякlaminadensaбазальноймембраны(какбы"заякориваться"вней)иобразовыватьпетливсубэпидермисе.Такие"заякоренные"фибриллымогутсоединятьlaminadensaбазальноймембраныс"якорнымидисками"."Заякоренные"фибриллытакжезахватываютфибриллыколлагена IиIIIтипов
Таким способом "заякоренные" фибриллы коллагена VII типа обеспечивают присоединениеэпидермисак дерме.
Коллаген.
Коллагенсоставляет25–33%отобщегоколичествабелкаорганизмавзрослогочеловека,или6% от массы тела. Видимые в оптическом микроскопе коллагеновые волокна состоят изразличимых в электронном микроскопе фибрилл – вытянутых в длину белковых молекул,названныхтропоколлагеном.Тропоколлаген–основнаяструктурнаяединицаколлагена
Коллагеновоеволокнопредставляетсобойгетерогенноеобразованиеисодержит,кромебелкаколлагена,другиехимическиекомпоненты.Молекулатропоколлагена–этобелокколлаген.
Однойизотличительныхчертданногобелкаявляетсято,что1/3всехегоаминокислотных
остатковсоставляетглицин,1/3–пролини4-гидроксипролин,около1%–гидроксилизин;
Вразныхтканяхпреобладаютразныетипыколлагена,аэто,всвоюочередь,определяетсятойролью,которуюколлагениграетвконкретноморганеилиткани.
Коллаген-ярковыраженныйполиморфныйбелок.Внастоящеевремя известно19типовколлагена, которые отличаются друг от друга по первичной структуре пептидных цепей,функциями локализации ворганизме.
Эластин
Эластин-основнойбелокэластическихволокон,которыевбольшихколичествахсодержатсявмежклеточном веществе такихтканей,каккожа,стенкикровеносныхсосудов,связки,лѐгкие.
Резиноподобныесвойстваназванныхтканейобеспечиваютсяособенностямисоставаистроенияэластина-гликопротеина
Общими для эластина и коллагена являются большое содержание глицина и пролина,наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем вколлагене. Как и в коллагене, в эластине мало метионина и отсутствуют триптофан ицистеин.Вотличиеотколлагенавэластинезначительнобольшевалинаиала-нинаименьшеглутаминовойкислоты и аргинина.
При ферментативномгидролизеэластинав гидролизате обнаруживаютсядесмозиниизодесмо-зин. Очевидно, именно благодаря своей структуре десмозин и изодесмозин могутодновременно входить в состав четырех пептидных цепей. По-видимому, этим можнообъяснить,чтоэластинвотличиеотдругихфибриллярныхбелковспособенрастягиватьсявдвухнаправлениях.
Оказалось,чтоэтолизиннорлейцин,которыйобеспечиваетнарядусдесмозиномиизодесмозиномпоперечныесвязивмолекулеэластина:
Гликозаминогликаны-линейныеотрицательнозаряженныегетерополисахариды.гликозаминогликаны могут связывать большие количества воды, в результате чегомежклеточное веществоприобретает желеобразныйхарактер.
Гликозаминогликаны представляют собой длинные неразветвлѐнные цепи гетерополиса-харидов.Онипостроеныизповторяющихсядисахаридныхединиц.Одниммономеромэтогодисахаридаявляетсягексуроноваякислота,вторыммономером-производноеаминосахара/
Н-р,гиалуроноваяк-та:
Протеогликаны- высокомолекулярные соединения, состоящие из белка (5-10%) игликозаминогликанов(90-95%).Ониобразуютосновноевеществомежклеточногоматриксасоединительнойткани
Основной протеогликан хрящевого матрикса называетсяагрекан.Это очень большаямолекула, в которой к одной полипептидной цепи присоединены до 100 цепейхондроитинсульфатов и около 30 цепей кератансульфатов. В хрящевой ткани молекулыагрекана собираются в агрегаты с гаалуроновой кислотой и небольшим связывающимбелком.Обакомпонентаприсоединяютсякагреканунековалент-нымисвязямивобластидоменаG1.
Минеральныекомпонентыпищи.Классификация.Биохимическаяфункция. Биоусвояемые формы. Биохимическая функция цинка,селенаихрома,меди,железа.
МинеральныевеществаВколичественномотношениинаиболееважнымнеорганическимкомпонентомпищиявляетсявода.Увзрослогочеловекасуточнаяпотребностьвводесоставляет примерно 2,4 л. Эта цифра включает воду, поступающую в организм с твердой ижидкойпищей,ввиденапитков,атакжеводу,образующуюсявдыхательнойцепи
Жизненнонеобходимыеэлементыподразделяютсянамакроэлементы(суточнаяпотребность>100мг)имикроэлементы(суточнаяпотребность<100мг).Кмакроэлементам относятсянатрий (Na), калий (К), кальций (Ca), магний (Мg), хлор (Cl),фосфор (Р), сера (S) и иод (I).К жизненно важным микроэлементам, необходимым лишь вследовых количествах, относятся железо (Fe), цинк (Zn), марганец (Μn), медь (Cu), кобальт(Со), хром (Сr), селен (Se) и молибден (Мо). Фтор (F) не принадлежит к этой группе, однакооннеобходимдляподдержаниявздоровом состоянии костной и зубной ткани.Цинк.
Биологическаярольцинкаопределяетсяегонеобходимостьюдлянормальногороста,развития и полового созревания, а также обеспечения нормального кроветворения, вкуса иобоняния.Цинкнеобходимдлясинтезабелков,контролируетсократительнуюфункциюмышциучаствуетвсинтезеинсулина.требуетсядлянесколькихферментов,такихкаккарбоксипептидаза,алкогольнаядегидрогеназапечени,углероднаяангидраза.
Железо.
Этотэлементтесносвязансважнейшимифункциямиорганизма,являетсянезаменимойсоставнойчастьюгемоглобинаимиоглобина.Железовходитвсоставокислительно-восстановительныхферментов,участвуетвнасыщениимышечнойтканикислородомииграетважнуюрольвкроветворении.Требуетсядлямногихбелковиферментов,особенногемоглобина.Источникиврационевключаюткрасноемясо,зелѐныелистовыеовощи,рыбу(тунец,лосось),сухофрукты,бобы,виноград,цельныеиобогащѐнныезѐрна.
Селен.
Биохимическиефункцииселенаопределяютселенсодержащиебелки(СБ).Недостатокмикроэлементаможетприводитькнарушениюклеточнойцелостности,изменениюметаболизматиреоидныхгормонов,активностибиотрансформирующихферментов,усилениютоксическогодействиятяжѐлыхметаллов,повышениюконцентрацииглютатионавплазме.
ХарактернойособенностьюСБмлекопитающихявляетсято,чтоони,по-видимому,связанысокислительно-восстановительнымипроцессами,проходящимивнутриклеткиивнеее.кофактор,существенный для активности
антиоксидантныхферментов,такихкакглутатионпероксидаза.
Медь.
Медьвстречаетсявбольшомколичествеферментов,например,вцитохром-с-оксидазе,всодержащеммедьицинкферментесупероксиддисмутазе,ивпереносящеммолекулярныйкислородбелкегемоцианине. Предполагается, что медь и цинк конкурируютдруг с другом в процессе усваивания впищеварительном тракте, поэтому избыток одного изэтихэлементоввпищеможетвызватьнедостатокдругогоэлемента.Принедостаткемедивхондро-иостеобластахснижается активность ферментных систем и замедляется белковыйобмен,врезультатезамедляетсяинарушаетсяросткостныхтканей
Хром.
Хром —одинизбиогенныхэлементов,постоянновходитвсоставтканейрастенийиживотных.Уживотныххромучаствуетвобменелипидов,белков(входитвсоставферментатрипсина),углеводов.Снижениесодержанияхромавпищеикровиприводитк уменьшению скорости роста, увеличениюхолестеринав крови.
Макро-имикроэлементы.Ролькальциявметаболизмеикостнойсистеме(обосноватьрольвитаминовидругихминералов).
Всеминеральныевеществавзависимостиотихконцентрации,подразделяютсянамакро-имикроэлементы. Содержание макроэлементов превышает 50 мг/кг массы тела (натрий икалий,кальций,магний,фосфат,хлорид,сульфат).Содержаниемикроэлементовсоставляетменее50 мг/кгмассы тела(медь, цинк,селен, кобальти др.).
Микроэлементывыполняют важную физиол. роль и необходимы для нормальнойжизнедеятельности. Дефицит или избыток их приводит к т. наз. биогеохим. эндемиям -заболеваниям растений, животных и человека. Территории распространения этихзаболеваний наз. биогеохим. провинциями. Так, распространение эндемич. зоба во мн.горныхивнутри-континент.районахсвязаносдефицитомIвпищеиводе,кариесзубов-сдефицитомFвводе,флюороз-тяжелоезаболеваниескелета-сизбыткомF
Дляборьбысдефицитоммикроэлементовиспользуютфторированиепитьевойводы,иодированиеповареннойсоли,препаратыСо(витаминВ12)вмедицине.
Этиэлементыслагаютплотьживыхорганизмов.Кмакроэлементамотносяттеэлементы,рекомендуемаясуточнаядозапотреблениякоторыхсоставляетболее200мг.
Макроэлементы,какправило,поступаютворганизмчеловекавместеспищей.
Биогенныеэлементы
Кислород—70%
Углерод—17%
Водород—10%
Азот—3%
Этимакроэлементыназываютбиогенными(органогенными)элементами
илимакронутриентами. Из макронутриентов преимущественно построены такиеорганическиевещества,какбелки,жиры,углеводыинуклеиновыекислоты.
Кальций.
Кальций-наиболеераспространенныйэлементворганизме
Кроместруктурнойфункциикальцийвлияетнапроницаемостьклеточныхмембран,действуякак вторичный мессенжер, инициируя ответы клеток на различные стимулы. Перемещениекальция из внутриклеточного пространства во внеклеточную среду обеспечивает такиесобытия, как дифференцировку клетки, сокращение, секрецию и перистальтику. Множествоферментов,включаяте,чтоучаствуютвсистемесвертываниикрови,зависятоткальция.
Кальций влияет на функцию эндокринных желез (особенно околощитовидных), оказываетпротивовоспалительное и десенсибилизирующее действие, находится в биологическомантагонизме с ионами натрия и калия. Кальций необходим для нормальной возбудимостинервнойсистемы,сократимостимышц,являетсяактиватороммногихферментовигормонов,представляетсобойважныйкомпонент,необходимыйдлясвертываниякрови.
Кальцийобладаетвысокойбиологическойактивностью,выполняетворганизме
многообразныефункции.Основныефункциикальцияворганизме:
Регуляциявнутриклеточныхпроцессов.
Регуляцияпроницаемостиклеточныхмембран.
Регуляцияпроцессовнервнойпроводимостиимышечныхсокращений.
Поддержаниестабильнойсердечнойдеятельности.
Формированиекостнойткани,минерализациязубов.
Участиевпроцессах свертываниякрови.
Кфункциямкальцияворганизмеотносятся:
структурная(кости,зубы);
сигнальная(внутриклеточныйвторичныймессенджер-посредник);
ферментативная(коферментфакторовсвертываниякрови);
нейромышечная(контрольвозбудимости,выделениенейротрансмиттеров,инициациямышечногосокращения).
Главная роль в метаболизме кальция в организме человека принадлежит костной ткани. Вкостях кальций представлен фосфатами — Са3(РО4)2(85%), карбонатами — СаСО3(10%),солямиорганическихкислот—лимоннойимолочной(около5%).
Вбелкахсистемысвертываниясодержатсякальций-связывающиеучастки,образованиекоторыхзависит от витаминаК.
Механизм обезвреживания ксенобиотиков ибиотрансформациилекарств и эндогенных метаболитов: система микросомальногоокисления.ЦитохромР-450.Строениеактивногоцентра.ТипыреакцийцитохромаР-450.СистемацитохромаР-450иb5,
компонентысистемы.Витаминыиминералывфункционированиисистемы.
Обезвреживание большинства ксенобиотиков происходит путѐм химическоймодификацииипротекаетв2фазы(рис.12-1).Врезультатеэтойсерииреакцийксенобиотикистановятсяболеегидрофильнымиивыделяютсясмочой.
Вещества,болеегидрофобныеилиобладающиебольшоймолекулярноймассой(>300 кД), чаще выводятся с жѐлчью в кишечник и затем удаляются сфекалиями.
Сисгемаобезвреживаниявключаетмножестворазнообразныхферментов,поддействием которых практически любой ксенобиотик может бытьмодифицирован.
Стадии.
Микросомальноеокисление
Микросомальные оксидазы - ферменты, локализованные в мембранах гладкогоЭР,
Микросомальная сисгема не содержит растворимых в цитозоле белковыхкомпонентов,всеферменты-мембранныебелки,активныецентрыкоторыхлокализованы на цитоплазматической поверхности ЭР. Сисгема включаетнесколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭРсуществуютдветакиецепи,перваясостоитиздвухферментов-NADPH-
P450редуктазыицитохромаР450,втораявключаетферментNADH-цитохром-b5редуктазу,цитохромb5иещѐодинфермент-стеароил-КоА-десатуразу.
Электронтранспортнаяцепь-NADPH-P450редуктаза-цитохромР450.Вбольшинстве случаев донором электронов (e) для этой цепи служит NADPH,окисляемый NАDРН-Р450 редуктазой. Фермент в качестве простетическойгруппы содержит 2 кофермента - флавинаденинди-нуклеотид (FAD) ифлавинмононуклеотид (FMN). Протоны и электроны с NADPH переходятпоследовательно на коферменты NADPH-P450 редуктазы. ВосстановленныйFMN(FMNH2) окисляетсяцитохромомР450
ЦитохромР450-гемопротеин,содержитпростетическуюгруппугемиимеетучасткисвязываниядлякислородаисубстрата(ксенобиотика).
СвязываниевактивномцентрецитохромаР450липофильноговеществаRHимолекулы кислорода повышает окислительную активность фермента. Одинатомкислородапринимает2еипереходитвформуО2-.ДоноромэлектроновслужитNADPH,которыйокисляетсяNADPH-цитохромР450редуктазой.О2-взаимодействует с протонами: О2-+ 2Н+→ Н2О, и образуется вода. ВторойатоммолекулыкислородавключаетсявсубстратRH,образуягидроксильнуюгруппувещества R-OH(рис.12-3).
СуммарноеуравнениереакциигидроксилированиявеществаRHферментамимикросомальногоокисления:
RH+О2+ NADPH+ Н+→ ROH+Н2О+NADP+.
Субстратами Р450могут быть многие гидрофобные вещества как экзогенного(лекарственныепрепараты,ксенобиотики),такиэндогенного(стероиды,жирныекислоты идр.)происхождения.
Такимобразом,врезультатепервойфазыобезвреживаниясучастиемцитохромаР450происходитмодификациявеществсобразованиемфункциональныхгрупп,повышающихрастворимостьгидрофобногосоединения.
NADH-цитохром b5редуктаза - двухдоменный белок. Глобулярныйцитозольныйдоменсвязываетпростетическуюгруппу-коферментFAD,аединственныйгидрофобный"хвост"закрепляетбелоквмембране.
Цитохром b5- гемсодержащий белок, который имеет домен, локализованный наповерхностимембраныЭР,икороткий"заякоренный"влипидномбислоеспирализованныйдомен.
NADH-цитохромb5-редуктазаицитохромb5,являясь"заякоренными"белками,нефиксированыстрогонаопределѐнныхучасткахмембраныЭРи
поэтомумогутменятьсвоюлокализацию.
Вторая фаза системы детоксикации. Виды, ферменты и коферментыреакций конъюгации. Механизмы глутатионовой и глюкурониднойконъюгации,реакцияацетилирования.
Конъюгация-втораяфазаобезвреживаниевеществ
Вторая фаза обезвреживания веществ - реакции конъюгации, в ходе которых происходитприсоединение к функциональным группам, образующимся на первом этапе, других молекулили групп эндогенного происхождения, увеличивающих гидрофильность и умеНbшающихтоксичностьксенобиотиков
Всеферменты,функционирующиевовторойфазеобезвреживанияксенобиотиков,относяткклассутрансфераз.Онихарактеризуютсяширокойсубстратнойспецифичностью.
УДФ-глюкуронилтрансферазы
ЛокализированныевосновномвЭРуридин-дифосфат(УДФ)-глюкуронилтрансферазыприсоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходемик-росомальногоокисления.
ВобщемвидереакциясучастиемУДФ-глюкуронилтрансферазызаписываетсятак:ROH+УДФ-С6Н9О6=RO-C6H9O6+УДФ.
Сульфотрансферазы
Цитоплазматическиеcульфотрансферазыкатализируютреакциюконъюгации,входекоторойостатоксернойкислоты(-SO3H)от3'-фосфоаденозин-5'-фосфосульфата(ФАФС)присоединяетсяк фенолам, спиртамилиаминокислотам
Глутатионтрансферазы
Глутатионтрансферазыфункционируютвовсехтканяхииграютважнуюрольвинактивациисобственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина,жѐлчныхкислот, продуктов.
Глутатион- трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединѐн к цис-теинукарбоксильной группой радикала).
ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химическоймодификациисучастиемглугатионаподвергаютсятолькоте,которыеимеютполярнуюгруппу.
Обезвреживание,т.е.химическаямодификацияксенобиотиковсучастиемГТ,можетосуществлятьсятремяразличными способами:
путѐмконъюгациисубстратаRсглутатионом(GSH):
R+GSH→GSRH,
врезультатенуклеофильногозамещения:
RX+GSH→ GSR+НХ,
восстановленияорганическихпероксидовдоспиртов:
R-HC-O-OH +2GSH→R-HC-OH+GSSG+H2O
Ацетилтрансферазы,метилтрансферазы
Ацетилтрансферазы катализируют реакции конъюгации - переноса ацетильного остатка отацетил-КоА на азот группы -SO2NH2, например в составе сульфаниламидов. Мембранные ицитоплазматические метилтрансферазы с участием SAM метилируют группы -Р=О, -NH2иSH-группыксенобиотиков.
ГлутатионоваяконъюгацияосновананареакционнойспособностиGSHвзаимодействоватьс ксенобиотиками, которые содержат электрофильные углеродные атомы, в следующихпроцессах.Катализирует реакцииглутатион-S-трансфераза.Ферментустраняетгалогены.
Аналогично происходит замещение лабильных нитрогрупп или сульфатов. Субстратами дляглутатион-S-трансферазы служат ареновые окислы, алифатические эпоксиды или вещества сненасыщеннымисвязями.ВреакцияхстиоцианатамиGSHвыступаетвкачествесоединения,атакующегоэлектрофильнуюсеру.Ферментвнекоторыхслучаяхвыполняетроль
«нитратэфирнойредуктазы».ЗдесьGSHвзаимодействуетсэлектрофильнымазотом.Помереобразования и выделения меркаптуровой кислоты при действии различных ксенобиотиков втканяхпроисходитбыстроеснижениесодержанияGSH.
Спомощьюкакихбиохимическихтестовможнооценитьфункциональноесостояниепечени?
Современная панель биохимических тестов включает в себя большое число ферментов,которые,однако,невсегдаобладаютдостаточнойспецифичностьюичувствительностью
Аланинаминотрансфераза(алт)
АЛТ,илиглутамил-пируваттрансфераза(ГПТ),встречаетсяпочтивовсехклеткахорганизма,нопреимущественновпечениипочках.Болезнипечениявляютсянаиболеечастой,нонеединственнойпричинойповышенияактивностиАЛТ.Приналичииповреждения печени уровень АЛТ в пределах нормальных значений может наблюдаться прихроническомгепатитеСижировойпечени,особенноубольныхсминимальнойвоспалительной активностью. Кроме того, нормальный уровень АЛТ нередко выявляется убольныхгемохроматозом,притерминальнойстадиипеченочнойнедостаточностииалкогольной болезни печени на фоне выраженного дефицита пиродоксальфосфата (витаминаВ6)-кофактораАЛТ.
Аспартатаминотрансфераза(аст)
АСТ,илиглутамилоксалоацетаттрансфераза(ГОТ),имеетменьшуюдиагностическуючувствительность , чем АЛТ. Обнаружение повышенного уровня аминотрансфераз (АЛТ иАСТ)всывороткекровиявляетсядостаточночувствительнымтестомдляустановленияболезнейпечени.Приэтомспецифичностьданноготестазависитотуровнягиперферментемии.
Щелочнаяфосфатаза(щф)
ЩФ- группа гетерогенных изоэнзимов, участвующих в транспорте различных субстратовчерез клеточную мембранную Содержится (в убывающем порядке) в плаценте, слизистойоболочкеподвздошнойкишки,почках,костяхипечени.
ПеченочнаяЩФобнаруживаетсявгепатоцитахиэпителиижелчныхпротоковкакв
цитоплазме, так и на поверхности клеток. Считается, что холестаз стимулирует синтез ЩФгепатоцитами. При обструкции желчных протоков на любом уровне повышение ЩФ всегдапредшествует началу желтухи. Повышение активности ЩФ без сопутствующего повышенияуровнябилирубинатребуетисключенияпервичногоилиметастатическогоракапечени,лимфомыилиинфильтративныхзаболеваний,такихкаксаркоидозиамилоидоз.ВнекоторыхслучаяхповышениеЩФможетбытьединственнымпроявлениемпораженияпечени.
Гамма-глутамилтрансфераза(ггт)
ГГТявляетсямембраносвязаннымферментомивубывающейпоследовательностипредставленавпроксимальныхканальцахнефрона,печени,поджелудочнойжелезе(протоковые и ацинарные клетки), кишечнике. Активность ГГТ в сыворотке крови в первуюочередь обусловленапеченочнымизоферментом.
Лактатдегодрогеназа(ЛДГ)-менееспецифичныймаркерповреждениягепатоцитовиобычгнонедобавляетдиагностическойинформациикужеполученнойнаоснованииисследованияАЛТиАСТ.Исключениемявляетсякратковременное,нозначительноеповышение активности ЛДГ при ишемии печени и продолжительное повышение уровня ЛДГвсочетаниисЩФ, указывающеенаинфильтрациютканипечениопухолью.
Патологическиекомпонентымочи,ихпроисхождение.Диагностическое значение определения патологических компонентовмочи.
Протеинурия.Этотсимптомнаблюдаетсяпризаболеванияхпочек,которыесопровождаютсяструктурно-функциональным нарушением гломерулярных мембран, например, при нефри-тах, нефрозах. Как физиологическое явление протеинурия встречается при беременности(частоклиницистыиспользуюттермин«альбуминурия».Оннеточен,таккакпризаболевании почек в мочу могут выделяться не только альбумины, но и глобулины, особеннопри нефрозах). Различают: 1. почечную альбуминурию (результат повреждения нефрона) и 2.внепочеч-ную альбуминурию (при заболеваниях мочевыводящих путей или предстательнойжелезы).
Ферменты.Вмочевнезначительнойконцентрацииприсутствуютразличныеферменты(липаза,а-амилаза,РНК-азы,ЛДГ,протеазы,фосфатазы).Прирядезаболеванийихконцентрациявмочевозрастает:так,приостромпанкреатитерезкоувеличиваетсядиастазная(амилазная)активность мочи.
Глюкозурия. Она наблюдается при превышении максимума реабсорбции глюкозы (около 10ммоль/л) в почечных канальцах, например, при сахаром диабете, когда выделение глюкозы смочой может достигать нескольких граммов в сутки. Помимо диабета глюкозурия можетотмечатьсяубольныхтиреотоксикозом,присильномстрессе,назначенииглюкокортикоидов.Вподавляющембольшинствеслучаевглюкозурияявляетсяследствиемгипергликемии,превышающей почечный порог (около 10 ммоль/л). Глюкозурия, причиной которой являетсядефекттранспортнойсистемыпочечныхканальцев,называетсяренальнымдиабетом
(уровеньглюкозывкровиприэтомнормальный).Вмочемогутприсутствоватьвопределяемых количествах пентозы, фруктоза, галактоза (при врождѐнной недостаточностиферментовихметаболизма),чтонеобходимопомнитьприисследованиимочинасахар.
Гемоглобинурия. Этот симптом отмечается при тяжелом внутрисосудистом гемолизе. Ге-матурия-появлениеэритроцитоввмоче,бываетдвухвидов:1.внепочечная-притравмированиимочевыводящихпутейи2.Почечная-принарушениипроницаемостипочечных клубочков (острыйнефрит).
Кетонурия. Кетонурия является следствием повышенного катаболизма липидов. Образую-щееся вследствие этого высокое содержание ацетил-КоА в тканях, например, при сахарномдиабетеиголодании,приводиткинтенсивномуобразованиюкетоновыхтел,которыепоступают в кровь и выделяются с мочой. Кетонурия бывает резко выражена при сахарномдиабете,она-постоянныйспутникголоданияинизкоуглеводногопитания.Кетонурияотмечаетсяпри инфекционныхзаболеваниях
Желчные пигменты. В норме моча содержит уробилин (точнее, стеркобилин). Концентра-циябилирубинавнейоченьнизка.Резкое возрастаниесодержаниябилирубинавмоче,котораяприэтомприобретает«цветпива»,наблюдаетсяпримеханическойжелтухе.Увеличениеегоконцентрациихарактерноидляпаренхиматознойжелтухи(гепатиты).Вмочупоступает обычно прямой билирубин (диглюкуронид билирубина - маленькая молекула).Непрямой билирубин может появляться в моче только при тяжѐлом нарушении клубочковойфильтрации(одновременноспроте-инурией).Концентрацияуробилиназначительноувеличиваетсяпригемолитическойжелтухе(из-заусиленногораспадагемоглобинаипоступления большого количества уробилиногена в кишечник) и паренхиматозной желтухе(из-занарушенияспособностигепатоцитовразрушатьмезобилиногени уробилиноген).
Порфирины. При злокачественной анемии и заболеваниях печени их количество в мочеможет увеличиваться на порядок и выше. Существуют врождѐнные порфирии, при которыхимеетсясверхпродукция некоторыхпорфиринов.
Камни в почкахКамни в почках в основном состоят из: оксалата кальция (2/3 всех случаев),фосфатакальция(особеннопригиперпаратиреоидизме),магний-аммонийныхфосфатов,уратов (соли мочевой кислоты, в избытке выделяющиеся при подагре). Вероятно, в основеобразования камней в почках лежит нарушение обмена веществ, в частности, увеличениевыделениякамнеобразующих(лито-генных) субстанций.
