
- •ОГЛАВЛЕНИЕ
- •ОБСТРУКТИВНЫЕ ЗАБОЛЕВАНИЯ ЛЕГКИХ
- •Хроническая обструктивная болезнь легких (ХОБЛ)
- •Бронхиальная астма (БА)
- •Вопросы для самоконтроля
- •Воспалительные и нагноительные заболевания легких
- •Пневмонии
- •Госпитальная пневмония
- •Вопросы для самоконтроля
- •НЕФРОЛОГИЯ
- •Иммунные заболевания почек
- •Гломерулонефриты
- •Инфекционно-воспалительные заболевания почек
- •Пиелонефрит
- •Хроническая болезнь почек (ХБП)
- •Вопросы для самоконтроля
- •Железодефицитная анемия
- •Меголобластные анемии
- •Гемолитические анемии
- •Наследственные гемолитические анемии, обусловленные изменениями мембраны эритроцитов. Болезнь Минковского-Шоффара
- •Пароксизмальная ночная гемоглобинурия (болезнь Маркиафавы-Микели)
- •Апластическая анемия
- •Вопросы для самоконтроля
- •Острые лейкозы
- •Острые лейкозы
- •Вопросы для самоконтроля
- •Хронические лейкозы
- •Хронический лимфолейкоз
- •Миелопролиферативные заболевания
- •Хронический миелолейкоз
- •Хронический идиопатический миелофиброз
- •Истинная полицитемия
- •Вопросы для самоконтроля
- •Парапротеинемические гемобластозы
- •Общие вопросы
- •Множественная миелома
- •Вопросы для самоконтроля
- •Лимфомы
- •Общие вопросы
- •Лимфогранулематоз
- •Неходжкинские злокачественные лимфомы
- •Вопросы для самоконтроля
- •Геморрагические диатезы
- •Общие вопросы
- •Болезнь Рандю-Ослера-Вебера (наследственная телеангиоэктазия)
- •Болезнь Шенлейн-Геноха (Геморрагический васкулит)
- •Болезнь Верльгофа (Идиопатическая тромбоцитопеническая пурпура, аутоиммунная тромбоцитопения)
- •Гемофилия
- •Вопросы для самоконтроля
- •Ревматоидный артрит (РА)
- •Остеоартроз (ОА)
- •Подагра
- •Реактивный артрит (РеА)
- •Псориатический артрит (ПсА)
- •Анкилозирующий спондилоартрит (болезнь Бехтерева)
- •Системные болезни соединительной ткани
- •Системная красная волчанка (СКВ)
- •Системная склеродермия
- •Дерматомиозит
- •Системные васкулиты
- •Классификация
- •Болезнь Хортона
- •Болезнь Кавасаки
- •Гранулематоз Вегенера
- •Синдром Чарга-Стросса
- •Микроскопический полиангиит
- •Вопросы для самоконтроля
- •Ахалазия кардии
- •Гастроэзофагеальная рефлюксная болезнь
- •Хронический гастрит
- •Язвенная болезнь желудка и двенадцатиперстной кишки
- •Воспалительные заболевания кишечника Болезнь Крона
- •Болезнь Уиппла
- •Неспецифический язвенный колит
- •Вопросы для самоконтроля
- •Заболевания желудочно-кишечного тракта: желчного пузыря, печени и поджелудочной железы
- •Хронический бескаменный холецистит
- •Хронический гепатит
- •Аутоиммунный гепатит
- •Алкогольная болезнь печени (АБП)
- •Цирроз печени.
- •Гемохроматоз
- •Болезнь Коновалова - Вильсона
- •Лекарственные поражение печени
- •Цирроз печени
- •Хронический панкреатит
- •Вопросы для самоконтроля
40. Больная Г., 33 лет, предъявляет жалобы на одышку, сердцебиения, повышенную утомляемость, страдает частыми бронхитами и пневмониями, рецидивирующими десневыми, носовыми, маточными кровотечениями. Объективно: систолический шум на верхушке, ЧСС 98 уд/мин. В общ. анализе крови эритр. – 2,3 Т/л, гемогл. – 66 г/л, ЦП – 0,9, ретикул. – 0%, тромб. – 60 Г/л, лейкоц. – 2,5 Г/л, эоз. –1%, базоф. – 0%, пал. – 0%, сегм. – 16%, лимф. – 79%, мон.-5%, СОЭ – 26 мм/ч. При гистологическом исследовании костного мозга наблюдаются небольшие очаги кроветворения на фоне замещения его жировой тканью. Какие препараты следует использовать для лечения такой больной?
A. Циклоспорин А в сочетании с антилимфоцитарным глобулином; В. Переливание свежезамороженной плазмы; С. Глюкокортикостероиды;
D. Препараты железа в сочетании с антилимфоцитарным глобулином; Е. Витамин В 12 в сочетании с циклоспорином А.
Ответы на вопросы для самоконтроля:
1-А, 2-А, 3-А, 4-А, 5-А, 6-В, 7-С, 8-В, 9-А, 10-С, 11-А, 12-D, 13-D, 14-А, 15-C, 16-A, 17-A, 18- E, 19-B, 20-A, 21-E, 22-A, 23-E, 24-E, 25-E, 26-A, 27-B, 28-B, 29-A, 30-E, 31-D, 32-A, 33-A, 34- C, 35-B, 36-B, 37-C, 38-C, 39-C, 40-A
Острые лейкозы
Острые лейкозы
Определение. Острые лейкозы представляют собой гетерогенную группу опухолевых заболеваний системы крови - гемобластозов, которые характеризуются первичным поражением костного мозга морфологически незрелыми кроветворными (бластными) клетками с вытеснением нормальных элементов и инфильтрацией бластами различных тканей и органов.
Эпидемиология. Острый лейкоз довольно редкое заболевание и составляет лишь 3% злокачественных опухолей человека. Однако среди гемобластозов он занимает одно из первых мест по частоте встречаемости. Заболеваемость составляет в среднем 5 случаев на 100 000 населения в год. В 75% случаев острый лейкоз диагностируется у взрослых.
Этиология. В большинстве случаев конкретная причина возникновения острого лейкоза остается неизвестной. Однако существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания:
1.Вирусы – РНК-ретровирусы, ДНК-вирус Эпштейна-Барр
2.Ионизирующая радиация
3.Курение
4.Химическое воздействие – бензол
5.Цитостатические препараты
6.Наследственные и врожденные заболевания – синдром Дауна, врожденный агранулоцитоз, анемия Фанкони и другие.
Острый лейкоз является следствием повреждения (мутации) в генетическом материале стволовой клетки - предшественницы всех ростков гемопоэза. В настоящее время обнаружена взаимосвязь между аберрациями хромосом, наблюдаемыми с большой частотой
ипостоянством при некоторых формах опухолей у человека, и онкогенными эффектами. Сделаны важные открытия, свидетельствующие о том, что специфические трнаслокации
70
хромосом могут привести к злокачественному росту в результате активации нормальных клеточных генов. У человека определена хромосомная локализация свыше двух десятков генов, которые можно назвать онкогенами, так как их активация является причиной развития специфических опухолей, связанных с мутациями и перестройками хромосом. Наблюдается четкое совпадение между локализацией онкогенов в хромосомах и точками разрывов хромосом, вовлеченных в перестройки при некоторых типах лейкозов.
Патогенез. Хромосомные повреждения гемопоэтических стволовых клеток вызывают клональный рост, означающий, что потомство одной мутировавшей клетки несет в себе все признаки ее мутации. Бластные клетки самовозобновляются, но не дифференцируются до зрелых форм как в норме, что приводит к быстрой замене нормальных гемопоэтических элементов костного мозга.
Гемобластозы объединяет ряд общих черт, относящихся к категории первичных механизмов патогенеза:
1.«Системность» поражения, обусловленная ранним метастазированием опухолевых клеток в органы кроветворения.
2.Клоновое происхождение.
3.Опухолевая прогрессия – качественные изменения в поведении и морфологии опухолевых клеток по мере развития заболевания, возникающие в результате повышенной изменчивости их генетического аппарата. Опухолевая прогрессия характеризуется следующими признаками:
- гемобластозы в своем развитии проходят две стадии: моноклоновую (доброкачественную) и поликлоновую – появление в рамках первоначального опухолевого клона новых мутантных субклонов (злокачественную);
- угнетение нормального кроветворения и в первую очередь ростка, послужившего источником опухолевого роста;
- опухолевые клетки могут терять ферментную специфичность цитоплазматических включений и становиться морфологически и цитохимически неидентифицируемыми;
- форма ядра и цитоплазмы бластных клеток претерпевает скачкообразные или постепенные изменения от круглой к неправильной и большей по площади;
- в условиях современной цитостатической терапии появление резистентности опухоли к ранее эффективному лечению означает качественно новый этап ее развития
Классификация. В связи с тем, что при мутации стволовой клетки могут повреждаться как миелоидный, так и лимфоидный ростки кроветворения, согласно иммунологической классификации, выделяют:
1. Острые лимфобластные лейкозы: а) В-клеточный б) Т-клеточный
в) Недифференцируемый или ни Т, ни В-ОЛЛ
2.Острые нелимфобластные лейкозы, согласно франко-американско-
британской (FAB) классификации, делятся на:
М0 – острый миелобластный недифференцированный лейкоз М1 – острый миелобластный лейкоз без созревания М2 – острый миелобластный лейкоз с созреванием М3 – острый проимелоцитарный лейкоз М4 – острый миеломонобластный лейкоз М5 – острый монобластный лейкоз
М6 – острый эритробластный лейкоз (эритромиелоз)
71
М7 – острый мегакариобластный лейкоз Среднее соотношение миелоидных и лимфоидных лейкозов составляет 6:1. Тем не
менее в детском возрасте в 80-90% случаев отмечаются лимфобластные формы, а после 40 лет наблюдается обратное соотношение – у 80% больных выявляется миелоидный вариант заболевания.
Стадии острого лейкоза.
1.Развернутая (дебют, манифестация) – выраженное угнетение нормального кроветворения, высокий бластоз костного мозга. Клиническая манифестация опухоли происходит тогда, когда ее масса составляет 1012 клеток.
2.Терминальная – прогрессирование заболевания, несмотря на цитостатическую терапию на фоне полного угнетения всех ростков кроветворения.
Клиника. Основные клинические проявления острых лейкозов обусловлены замещением нормальной гемопоэтической ткани опухолевыми клетками, что проявляется угнетением трех ростков кроветворения – эритроидного, тромбоцитарного и лейкоцитарного, инфильтрацией бластами различных органов и продукцией различных цитокинов. Выделяют следующие основные синдромы:
1.Анемический синдром
2.Синдром инфекционных осложнений – лихорадка, язвенно-некротические поражения (ЖКТ, миндалин), пневмонии и другие.
3.Геморрагический синдром – от петехиальных высыпаний до тяжелых кровотечений
4.Гиперпластический синдром: увеличение периферических лимфатических узлов, печени, селезенки, гиперплазия десен
5.Болевой синдром – боли в костях, суставах.
Особого внимания заслуживают внекостномозговые проявления острого лейкоза: 1. Нейролейкемия
-Ее возникновение обусловлено метастазированием лейкозных клеток в паутинную и мягкую оболочки головного и спинного мозга у 50% больных, что проявляется менингеальным синдромом: тошнота, рвота, головная боль, ригидность затылочных мышц.
-В ряде случаев наблюдается лейкозная инфильтрация периферических и черепных нервов с разнообразными двигательными и чувствительными нарушениями или
-обнаруживается очаговое поражение вещества головного мозга (интратумор). Отсутствие клинических проявлений нейролейкемии не означает отсутствие
лейкозного поражения оболочек.
2.Поражение кожи – лейкемиды - розовые или светло-коричневые уплотнения, возвышающиеся над кожей.
3.Десен – гиперемированы с участками кровоизлияий, нависают над зубами
4.Инфильтрация печени – увеличенная, безболезненная
4. Яичек – увеличение, уплотнение
6.Почек – признаки почечной недостаточности
7.Миокарда – признаки сердечной недостаточности 8.Пневмонит – сухой кашель, повышение температуры, одышка.
Дополнительные методы исследования
I. Общий клинический анализ крови: колебания от нормального анализа до панцитопении, или избирательного снижения одного ростка, уровень лейкоцитов может быть нормальным, сниженным и повышенным.
-лейкемическая фаза – с выходом бластов в периферическую кровь (рис. 4.1);
-алейкемическая – без их появления в крови
72
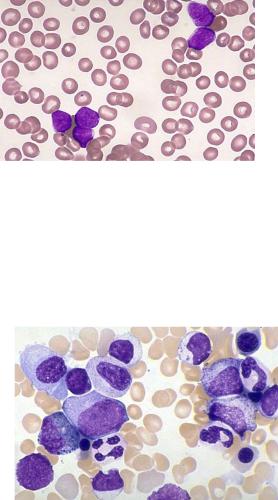
Рис. 4.1. Бластные клетки в крови больного острым лейкозом
II. Миелограмма: Миелограмма – более 20% бластов (рис. 4.2). Бластные клетки являются фоменными элементами размером 18-22 мкм в диаметре, с нежной структурой ядра и равномерным распределением хроматиновых нитей, образующих тонкопетлистую сеть; ядра содержат от 2 до 5 ядрышек, окрашенных в синий цвет; цитоплазма различной степени базофилии окружает ядро небольшим пояском. При обнаружении в миелограмме менее 20% (5-20%) бластных клеток устанавливается диагноз миелодиспластического синдрома.
Рис. 4.2. Бластные клетки в костном мозге больного острым лейкозом.
III. Цитохимическое исследование бластных клеток для установления варианта острого лейкоза.
-Цитохимически все острые лимфобластные лейкозы являются негативными на миелопероксидазу, судан черный (окраска на липиды), хлорацетатэстеразу и α- нафтилэстеразу (рис. 4.3). Наиболее характерной для ОЛЛ является выраженная реакция на гликоген в виде концентрических скоплений вокруг ядра лимфобласта его грубых гранул (PAS-реакция в глыбчатой ли гранулярной форме).
-Положительная реакция на кислую фосфатазу при возможной отрицательной реакции на гликоген отличает Т-клеточный ОЛЛ.
-При ОМЛ отмечается положительная реакция на миелопероксидазу и липиды (рис. 4.4., 4.5.), реакция на гликоген отрицательная.
-Недифференцируемый ОЛЛ представляет собой гетерогенную группу ОЛ. При данном варианте бластные клетки не дают положительных цитохимических реакций, харктерных для лимфоидных ли миелоидных острых лейкозов.
73

Рис. 4.3. Отрицательная реакция бластных клеток на миелопероксидазу.
Рис. 4.4. Положительная реакция бластных клеток на миелопероксидазу.
Рис. 4.5. Положительная реакция бластных клеток на эстеразу.
IV. Иммунофенотипирование. На поверхности и в цитоплазме гемопоэтических клеток определено более 150 специфических белков-антигенов, сгруппированных в так называемые кластеры дифференцировки, к которым созданы моноклональные антитела, что дало возможность с достаточной точностью выявлять их на поверхности или внутри клеток. Следовательно, иммунологическая диагностика гемобластозов заключается в подробном изучении антигенов мембраны и цитоплазмы злокачественных клеток. При этом проводится сопоставление иммунофенотипа (т.е. набора маркеров) клеток гемопоэтической опухоли с иммунофенотипом клеток нормальной кроветворной ткани.
К задачам иммунофенотипирования можно отнести:
1)подтверждение диагноза;
2)установление варианта острого лейкоза в том случае, когда цитохимический метод неинформативен;
3)выделение прогностических групп.
Бластные клетки считаются позитивными по экспрессии того или иного антигена, если 20% и более из них экспрессируют его.
V. Цитогенетический анализ – исследование хромосомного аппарата. Данные этого исследования позволяют уточнить вариант заболевания, проводить динамическое наблюдение за больным в период ремиссии или рецидива, оценивать прогноз. Как указано в
74
практических рекомендациях Комитета по острым лейкозам США «цитогенетическое исследование обязательно следует проводить у всех первичных больных острыми лейкозами».
Практически у 90% больных находят генетические поломки, характеризующиеся различными дефектами хромосом (транслокации, делеции, инверсии и т.д.). Например, инверсия 16 хромосомы часто определяется у больных миеломонобластным лейкозом с высокой эозинофилией костного мозга, транслокация (15;17) – типичный маркер острого промиелоцитарного лейкоза, транслокация (8;21) отмечается у 40% больных с М2-вариантом ОМЛ. Три описанные транслокации характеризуют группу благопрятного прогноза при ОМЛ, причем для ОМЛ с этими транслокациями созданы программы дифференцированного лечения, которые позволяют более чем 70% больным, у которых достигнута полная ремиссия, длительное время прожить без признаков рецидива.
Клоны клеток с анеуплоидным числом хромосом исчезают во время ремиссии и вновь появляются при рецидиве. Иногда в период обострения присоединяются дополнительные нарушения кариотипа.
Прогностически крайне неблагоприятным является наличие t (9;22), т.е. обнаружение филадельфийской хромосомы при остром лимфобластном лейкозе. Клинически иногда трудно установить, идет ли речь о хроническом миелолейкозе, дебютировавшем с лимфоидного варианта бластного криза, или об ОЛЛ. Однако, если удается добиться ремиссии, диагностические трудности исчезают, так как при ХМЛ филадельфийская хромосома продолжает определяться практически во всех клетках костного мозга в любой фазе болезни, включая ремиссию бластного криза, в то время как при ОЛЛ костный мозг даже до начала лечения, обычно содержит какое-то количество клеток без этой хромосомы, а наступление ремиссии сопровождается уменьшением или полным исчезновением клона этих клеток.
VI. Молекулярная диагностика – определение молекулярных маркеров (например, белки, синтезируемые в результате транслокаций), которые характеризуют лейкемические клетки.
VII. Спинномозговая пункция – в случае нейролейкемии бластный цитоз более 10 в 1
мкл
Диагноз. Критерием диагноза является наличие в миелограмме более 20% бластных клеток.
Дифференциальный диагноз. Подтверждение диагноза не вызывает трудностей, поскольку, если в костном мозге обнаруживается более 20% бластов – диагноз очевиден. В случае наличие менее 20% бластов проводят весь спектр вышеперечисленных иследований для установления диагноза.Дифференцируют острые лейкозы с хроническими, различными анемиями (наиболее часто апластической), инфекционными заболеваниями, геморрагическими диатезами.
Особенности некоторых видов лейкоза.
Острый лимфобластный лейкоз Среди клинических проявлений острого лимфобластного лейкоза имеет место
лимфоаденопатия, поражение железистой ткани, часто еразвитие нейролейкемии. Острый промиелоцитарный лейкоз
Встречается в 10% случаев миелоидных лейкозов. Для него характерна особая морфология бластных клеток, содержащих обильную крупную зернистость, тяжелый геморрагический синдром и быстрота течения. Название промиелоцитарный лейкоз получил из-за внешнего сходства опухолевых клеток с промиелоцитами. Именно с промиелоцитарным лейкозом связано одно из самых принципиальных и значительных
75
открытий в области биологии лейкозов в последние 10 лет: обнаружение эффекта дифференцировки бластных клеток промиелоцитарного лейкоза под воздействием дериватов ретиноевой кислоты – 13-цис-ретиноевой, полностью трансретиноевой (ATRA), 9-цис ретиноевой кислот. Было доказано, что без химиотерапии, только при использовании ATRA достигается полная ремиссия, быстро купируются геморрагический и ДВС-синдром.
Острый монобластный лейкоз характеризуется опухолевой инфильтрацией кожи (нейролейкемиды), слизистых полости рта и глотки, их некротическими изменениями.
Острый эритромиелоз
Ванамнезе больных этих лейкозом нередко лучевая или химиотерапия: эта форма острого лейкоза чаще других описывается в качестве вторичного у лиц, больных лимфогранулематозом, миеломной болезнью, эритремией. В отличие от предыдущих форм острого лейкоза, где диагностика основывается на обнаружении в пунктате костного мозга атипических бластных клеток, при остром эритромиелозе пунктат часто сам по себе становится загадкой. Для этого заболевания характерно резкое увеличение содержания клеток красного ряда в костном мозге. Такая картина встречается при гемолитических и В- 12-дефицитной анемии, при неэффективном эритропоэзе любой природы (т.е. гемолизе эритрокариоцитов). В отличие от других форм острого лейкоза, при остром эритромиелозе дифференцировка опухолевых клеток красного ряда происходит нередко до стадии полихроматофильных и оксифильных эритрокариоцитов или до эритроцитов. Однако наряду
склетками красного ряда, иногда атипичными, многоядерными, в костном мозге, а позже и в крови появляются бластные элементы. Если наблюдается выраженное угнетение нормальных ростков кроветворения, а в костном мозге – обилие уродливых эритрокариоцитов и много атипичных недифференцированных бластных клеток или миелобластов, то диагноз острого эритромиелоза становится очевидным. Исследование хромосомного аппарата клеток костного мозга может оказать существенную помощь в диагностике эритромиелоза: при обнаружении в клетках красного ряда анеуплоидного клона. Цитиохимической особенностью эритромиелоза служит PAS-положительная субстанция в цитоплазме ядросодержащих клеток красного ряда, в частности эритрокариоцитов, хотя этот признак неспецифичен для лейкозного процесса.
Острый мегакариобластный лейкоз
Вкрови и костном мозге при этой форме часто встречаются уродливые мегакариоциты, осколки ядер мегакариоцитов и скопления тромбоцитов. Уровень тромбоцитов, как правило, превышает нормальный. Клиническая картина этого лейкоза большей частью лишена специфических особенностей, однако в ряде случаев острый мегакариобластный лейкоз может иметь клиникно-гематологическую картину острого малопроцентного лейкоза, а по гистологии костного мозга – картину миелофиброза.
Острый плазмобластный лейкоз Представляет собой редкое заболевание и чаще всего диагностируется в качестве
последнего этапа опухолевой прогрессии у больных множественной миеломой. В костном мозге определяется большое количество плазмобластов и уродливых плазматических клеток.
Лечение. Никогда не следует начинать лечения до окончательного установления диагноза, в т.ч. его морфологического подтипа. Основными целями лечения ОЛ являются эрадикация лейкемического клона, восстановление нормального кроветворения и в результате этого достижение длительной безрецидивной выживаемости больных. Это достигается за счет использования миелотоксических противоопухолевых препаратов, которые быстро уменьшают объем опухолевой массы, вызывая глубокую аплазию костного мозга. Именно в период аплазии возникает так называемое состояние клональной конкуренции, когда пролиферативное преимущество получают клетки нормального кроветворного клона,
76
которые и репопулируют костный мозг, восстанавливая здоровое поликлональное кроветворение.
Основополагающими принципами химиотерапии злокачественных опухолей человека, в т.ч. и острых лейкозов являются:
1)принцип дозы-интенсивности, т.е. необходимости использования адекватных доз цитостатических препаратов в сочетании с четким соблюдением временных межкурсовых интервалов;
Как в эксперименте, так и в клинической практике было доказано, что снижение дозы препаратов на 20% в программах химиотерапии ведет к уменьшению эффективности лечения на 50%. Известно также, что увеличение дозы в 2 раза при лечении опухолей с высокой фракцией роста сопровождается 10-кратным увеличением количества погибающих опухолевых клеток. Использование сочетаний цитостатических препаратов еще более повышает процент гибели опухолевых клеток. В связи с этим в настоящее время принцип дозы-интенсивности дополнен таким понятием, как «суммация интенсивности дозы», что отражает влияние множества эффективных и дозоадекватных воздействий на исход терапии злокачественных опухолей.
2)принцип использования комбинаций цитостатических средств с целью получения наибольшего эффекта и уменьшения вероятности развития лекарственной резистентности;
Современная химиотерапия острых лейкозов создавалась эмпирическим путем, по мере появления новых цитостатических препаратов и исследования эффективности их сочетаний, а также основываясь на законах, разработанных на экспериментальных моделях.
-Во-первых, мышиная модель лейкоза, позволила найти закономерность
между временными интервалами, способом введения цитостатических препаратов и появлением клонов лейкемических клеток, устойчивых к воздействиям данных препаратов. Иными словами, было доказано, что вероятность появления резистентности опухолевых клеток повышается при длительном применении лекарственных средств в низких концентрациях и может быть снижена, если повторно использовать импульсные более высокодозные программы.
- Во-вторых, появление устойчивости к химиотерапевтическим воздействиям напрямую связано с объемом опухолевой массы. Следовательно, инициальное химиотерапевтическое воздействие должно быть достаточно мощным, чтобы максимально уменьшить объем опухолевой массы, и заключаться в применении различных по механизму действия лекарственных препаратов с целью влияния на различные по чувствительности лейкемические клетки.
3)принцип этапности терапии; При всех ОЛ существует несколько этапов терапии:
-индукция ремиссии – период начального лечения, целями которого являются максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремисии.
-консолидация ремиссии – закрепление достигнутого противоопухолевого эффекта. В настоящее время в большинстве случаев консолидация является наиболее агрессивным и высокодозным этапом при лечении ОЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
-поддерживающая терапия
-использование полноценной вспомогательной терапии, а именно профилактику осложнений и их лечение.
К основным профилактическим мерам относят:
a)обеспечение сосудистого доступа;
b)профилактику инфекционных осложнений
77
Лечение осложнений, возникающих в период миелотоксической депрессии кроветворения, требует гораздо больше затрат, нежели их профилактика. К наиболее опасным осложнениям у 80-90% пациентов относятся различной тяжести инфекции. Главный принцип лечения всех инфекций – эмпирическая поэтапная антибиотикотерапия с обязательным предварительным бактериологическим исследованием для дальнейшего изменения спектра используемых антибиотиков в соответствии с результатами посева.
В качестве вспомогательных средств в начале 90-х годов в исследовательские программы химиотерапии острых лейкозов стали включать ростовые гемопоэтические факторы. Доказано, что применение этих факторов никоим образом не влияет на пролиферацию лейкемических клеток (показатели безрецидивной выживаемости и продолжительности полной ремиссии не ухудшаются). Кроме того, они существенно сокращают период миелотоксического агранулоцитоза, что в свою очередь приводит к уменьшению числа инфекционных осложнений, а также количества дней применения антибиотиков и противогрибковых средств. Помимо этого ростовые гемопоэтические факторы применяют в качестве прайминга – усиления чувствительности лейкемических клеток к последующему цитостатическому воздействию.
c)профилактику геморрагических осложнений с помощью заместительной трансфузии тромбоцитов (при нормальной температуре тела их уровень в периферической крови должен быть не менее 20 тыс., при ее повышении – 30 тыс.
Геморрагический синдром представлял угрозу лишь на первых этапах химиотерапии ОЛ. С появлением заместительной терапии тромбоцитами он занимает скромное место (1015%) в перечне наиболее тяжелых осложнений.
d)профилактика или лечение нейролейкемии.
Этот этап охватывает все периоды программного лечения – индукцию ремиссии, консолидацию и поддерживающее лечение. В период индукции выполняют контрольнодиагностическую пункцию с введением одного или двух препаратов, а затем профилактически вводят интратекально три цитостатических препарата 1-2 раза в неделю. При лечении нейролейкемии цитостатические препарата вводят до достижения нормализации показателей ликвора и получения минимум трех нормальных люмбальных пункций. Обязательным этапом лечения является облучение головы, которое выполняется в дозе 2400 рад уже после достижения нормальных показателе ликвора.
e)профилактику синдрома массивного лизиса опухоли – водная нагрузка, форсированный диурез, аллопуринол;
f)профилактику флебита, если не используется центральный катетер;
g)профилактику тошноты и рвоты;
h)профилактику анемического синдрома – заместительные трансфузии Эр массы (следует иметь ввиду, что в отсутствие признаков гипоксии – одышки при нагрузке, выраженной тахикардии, головной боли, головокружения, обморочных состояний, при уровне гемоглобина 75-80 г/л не требуется трансфузия эритроцитов).
i)профилактику электролитных нарушений
Трансплантация костного мозга. Противоречивой и до сих пор нерешенной остается проблема использования трансплантации костного мозга у больных острым лимфобластным лейкозом. Трансплантация аллогенного костного мозга может быть однозначна рекомендована больным ОЛЛ при второй и более поздней ремиссии, а также при первой ремиссии из группы с плохим прогнозом. Аутологичная трансплантация может рассматриваться в качестве целесообразного терапевтического подхода лишь при второй и более поздней ремиссии. Больным ОМЛ из группы стандартного риска может быть рекомендовано проведение аллогенной трансплантации. Однозначных рекомендаций по выполнению аутологичной трансплантации у больных ОМЛ в первой ремиссии быть не может. Только при условии минимальной летальности (не более 8-10%) вследствие самой
78
трансплантации аутологичная трансплантация костного мозга может быть включена в программы лечения ОМЛ. Для группы ОМЛ с неблагоприятным прогнозом выполнение трансплантации не улучшает результаты лечения. Данную процедуру следует выполнять в специализированных центарх, в которых выполняется не менее 10 аллогенных и 10 аутологичных ТКМ в год. Это условие представляется важным, иначе леталльность при осложнениях самой процедуры будет слишком высока, что скажется на общей выживаемости больных.
Лечение должно приводить к развитию полной клинико-гематологической ремиссии:
-отсутствие клинических проявлений
-отсутствие бластов в периферической крови
-в пунктате костного мозга менее 5% бластов
-отсутствие внекостномозговых пролифератов Неполная клинико-гематологическая ремиссия - это
-отсутствие клинических проявлений
-отсутствие бластов в периферической крови
-в пунктате костного мозга менее 30% бластов
-отсутствие внекостномозговых пролифератов
Если у больного после двух курсов индукционной терапии ремиссия не достигнута, то констатируется резистентная форма ОЛ. Различают резистентность первичную и вторичную. Первичная – это отсутствие ремиссии после первичного адекватного цитостатического воздействия или ранний рецидив в течение 6 месяцев с момента достижения первой ремиссии.
Рецидив острого лейкоза - это:
-костномозговой – появление более 5% бластов
-местный – внекостномозговая пролиферация любой локализации
В зависимости от механизма развития различают резистентность лекарственную – обусловленную измененим метаболизма цитостатиков, цитокинетическую – обусловленную пролиферативными характеристиками лейкемических клеток: временем их деления или продолжительностью клеточного цикла, и фармакокинетическую – естественные барьеры (гематоэнцефалический), куда не проникают цитостатикки, резистентность.
При помощи цитогенетического метода можно отслеживать в динамике судьбу лейкемического клона. В связи с этим появились понятия минимальная остаточная, или резидуальная, болезнь, «клональная ремиссия» и «молекулярная ремиссия».
Минимальной остаточной болезнью принято называть остаточную популяцию лейкемических клеток, которая может быть выявлена лишь с помощью новых высокочувствительных методов (молекулярная диагностика, цитогенетика и др.) при условии, что при световой микроскопии в костном мозге у пациента определяется не более 5% бластных клеток при нормальных показателях периферической крови и отсутствуют экстрамедуллярные очаги. По данным современных исследований в большинстве случаев, когда в период ремиссии острого лейкоза удается обнаружить в костном мозге минимальную популяцию лейкемических клеток – минимальную резидуальную болезнь, наступает рецидив болезни.
Рецидив острого лейкоза принципиально отличается от дебюта заболевания и должен рассматриваться как появление и пролиферация нового, чаще всего устойчивого к проводимой терапии клона лейкемических клеток, т.е. вследствие опухолевой прогрессии развивается вторичная резистентность. Если констатирован изолированный внекостномозговой рецидив, то кроме локальной терапии (лечение нейролейкемии, облучние яичка и т.д.), обязательно проведение системной индукционной терапии.
Прогностические факторы.
79
