
796
.pdfже кислоты (электрофилы) и основания (нуклеофилы) по своей жесткости друг к другу, тем выше скорость образования и прочность аддуктов. Это можно показать на примере изменения скорости реакций галогенид-ионов (фторид-ион – жесткий нуклеофил и иодид-ион – мягкий нуклеофил):
а) с жесткими электрофилами (Mg+2 и Al+3) F − > Cl − > Br − > I −; б) с мягкими электрофилами (Hg+2) F − < Cl − < Br − < I −.
Использование методов квантовой химии дало возможность охарактеризовать понятия абсолютной «жесткости», «мягкости», а также «электроотрицательности» кислот и оснований Льюиса количественно.
Квантовая химия позволяет получить в рамках различных приближений набор энергетических уровней и соответствующих им состояний (орбиталей), которые разрешены для размещения на них электронов, осуществляющих химические связи в молекуле (валентные электроны). Так как каждое состояние может быть занято не более чем двумя электронами, то часть орбиталей, соответствующих более низким энергиям оказывается занятой, а состояния с более высокими энергиями – свободными, то есть не занятыми электронами. Состояние или орбиталь, соответствующая самому высокому по энергии занятому уровню, называется высшей занятой молекулярной орбиталью (ВЗМО), а отвечающая ему энергия – ЕВЗМО. Незанятое состояние, имеющее самую низкую энергию, называется низшей свободной молекулярной орбиталью и ему соответствует энергия ЕНСМО.
Эти две орбитали объединяются общим названием граничные орбитали, а соответствующие им энергии – граничные энергии.
Для количественного описания взаимодействия между кислотой и основанием Льюиса вводятся понятия абсолютной жесткости и абсолютной электроотрицательности молекул. Смысл этих понятий пояснен на рис. 2.2.
Абсолютная жесткость (G) – это величина энергетической щели между граничными МО молекул:
G = [EНСМО − E ВЗМО ]
Абсолютная электроотрицательность молекулы ( ) характеризуется положением средней точки между уровнями НСМО и ВЗМО:
=−½ [E ВЗМО − E НСМО ]
Чем больше величина G, тем молекула «жестче». Чем больше величина , тем молекула более электроотрицательна. Молекула С мягче молекул А и В. Молекулы А и В имеют одинаковую жесткость, но электроотрицательность у молекулы А больше, чем у молекулы В.
81

|
GB |
НСМО |
C |
B |
|
|
A |
|
GC |
GA B
C
ВЗМО 

A
Рис. 2.2.
Абсолютная жесткость и абсолютная электроотрицательность молекул.
При взаимодействии кислоты А с основанием В происходит образование донорно-акцепторного комплекса АВ. Можно полагать, что прочность комплекса АВ, т.е. сила кислотно-основного взаимодействия, будет определяться степенью переноса заряда от В к А. Степень переноса заряда ( N) имеет размерность долей электрона и связана с абсолютной жесткостью и абсолютной электроотрицательностью следующим соотношением:
N = ( A− B ) (G A + G B)
Это соотношение показывает, что величина N будет тем больше, чем больше разность электроотрицательностей между молекулами кислоты и основания, и тем меньше, чем больше жесткость взаимодействующих молекул кислоты и основания.
Жесткость кислот и оснований определяет направление реакции. Так, при взаимодействии 1-хлорпропана с жесткими нуклеофилами (СН3О−) происходит отщепление (Е2), а с мягкими нуклеофилами (C6H5S−) – замещение (SN 2)
+

 H э.ц.ж.
H э.ц.ж.
+
H3C CH CH2
э.ц.м.
+

 H э.ц.ж.
H э.ц.ж.
+
H3C CH CH2
э.ц.м.
Cl + H CONa |
H C |
|
CH |
|
CH |
+ CH OH + NaCl |
||||||||||
|
|
|||||||||||||||
3 .. |
3 |
|
|
2 |
|
3 |
|
|
|
|
||||||
|
н.ц.ж. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl + CH CH SH |
H C |
|
CH |
|
CH |
|
S |
|
CH |
|
CH + HCl |
||||
|
|
|
|
|
|
|||||||||||
3 2 .. |
3 |
2 |
2 |
2 |
3 |
|||||||||||
н.ц.м.
82

Аналогичная ситуация наблюдается и в реакциях 2-бромпропана с жесткими (О−Н) и мягкими ((С2Н5ОСО)2С−Н) нуклеофилами:
H3C CH CH3
Br
H3C CH CH3
Br
+ NaOH |
спирт |
H C |
|
CH |
|
CH |
+ NaBr + H O |
||||
|
|
|
|||||||||
|
|
|
|||||||||
.. |
|
3 |
2 |
2 |
|||||||
н.ц.ж. |
|
|
|
|
|
|
|
|
|
|
|
+ C−H(СООC2H5)2 |
|
|
H3C |
|
|
CH |
|
CH3 + Br− |
|||
|
|
|
|
||||||||
.. |
|
|
|
|
|
|
|
|
|
|
|
н.ц.м. |
|
|
|
|
|
|
|
CH(COOC2H5)2 |
|||
Реакция алкенов (например, пропен) с галогенами может протекать в 2-х направлениях: более жесткий электрофил – молекулярный хлор – присоединяется по двойной связи, а более мягкий электрофил – атомарный хлор – замещает водород sp3-гибридного углерода:
|
|
|
|
− |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
H C |
|
CH |
|
CH + Cl Cl |
|
|
H C |
|
CH |
|
|
CH |
|||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|||||||||||||
3 |
|
.. 2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2 |
|||
|
|
н.ц. более э.ц. более |
|
|
|
|
Cl |
|
|
Cl |
|||||||||
|
|
жесткий |
жесткий |
|
|
|
|
|
|
|
|
|
|
|
|
||||
− |
|
|
|
+ Cl |
> 400 |
0 |
C |
|
|
|
|
|
|
|
|
|
|||
H C |
|
CH |
|
CH |
|
ClCH CH |
|
|
CH HCl |
||||||||||
|
|
|
2Cl. |
|
|
||||||||||||||
3.. |
|
2 |
|
2(Cl:Cl |
) |
2 |
|
|
|
2 |
|||||||||
н.ц. более |
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
||||
мягкий |
э.ц. более |
|
мягкий |
||
|
В тех случаях, когда в химических реакциях участвуют амбидентные нуклеофилы или электрофилы, наблюдается явление региоселективности. Оно является результатом конкуренции реакционных центров в реакциях с реагентами в соответствии с принципом ЖМКО. Явление, при котором атака частицы реагентом может протекать по двум или более атомам (центрам), называют амбидентностью. Известны различные виды конкуренции реакционных центров:
а) S, N-конкуренцию можно показать на примере реакции роданидиона с жесткими (галогенангидридами) и мягкими (йодистый метил) электрофилами:
CH3 S C N
N
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
CH3I |
|
|
|
|
|
|
|
− |
R |
|
|
C |
||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
C |
|
N |
э.ц.ж.Cl |
||||||
э.ц.м. |
|
|
|
|
||||||||||
|
|
|
|
|||||||||||
|
|
.. |
|
|
.. |
|
|
|
|
|
|
|
||
|
|
н.ц.мягче |
н.ц.жестче |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S C N C R + Cl−
O
83
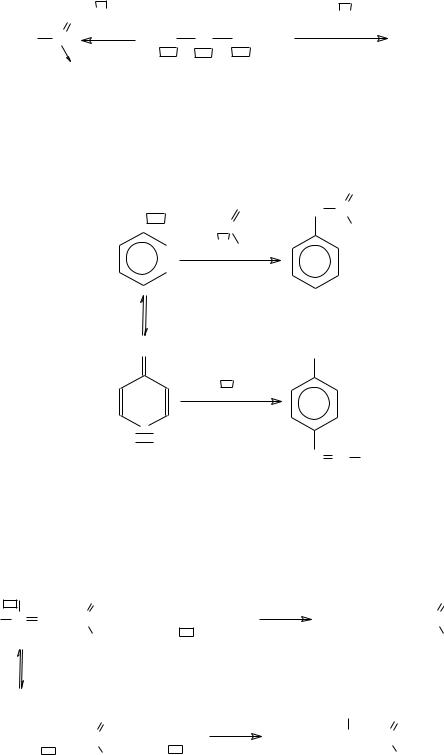
б) O, N-конкуренция нуклеофильных центров проявляется в реакциях нитрит-иона с промежуточными (третбутилхлорид) и мягкими (метилйодид) электрофилами:
O CH3 N
O
|
CH3I |
|
|
|
|
|
|
|
|
|
− |
(CH ) CCl |
|
|
|
|
|
|
|
|||
|
|
|
|
н.ц. |
|
|
|
н.ц. |
3 3 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
э.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
э.ц. |
|
|
|
|
|
|
|
|||||||||
|
жестче |
жестче |
|
|
|
|
|
|
|
|
|
|||||||||||
мягче |
|
|
жестче |
|
|
|
|
|
|
|
||||||||||||
|
O |
|
... |
N |
|
... |
O |
|
(CH3)3C |
|
O |
|
N |
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
.. .. .. |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
мягче |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в) О, С-конкуренция нуклеофильных центров выявлена в реакциях фенолят-иона с жесткими (галогенангидриды) и мягкими (диазосоединения) электрофилами:
н.ц.ж. |
|
|
|
|
|
|
|
− |
|
|
|
|
|
O .. |
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
R |
|
|
C |
|
|
|
|
|
|||
|
|
|
|
|
||
|
|
э.ц.ж.Cl |
||||
|
|
|||||
|
|
|
|
|
|
|
O
[C6H5N N]+
N]+
э.ц.м.
−
 ..
.. 
н.ц.м.
O O C
R
+ Cl−
OH
N N C6H5
О, С-конкуренция также наблюдается в реакциях енолят-иона с жесткими (метилтозилат) и мягкими (метил йодистый):
н.ц.ж.
..O− H3C C
|
|
O |
+ H C |
|
|
|
|
|
|
|
|
OCH3 O |
+ Ts |
|
O− |
||||
|
|
|
|
|
|
|
|
|
|
||||||||||
CH |
|
C |
|
O |
|
Ts |
H C |
|
C |
|
CH |
|
C |
|
|||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
3 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
OC2H5 |
э.ц.ж. |
|
|
|
|
|
|
|
|
OC2H5 |
|||||||
|
|
O |
|
O |
|
|
|
|
O |
CH3 O |
|
||||||||||
|
|
|
|
|
|
C−H |
|
|
|
|
|
|
|
|
|
+ I− |
|||||
H C |
|
C |
|
|
C |
+ CH I |
H3C |
|
C |
|
CH |
|
C |
||||||||
|
|
|
|
|
|
||||||||||||||||
3 |
.. |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
OC2H5 |
э.ц.м. |
|
|
|
|
|
|
|
|
|
OC2H5 |
||||||||
|
|
|
|
|
н.ц.м. |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
84

г) С, N-конкуренция нуклеофильных центров замечена в реакциях алкилгалогенидов с солями цианисто-водородной кислоты:
|
|
|
KCN |
|
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
мягче |
R |
|
|
C |
|
|
N + KX |
||
R |
|
X |
AgCN |
|
|
|
|
|||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
.. |
|
|
|
|
|
|
|
|
|
э.ц. |
н.ц. |
|
|
|
|
|
|
|
|
|
||
жестче |
|
|
|
|
|
|
|
|
|
|||
|
|
|
R |
|
|
N |
|
|
C + AgX |
|||
|
|
|
|
|
|
|
||||||
В первом случае жесткая кислота (К+) блокирует более жесткий нуклеофильный центр (N−), и вакантным остается углерод (образование R – C- связи); а во втором случае мягкая кислота (Ag+) блокирует более мягкий нуклеофильный центр (С−), и вакантным остается азот (образование R – N- связи);
д) С, С-конкуренция нуклеофильных центров наблюдается в реакциях нитрования гомологов бензола (sp3-гибридные углеродные атомы боковой цепи мягче, чем sp2-гибридные углеродные атомы кольца):
|
|
|
CH |
|
|
|
|
|
CH2NO2 |
||||||||||
|
|
|
|
3 |
|
|
|
|
1000 C |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
+ HO |
|
NO2 |
|
|
|
|
|
|
+ H2O |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
[NO2 |
] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
э.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мягче |
|
|
|
|
|
|
|||
CH |
|
|
|
|
|
|
|
|
|
CH3 |
|||||||||
|
|
3 |
|
|
|
|
|
H2SO4 конц. |
O2N |
|
|
|
|
|
NO2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 3 H2O |
||
|
|
|
+ 3HO NO2 |
[NO+] |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
э.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
жестче |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
е) Н, S-конкуренция электрофильных центров может быть показана на примере реакций анилина с серной кислотой. Серная кислота (H2SO4) характеризуется наличием двух электрофильных центров – Н+ (жесткий) и S + (менее жесткий):
н.ц. жестче
..NH2
+ H2SO4
..
н.ц. мягче
10 %
водный
раствор
H+
э.ц.ж.
конц.
+
H2SO4
э.ц. менее жесткий
85
NH3
HSO4
NH2
+ H2O
SO3H
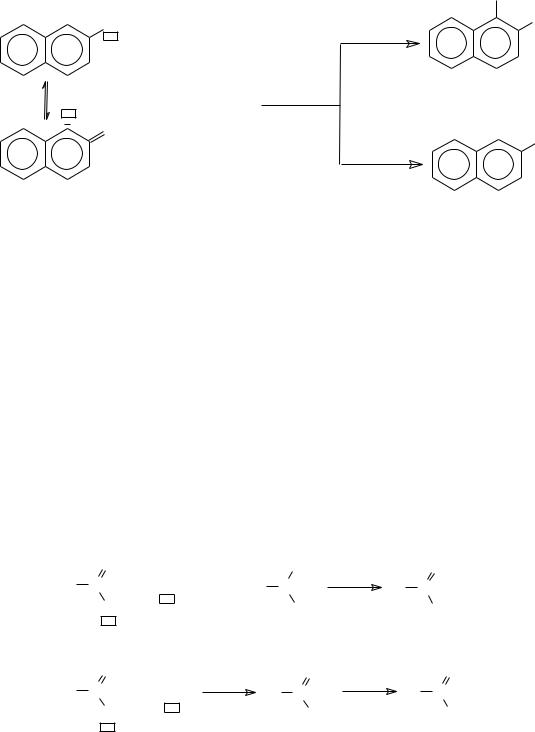
Процесс сольватации объясняется принципом ЖМКО. Протонные растворители (спирты, вода и др.) являются жесткими, а диполярные апротонные (диметилформамид, ацетонитрил, ацетон и др.) растворители в большинстве случаев – мягкими. Растворители, сольватируя либо мягкий, либо жесткий реакционный центр, могут изменять направление реакции:
O− |
|
.. |
− |
н.ц.ж. |
+ C6H5СH2Br |
|
н.ц.м.
..
O
+ C6H5СH2Br−
|
CH2C6H5 |
|
OH |
CF3CH2OH |
− |
жесткий |
+ Br |
|
(CH3)2NCHO |
OCH2C6H5 |
||
+ |
Br− |
||
мягкий |
|||
|
|
||
В первом случае жесткий растворитель (CF3CH2OH) блокирует жесткий нуклеофильный центр кислорода (О−), и реакция протекает по карбанионному центру. Во втором случае мягкий растворитель (диметилформамид) блокирует мягкий нуклеофильный центр углерода (С−), и реакция протекает по жесткому нуклеофильному центру кислорода.
В реакциях, протекающих у насыщенного углеродного атома по SN2- механизму, нуклеофильность галогенид-ионов в жестких (протонных) растворителях, например, спирты и др. возрастает в ряду: F−<Cl−<Br−<I−, а в мягких (апротонных) растворителях, например, диметилформамид, наоборот, в этом же ряду падает: F−>Cl−>Br−>I−.
Связь каталитических процессов с принципом ЖМКО также очевидна. К примеру, реакция гидролиза сложных эфиров катализируется жесткой кислотой (ион водорода), а мягкая кислота (ион серебра) не оказывает каталитического воздействия на эту реакцию. Однако ион серебра катализирует процесс тиоловых эфиров:
O R C
OR'
..
н.ц.ж.
O R C
SR'
..
н.ц.м.
+H+ 
э.ц.ж.
+Ag+
э.ц.м.
O
R C HOH
HOH
OR'
..
H
O
HOH
R C
SR'
..
Ag
O
R C + R'OH OH
O
R C + R'SH OH
86

2.6. Классификация органических реакций по реакционным центрам субстрата (атакуемая молекула)
Реакционные центры – это акцепторные и донорные атомы субстрата, которые атакуются соответствующими донорными и акцепторными атомами реагентов. Реакционные центры образуются в результате смещения электронной плотностью от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью:
+ |
− |
|
− |
+ |
||
C |
|
Z , |
|
C |
|
Z |
|
|
|
||||
|
|
.. |
.. |
|
||
э.ц. |
н.ц. |
|
н.ц. |
э.ц. |
||
Атом с большей электроотрицательностью при этом приобретает отрицательный заряд, становится нуклеофильным центром и атакуется электрофильным реагентом, то есть частицей с полным или частичным положительным зарядом.
Атом с меньшей электроотрицательностью заряжается положительным зарядом, является электрофильным центром и атакуется нуклеофильным реагентом, то есть частицей с полным или частичным отрицательным зарядом.
Реакционные центры позволяют сгруппировать многочисленные реакции в реакционные серии, а это, в свою очередь, позволяет глубже понимать сущность процесса. Как правило, количество реакционных серий определяется числом реакционных центров. Во многих органических соединениях атомы углерода имеют промежуточную степень окисления и потому они имеют двойственную природу – могут быть электрофилами и нуклеофилами. Так, например, функциональная группа альдегидов харак-
теризуется наличием четырех реакционных центров:
−
+ O..
э.ц−.C н.ц.
.. +
н.ц. H
э.ц.
Этим четырем реакционным центрам соответствуют четыре реакционные серии.
1.Нуклеофильные свойства кислорода O−− реакции с электрофильными реагентами.
2.Электрофильные свойства водорода Н + − реакции с нуклеофильными реагентами (реакции гидридного перехода).
3.Электрофильные свойства углерода С + − реакции с нуклеофильными реагентами.
87
4. Нуклеофильные свойства углерода С− − реакции с электрофильными реагентами.
Концепция электрофильности и нуклеофильности принципа ЖМКО и классификация органических реакций по реакционным центрам дают
возможность реализовать системно-структурный метод изучения классов органических соединений.
Описание классов органических соединений приведено по единой схеме. Даны определение класса, классификация, нахождение в природе, методы получения, изомерия и номенклатура, физические и химические свойства, практическое применение.
Химические свойства класса органических соединений описаны в следующем порядке:
−анализ функциональной группы данного класса с указанием реакционных центров на основе электроотрицательности атомов;
−общая характеристика реакционной способности – наиболее выраженная нуклеофильная или электрофильная активность (главное химическое свойство, которое определяет химическую натуру данного класса органических соединений), отличительные (особые) реакции, конкуренция реакционных центров и т.д.;
−при описании химических свойств субстрата реагенты располагаются следующим образом: в начале указываются водородные, кислород-
ные реагенты, а затем − остальные реагенты в алфавитном порядке;
−все металлические реагенты объединены в одну рубрику.
Вследующей главе «Важнейшие классы органических соединений» рассмотрены свойства, связанные, главным образом, с функциональной группой, но в некоторых случаях, когда химические реакции имеют большое научное и практическое значение, приводятся свойства, связанные с углеводородным радикалом.
88

ГЛАВА 3. ВАЖНЕЙШИЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
3.1. Алканы (предельные, насыщенные, парафиновые углеводороды)
Алканы – класс алифатических углеводородов, основным признаком которых является наличие в молекуле только одинарной связи:
(функциональная группа |
|
C |
|
C |
|
). |
|||||||||||||
|
|
|
|||||||||||||||||
Алканы образуют гомологический ряд с общей |
формулой CnH2n+2: |
||||||||||||||||||
CH4 |
− метан ; |
|
|
|
|
|
|||||||||||||
CH3 |
|
|
|
|
CH3 − этан ; |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
CH3 |
|
|
|
|
CH2 |
|
|
CH3 − пропан ; |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
CH3 |
|
|
|
|
CH2 |
|
|
CH2 |
|
CH3 − бутан и т.д. |
|||||||||
|
|
|
|
|
|
|
|||||||||||||
Классификация. Различают два типа предельных углеводородов.
1. Алканы нормального строения (без разветвлений и боковых це-
пей), например, бутан: |
CH3 |
|
CH2 |
|
|
CH2 |
|
CH3 |
|||
|
|
|
|
|
|||||||
2. Алканы изостроения (с |
|
разветвлением и боковыми цепями), |
|||||||||
например, изобутан: |
СH3 |
|
CH |
|
|
CH3 |
|||||
|
|
|
|
||||||||
|
|
|
|
||||||||
CH3
В них выделяют главную (самую длинную) углеродную цепь и побочную цепь.
В алканах различают следующие углеродные атомы:
а) первичный, если он соединен с одним соседним углеродным ато-
мом;
б) вторичный, если он соединен с двумя соседними углеродными атомами;
в) третичный, если он соединен с тремя соседними углеродными атомами;
г) четвертичный, если он соединен с четырьмя соседними углеродными атомами. При этом первичному, вторичному и третичному углеродным атомам соответствуют углеводородные группы: метил, метилен и
метин, например: метин
метил
СH3 CH CH2 CH3
CH3 метилен
89

Нахождение в природе. Алканы входят в состав следующих ископаемых.
1.Природные газы (метан 90 – 98%).
2.Попутные нефтяные газы (этан, пропан, бутан).
3.Нефть (сибирская – 71%, северокавказская – 66%, татарская –
61%).
4. Озокерит CnH2n+2 с n = 20÷30.
5. Газ-гидраты – соединения включения, образованные кристаллами льда и алканов, например:
CH4 . 7H2O, C2H6 .8 H2O, C3H8 . 18H2O
В живой природе алканы встречаются крайне редко и в малых количествах. Например, керосиновая фракция содержится в растительных соках некоторых южноамериканских трав; известны случаи, когда парафиновые углеводороды входят в состав восковых оболочек семян, листьев, плодов. Метан содержится в атмосфере Юпитера, Сатурна, Нептуна, Урана, Плутония.
Методы получения
1.Фракционная перегонка нефти и нефтяных газов.
2.Гидрирование каменного угля:
nC |
|
|
Fe |
|
С |
|
H |
|
+ |
|
|
|
n |
2 n + 2 |
|||
+ (n 1)H2 |
450 |
- 500 |
0 |
С |
|
|||
|
|
|
|
|
|
3. Синтез на основе CO и Н2:
nCO + ( 2n +1) H |
Fe + CO |
С n H2 n + 2 |
+ |
nH O |
|
0 |
|
||||
2 |
С |
|
2 |
||
|
200 |
|
|
|
|
4. Биотехнологический метод (например, получение метана из отходов сельского хозяйства с помощью дрожжей).
5.Лабораторные методы:
а реакция Вюрца:
2CH3Cl + 2Na  CH3CH3 + 2 NaCl
CH3CH3 + 2 NaCl
б) гидрирование непредельных углеводородов:
Pt
R CH CH2 + H2 1500 C RCH2CH3
Изомерия. Для алканов характерны следующие типы изомерии: 1. Структурная изомерия углеводородного скелета:
90
