
796
.pdf
|
OCH3 |
|
|
|
|
OCH3 |
|||
P |
|
OCH |
+ CH CH Br |
CH3CH2 |
|
P |
|
OCH3 + CH3Br |
|
|
|
|
|||||||
|
|||||||||
3 |
3 |
2 |
|
|
|
|
|
||
|
OCH3 |
|
|
|
|
O |
|||
− реакция Кучерова М.Г.
|
|
|
HgSO4 |
|
|
O |
HC |
|
CH + H2O |
H3C |
|
C |
|
|
|
|
||||
|
|
|
||||
|
|
|||||
|
|
|
|
|
|
H |
21
ГЛАВА 1. СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1.1. Развитие теории строения органических соединений
Первой известной теорией строения органических соединений является теория радикалов. Она была разработана Берцелиусом, Гей-Люссаком и Велером (1815−1832 г.г.). Cогласно этой теории в процессе химических реакций группы атомов (радикалы) в неизменном виде переходят в образующиеся в этих реакциях молекулы. Например, радикал ацетил
O H3C C
содержится в молекулах разных органических соединений:
|
|
|
|
O |
|
|
|
|
||||
H C |
|
|
C |
|
|
|
|
|
|
|
водородистый ацетил (уксусный альдегид) , |
|
|
|
|
|
|
|
|||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||||
|
|
|
|
O |
|
|
|
|
||||
H3C |
|
C |
|
|
|
|
|
|
хлористый ацетил , |
|||
|
|
|
|
|
|
|||||||
|
|
|
|
Cl |
|
|
|
|
||||
|
|
|
|
O |
|
|
|
|
||||
H3C |
|
C |
|
|
|
|
|
гидроксид ацетила (уксусная кислота) , |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
OH |
|
|
|
|
||||
|
|
|
|
O |
|
|
|
|
||||
H3C |
|
C |
|
|
|
|
ацетат натрия (уксуснокислый натрий) и т.д. |
|||||
|
|
|
|
|
||||||||
|
|
|
|
ONa |
|
|
|
|
||||
В большинстве химических реакций радикалы не изменяются
СH CO |
|
H + Ag O |
CH CO |
|
OH + 2Ag |
|
|
||||
3 |
2 |
3 |
|
|
|
Недостатком теории радикалов является наличие реакций, в которых изменяется сам радикал:
СH3CO |
|
OH + Cl2 |
Cl |
|
CH2CO |
|
OH + HCl |
|
|
|
В теории типов, разработанной Жераром и Лораном (1840-1860 г.г.), в отличие от теории радикалов, обращено внимание на изменчивые части органических молекул и причины этой изменчивости.
Органические молекулы – продукты замещения одного или нескольких атомов водорода в типичных неорганических соединениях на органические остатки. Органические молекулы обладают характерными «типическими» свойствами исходных неорганических соединений.
H |
CH3 |
CH3 |
COCH3 |
Тип воды O : |
O |
O |
O |
H |
H |
CH3 |
H |
|
метиловый |
диметиловый |
уксусная |
|
спирт |
22эфир |
кислота |
Тип хлористого |
|
|
|
|
|
|
: |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
HCl |
H3C |
|
|
C |
H3C |
|
|
|
Cl |
|
|
|
|
|||||||||||||||||
водорода |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
хлористый |
хлористый |
хлористый |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ацетил |
метил |
|
фенил |
|||||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
||||||
Тип аммиака |
H |
|
|
|
N : |
|
H |
|
|
N |
H |
|
|
N |
|
H3C |
|
N |
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH |
|
|
|
|
CH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
3 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
метиламин |
диметиламин |
|
триметиламин |
|||||||||||||||||||||
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
H |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Тип метана |
H |
|
C |
|
H |
H |
|
C |
|
CH3 |
H |
|
C |
|
CH3 |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
CH3 |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
этан |
|
пропан |
|
|
|
|
|
|||||||||||||||
Сходство органических соединений с неорганическими соединениями, лежащими в основе данного типа, заключается в составе, способах получения и химических свойствах:
2 |
H |
|
2Na |
2 |
H |
+ H2 |
O |
+ |
O |
||||
|
|
|
|
|
|
|
|
H |
|
|
|
Na |
|
2 |
H |
|
2Na |
2 |
Na |
+ H2 |
O |
+ |
O |
||||
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
По мере открытия новых соединений число типических формул неорганических соединений для них возросло, теория типов зашла в тупик.
В 1861 году А.М. Бутлеров сформулировал основные положения
теории строения органических соединений:
1.Атомы органической молекулы соединяются между собой в определенном порядке в соответствии с их валентностью, что определяет химическое строение молекул.
2.Свойства соединения определяются составом и строением моле-
кул.
3.Различное строение молекул при одинаковом качественном и ко-
личественном составе обусловливает явление изомерии:
C2H6O
H3C CH2 OH H3C O CH3
23

4. Атомы в молекуле оказывают взаимное влияние друг на друга, то есть реакционная способность атомов меняется в зависимости от того, с какими атомами в молекуле они связаны:
2 C2H5OH + 2Na  2 C2H5ONa + H2 H3C O CH3 + Na
2 C2H5ONa + H2 H3C O CH3 + Na 
5.Свойства любого вещества могут быть описаны, если известны его химический состав, химическое строение и взаимное влияние атомов.
6.Каждое органическое соединение имеет одну формулу.
Теория А.М. Бутлерова позволила объяснить многие свойства органических соединений. Ее принципиальные основы сохраняют направляющую роль в развитии современных теорий строения органических соединений.
Я. Вант-Гофф и М. Ле-Бель дополнили представления о химическом строении, заложенные А.М. Бутлеровым, и развили идею о пространственном расположении атомов в молекуле органического вещества (стереохи-
мическую теорию органических соединений). Они независимо друг от дру-
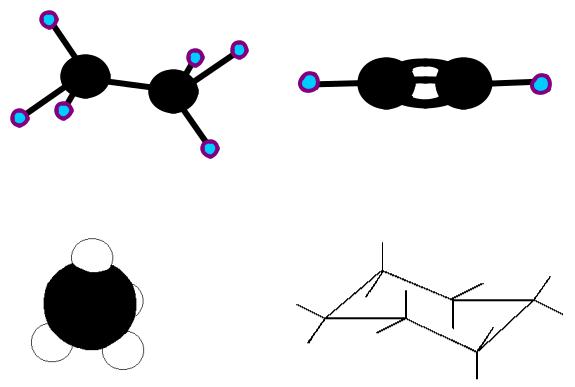
га (1874 г.) установили тетраэдрическое строение молекулы метана. Атомы водорода, связанные с атомом углерода, расположены не в одной плоскости, а в вершинах правильного тетраэдра, в центре которого находится атом углерода с тетраэдрическим углом 1090 28 (рис. 1.1.а). Молекула этана представляет собой два тетраэдра, соединенные вершинами и свободно вращающиеся вокруг общей оси (рис. 1.1.б). Молекула этилена состоит из двух тетраэдров, соединенных общим ребром (рис. 1в), а молекула ацетилена изображается моделью, в которой два тетраэдра соединены общей гранью (рис. 1.1.г).
а |
б |
в |
г |
Рис.1.1.
Модели по Вант-Гоффу: метана (а), этана (б), этилена (в), ацетилена (г).
24
Работы Я. Вант-Гоффа и М. Ле-Беля положили начало плодотворному направлению в органической химии – стереохимии, то есть учению о пространственном расположении атомов. Пространственные модели ВантГоффа используются для объяснения различных стереохимических аспектов, где пространственное расположение атомов играет определяющую роль: строение сложных молекул, направление химических реакций.
Наряду с моделями Вант-Гоффа в настоящее время применяются и другие модели, построенные с учетом длин химических связей и валентных углов (углов, образованных направлениями связей между отдельными атомами).
На рис. 1.2 ÷ 1.4 представлены наиболее употребляемые типы молекулярных моделей.
а |
б |
Рис. 1.2.
Шаро-стержневые модели: а − этана, б − ацетилена.
Рис.1.3. |
Рис.1.4. |
Модель метана |
Модель циклогексана |
по Стьюарту-Бриглебу |
(конформация кресло) по Дрейдингу. |
1.2. Химическая связь в органических соединениях
Под химической связью понимают различные виды взаимодействия, обусловливающие устойчивое состояние двухили многоатомных молекул. В органической химии различают два вида химической связи – ковалентную и ионную. Тип связи между атомами А и В можно определить по разности относительных электроотрицательностей атомов химических элементов ( ОЭЭ) (табл. 1.1).
25
Таблица 1.1
Разности относительных электроотрицательностей и тип химической связи
ОЭ |
Тип химической связи |
|
|
|
|
|
|
|
|
|
Примеры |
|
|
Э |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
Ковалентная неполярная связь |
H3C |
|
|
|
|
CH3 |
|
|
||||
|
|
|
|
|
|
ОЭЭ = 0 |
|
||||||
|
|
2. 5 2. 5 |
|
|
|
||||||||
|
|
|
|
|
|
||||||||
< 1.7 |
Ковалентная полярная связь |
H3C |
|
|
OH |
ОЭЭ = 1 |
|
||||||
|
|
|
|
||||||||||
|
2. 5 3. 5 |
|
|
|
|||||||||
|
|
|
|
|
|
||||||||
|
Ионная связь |
O |
|
|
|
|
|||||||
> 1.7 |
|
C |
|
O |
|
|
Na |
ОЭЭ = 2 |
.57 |
||||
|
|
|
|
||||||||||
|
|
H3C 3. 5 |
0. 93 |
||||||||||
|
|
|
|
||||||||||
Ковалентная связь является основным видом химической связи в органических соединениях. Это связь, образованная путем обобществления
пары электронов двумя атомами.
Если ковалентная связь образована одинаковыми атомами или группами атомов, например, H3C−CH3, то обобществленные электроны равномерно распределены между ними. Такая химическая связь называется ко-
валентной неполярной связью.
Если один из атомов сильнее притягивает электроны, то обобществленная электронная пара смещается в сторону этого атома. В таком случае возникает полярная ковалентная связь. Критерием способности атомов притягивать к себе электроны служит электроотрицательность.
Электроотрицательность − способность атомов притягивать к себе электроны:
= I+E,
где I − энергия ионизации атома, эв;
Е − сродство атома к электрону, эв.
ILi |
= 5.39 эв |
ELi = 0.54 эв |
Li = 5.39 + 0.54 = 5.93 эв |
IF |
= 17.42 эв |
EF = 3.62 эв |
F = 17.42 + 3.62 = 21.04 эв. |
|
Понятие относительной электроотрицательности элементов вве- |
||
дено |
Л.Полингом. |
Относительная электроотрицательность элемента |
|
(ОЭЭ) − безразмерная величина, равная отношению электроотрицательности исследуемого элемента к электроотрицательности лития:
ОЭЭF = F Li = 21.04 / 5.93
26
Относительная электроотрицательность связана с положением элемента в периодической системе. В периодах ОЭЭ возрастает слева направо, так как растет заряд атома при одинаковом числе энергетических уровней, а в
группе |
− понижается сверху вниз, поскольку возрастает радиус атома |
||||||||||||
(табл. 1.2). |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.2 |
|
|
|
|
Относительные электроотрицательности элементов по Полингу |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
|
H |
|
|
|
|
|
|
|
|
|
He |
|
|
|
2,20 |
|
|
|
|
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II |
|
Li |
Be |
B |
C |
N |
O |
F |
|
|
|
Ne |
|
|
|
0,98 |
1,57 |
2,04 |
2,55 |
3,04 |
3,44 |
3,98 |
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
|
|
Ar |
|
|
|
0,93 |
1,31 |
1,61 |
1,90 |
2,19 |
2,58 |
3,16 |
|
|
|
− |
|
|
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
|
|
IV |
|
0,82 |
1,00 |
1,36 |
1,54 |
1,63 |
1,66 |
1,55 |
1,83 |
1,88 |
1,91 |
|
|
|
|
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
|
|
|
Kr |
|
|
|
1,90 |
1,65 |
2,01 |
2,01 |
2,18 |
2,55 |
2,96 |
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
|
|
V |
|
0,82 |
0,95 |
1,22 |
1,33 |
1,60 |
2,16 |
1,90 |
2,20 |
2,28 |
2,20 |
|
|
|
|
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
|
|
|
Xe |
|
|
|
1,93 |
1,69 |
1,78 |
1,96 |
1,82 |
2,05 |
2,66 |
|
|
|
− |
|
|
|
Cs |
Ba |
La* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
|
|
VI |
|
0,79 |
0,89 |
|
1,30 |
1,50 |
2,36 |
1,90 |
2,20 |
2,20 |
2,28 |
|
|
|
|
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
|
|
|
Rn |
|
|
|
2,54 |
2,00 |
2,04 |
2,33 |
2,02 |
2,00 |
2,20 |
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VII |
|
Fr |
Ra |
Ac** |
* Лантаноиды: 1,10 – 1,27 |
|
|
|
||||
|
|
|
0,70 |
0,90 |
|
**Актиноиды: 1,10 – 1,30 |
|
|
|
||||
Относительная электроотрицательность зависит от типа гибридизации атома. Чем меньше доля р-электронов, тем выше ОЭЭ. Например,
|
Csp 3 |
Csp 2 |
Csp 3 |
|
. |
. |
. |
ОЭЭ |
2 5 |
2 8 |
3 1 |
Разность ОЭ атомов, образующих ковалентную связь, характеризует полярность связи. У атома с более высокой ОЭ повышается электронная плотность, и он получает эффективный отрицательный заряд −. Атом с более низкой ОЭ получает эффективный положительный заряд +:
27

|
|
|
+ |
− |
H3С |
|
Cl H3С:Cl |
H3С Cl |
|
|
||||
ОЭЭ 2.5 3.0
Ковалентные связи в органических соединениях обладают следующими свойствами:
1.Насыщаемость − способность атомов к образованию ограниченного числа ковалентных связей. Водород Н образует 1 связь, углерод С - 4 связи.
2.Длина связи - межъядерное расстояние. Длины связей:
|
C |
|
C |
|
C |
|
C |
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|||||||
0.154 нм |
0.134 нм |
0.120 нм |
|||||||||||
3. Энергия связи - количество энергии, необходимое для разрыва свя-
зи. EC−C = 339 кДж/моль, EC=С = 611 кДж/моль, ЕС С = 813 кДж/моль. 4. Направленность связи определяет геометрию молекулы.
Квантовохимическая теория электронного строения атомов объясняет образование общей электронной пары как перекрывание электронных облаков.
-Связи − это ковалентные связи, при образовании которых об-
ласть перекрывания электронных облаков находится на линии, соединяющей ядра атомов:
s-s |
s-p |
p-p |
H−H |
H−Cl |
Cl−Cl |
-Связи − ковалентные связи, при образовании которых область
перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов:
CH2 CH2
Одинарная (простая) связь образована одной электронной парой, она всегда является -связью. Двойная связь, образованная двумя общими
28
электронными парами, состоит из одной -связи и одной -связи. Тройная связь образована тремя общими электронными парами и состоит из одной-связи и двух -связей.
Гибридизация орбиталей − смешение атомных орбиталей (электронных облаков) разной формы, обладающих различной энергией, в результате которого образуются гибридные орбитали (табл. 1.3), одинаковые по форме и энергии. Число гибридных орбиталей равно числу орбиталей, участвующих в гибридизации:
|
s −орбиталь |
p − орбиталь |
sp − гибридная орбиталь |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.3 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
Типы гибридизации атома углерода |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Валент- |
|
|
|
|
|
|
|
|
|
|
Тип гибри- |
конфигура- |
Валент- |
|
|
|
|
|
|
|
|
|
ное со- |
|
Типы связей |
ция молеку- |
|
|
|
|
|
|
|
|
|
||||||||||
|
дизации |
ные углы |
Примеры |
|||||||||||||||||||
стояние |
|
|
|
|
|
|
|
|
|
|
|
лы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp3-гибриди- |
Тетраэдри- |
Тетраэд- |
|
Метан |
|||||||
Первое |
|
|
|
|
|
|
|
|
|
зация. Смеши- |
ческая пи- |
рический |
|
|
CH4 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
ваются 4 элек- |
рамида |
угол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
троных облака |
|
109 28' |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
sp2-гибриди- |
Плоская |
120 |
|
Этилен |
|||||||
Второе |
|
|
|
|
|
зация, |
треуголь- |
|
H |
H |
||||||||||||
|
|
|
|
|
|
|
|
смешиваются 3 |
ная |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
C |
|
|
|
|
C |
|
|
C |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
электронных об- |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
лака |
|
|
H |
H |
|||||||
|
|
|
|
|
|
|
|
|
sp-гибриди-зация, |
Линейная |
180 |
Ацетилен |
||||||||||
Третье |
|
|
C |
|
смешиваются 2 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
электронных об- |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
H |
|
C |
|
|
C |
|
H |
|||||||
|
|
|
|
|
|
|
|
|
лака |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ковалентная связь может быть образована не только перекрыванием электронных облаков атомов, образующих молекулу (обменный механизм), но и за счет неподеленной пары электронов атома-донора и вакантной электронной орбитали атома или иона-акцептора (донорно-акцепторный механизм). Последняя связь называется донорно-акцепторной или координационной. Это не особый вид связи, а лишь иной механизм образования ковалентной связи. В качестве примера приведем схему образования иона алкиламмония. В молекуле алкиламина атом азота имеет неподеленную пару электронов (двухэлектронное облако), а у протона имеется вакантная 1s-
29
орбиталь. При сближении алкиламина с протоном двухэлектронное облако атома азота становится общим для азота и водорода, то есть превращается в молекулярное электронное облако. Возникает четвертая ковалентная связь. Заряд протона делокализуется между всеми атомами:
|
|
H |
|
+ H+ |
|
|
|
H |
|
+ |
|||||
|
|
|
|
|
|||||||||||
R |
|
N : |
|
|
R |
|
N |
|
H |
|
|||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
||
|
|
H |
|
|
|
|
|
|
|
|
|
||||
|
акцептор |
|
|||||||||||||
|
|
|
|
|
|
||||||||||
донор |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Семиполярная (полуполярная) химическая связь – разновидность до- норно-акцепторной связи, представляющая сочетание ковалентной и ионной связи. Этот тип связи реализуется в нитросоединениях, N-оксидах, сульфоксидах и некоторых других соединениях. Семиполярную связь изображают стрелкой, идущей от донора к акцептору, или к обычной ковалентной связи добавляют знаки зарядов, возникающих на доноре (положительный заряд) и акцепторе (отрицательный заряд). В качестве примера приведем схему образования нитросоединений:
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
R |
|
N |
|
O + H |
|
O |
|
O |
|
H |
R |
|
N + H2O |
|
|
||||||||||||
|
|
|
|
|
|||||||||
|
|
||||||||||||
.. |
. |
|
|
|
|
|
|
|
|||||
O
Азот связан с одним из атомов кислорода обычной двойной ковалентной связью за счет обобществления двух электронов атома азота и двух электронов атома кислорода. Оставшаяся неподеленная пара электронов атома азота образует донорно-акцепторную связь со вторым атомом кислорода, при этом на атоме азота (донора) появляется положительный заряд, а на атоме кислорода (акцептора) – отрицательный.
Разновидностью ковалентной связи, образованной по донорно-
акцепторному типу, является водородная связь.
Водородная связь (ВС) − это особый вид химической связи между атомами водорода и сильноэлектроотрицательными атомами (F, O, N), имеющими неподеленную пару электронов. В силу своих малых размеров и очень слабого экранирования атом водорода может очень близко подходить к неподеленным парам электронов электроотрицательных атомов. Энергия возникающего при этом электростатического притяжения оказывается соизмеримой с энергией прежней связи, и поэтому энергетический барьер перехода протона от одного электроотрицательного атома к другому очень невелик. Обозначают водородную связь условно в виде трех точек (…). Энергия водородной связи значительно ниже энергии ковалентной (примерно 4 ÷ 33 кДж/моль), но ВС оказывает определенное влияние на химические и физические свойства соединений, так как для ее разрыва требуется дополнительная энергия. Слабые ВС приводят к образованию ассоциированных систем. Наличие в таких системах ВС объясняет умень-
30
