
796
.pdf
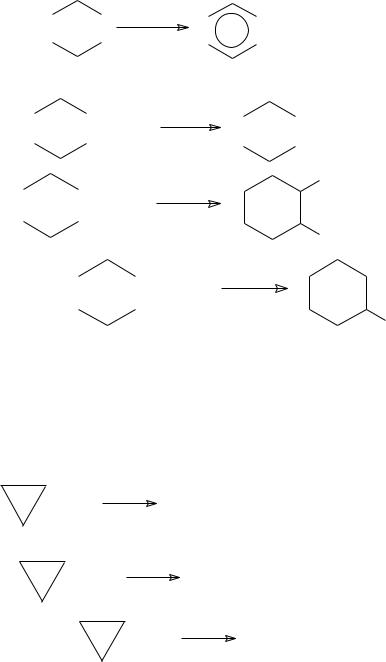
3. Конформационная изомерия (см. 1.4. Типы изомерии):
"кресло" "ванна"
Физические свойства. Подобно алифатическим соединениям алициклические углеводороды существуют в трех агрегатных состояниях: газообразном (циклопропан, t кип. –350С, циклобутан, t кип. -130С), жидком (циклопен-
тан, t кип. 490С, циклогексан, t кип. 81) и твердом (камфан, т. пл. 158−1590С). Температуры плавления, кипения и плотности (плотность меньше 1) их
выше, чем у соответствующих соединений алифатического ряда с тем же числом углеродных атомов. Алициклические соединения гидрофобны, лиофильны.
Подобно алканам циклоалканы не имеют полос поглощения в области УФ выше 200 нм. Инфракрасные спектры циклоалканов подобны спектрам алканов, за исключением полосы при 1380 см-1, которая характерна для концевых СН3-групп и отсутствует у циклоалканов. Особо следует остановиться на спектрах ПМР алициклических соединений. Специфика циклопропанового кольца заключается в наличии кольцевых токов в трехчленных циклах, обусловливающих магнитноанизотропное экранирование протонов цикла ( 0.22 м.д.), и позволяет легко определить его наличие в составе исследуемой молекулы по спектрам ПМР. С увеличением размера цикла экранирование кольцевых протонов резко уменьшается, приближа-
ясь к области экранирования ациклических соединений: |
|
|
|
||
– число звеньев в цикле…………….3 |
4 |
5 |
6 |
7 |
8 |
– химические сдвиги м.д.……..0.22 |
1.97 |
1.51 |
1.43 |
1.53 |
1.53 |
Химические свойства. Химические свойства алициклических углеводородов зависят от величины цикла и насыщенности его связей.
5- и 6-членные углеводородные циклы, характеризующиеся малым уг-
ловым напряжением, обладают теми же химическими свойствами, что и соответствующие им алифатические углеводороды, то есть для циклоалканов характерны реакции замещения и отщепления, а для циклоалкенов, -алкинов, -алкадиенов – реакции присоединения.
Реакции циклоалканов:
а) хлорирование:
|
h |
Cl |
|
|
+ Cl2 |
+ |
HCl |
||
|
||||
|
|
|
||
111 |
|
|
|
б) дегидрирование: |
|
|
|
|
Pt |
|
|
|
|
|
+ |
3 H2 |
|||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
100 −: 150 0 C |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Реакции циклоалкенов: |
|
|
|
|
||||||||||
а) гидрирование: |
|
|
|
|
|
|
Pt |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
+ |
H2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl
б) хлорирование: |
|
|
+ Cl2 |
Cl
в) гидрогалогенирование: |
|
|
+ HX |
|
|
|
|
X
Итак, поскольку 5- и 6-членные алициклические углеводороды точно повторяют химические свойства соответствующих алифатических углеводородов, поэтому их называют алифатическими циклами.
3- и 4-членным алициклическим углеводородам, обладающим высо-
ким угловым напряжением, свойственны реакции присоединения за счет разрыва кольца:
|
Ni |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а) гидрирование: |
+ H2 0 |
H3C |
|
CH2 |
|
|
CH3 |
||||||||
|
|
|
|||||||||||||
|
80 |
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
б) хлорирование: |
+ Cl2 |
|
ClCH2 |
|
|
CH2 |
|
|
CH2Cl |
||||||
|
|
|
|
|
|
||||||||||
в) гидрогалогенирование: |
+ |
HX |
H3C CH2 CH2X |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Практическое применение. Циклопропан используется в медицине в качестве ингаляционного анестезирующего средства. Циклогексан − хороший органический растворитель, кроме того, он широко применяется в синтезе адипиновой кислоты и капролактама. Примером соединения с большим кольцом (содержащим более 6 углеродных атомов) является мускон, выделяемый из желез самца мускусной кабарги, а в настоящее время получаемый более дешевым синтетическим путем. Он широко используется в парфюмерии в качестве душистого вещества и фиксатора запаха. Цибетон, выделяемый из цибетты (пахучей железы африканской виверры), как и мускон, используется в парфюмерии. Лимонен и α-пинен используются в приготовлении медицинских препаратов.
112
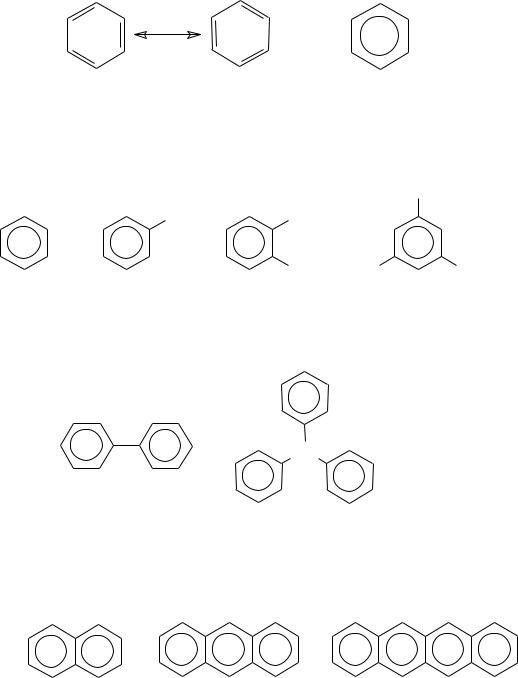
3.6. Арены (ароматические углеводороды)
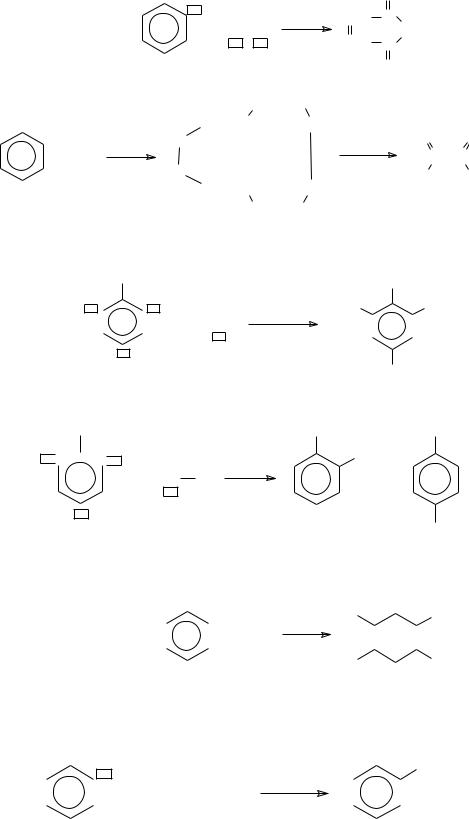
Арены – это класс углеводородов, содержащих особую функциональную группу − бензольное кольцо, представляющее собою плоский равносторонний шестиугольник с чередующимися одинарными и двойными углерод-углеродными связями, который принято изображать формулами:
или
Арены образуют гомологический ряд с общей формулой C6H2n-6. Классификация. Различают следующие типы аренов:
1. Моноядерные арены, представляемые бензолом (―родоначальником‖ аренов) и его гомологами:
|
|
|
|
CH3 |
|
CH3 |
CH3 |
|
|
|
|
CH3 |
H3C |
CH3 |
бензол |
толуол |
о -ксилол |
|
мезитилен |
2. Полиядерные неконденсированные арены, в которых арильные ядра соединены между собою одинарными связями:
CH
дифенил
трифенилметан
3. Полиядерные конденсированные арены (ароматические ядра, имеющие не менее двух общих углеродных атомов, входящих одновременно в состав соседних циклов):
Нахожде- нафталин антрацен тетрацен ние в
природе. Нефть является одним из главных источников аренов (в уральском месторождении их содержится до 60%, татарском – 18.7, северокавказском – 14.8, сибирском – 13).
113
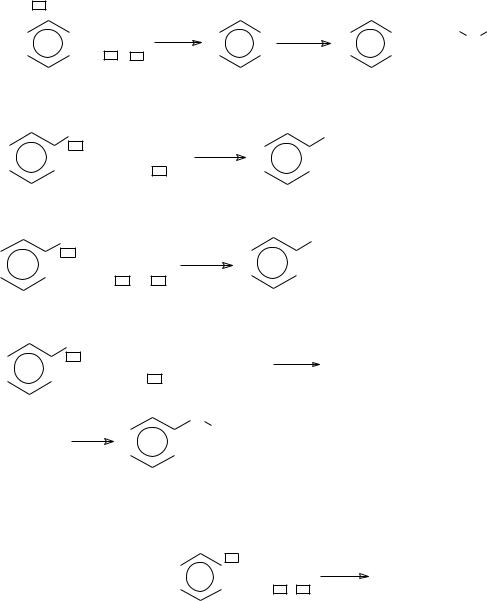
Методы получения:
1.Коксование каменного угля.
2.Дегидроциклизация (ароматизация) алканов, содержащих не менее 6 углеродных атомов в главной цепи:
|
|
H C |
|
|
|
CH |
|
CH |
|
CH |
|
|
|
CH |
|
CH |
Pt/Al2O 3 |
4H + |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
3 |
|
2 |
2 |
2 |
|
|
2 |
|
3 |
|
|
|
2 |
|
|
|||||||||||||
3. |
Тримеризация алкинов: |
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||||||||
|
|
3 HC |
|
|
|
|
|
|
|
Ni(CO)4, P(C6H5)3 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
C |
|
CH3 |
|
− |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 :70 |
|
C |
H3C |
|
CH3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
4. |
Реакция Вюрца-Фиттига: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
+ ClCH2CH3 + |
Zn |
|
|
|
|
|
|
+ ZnCl2 |
||||||||||||
5. |
Реакция Фриделя-Крафтса: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AlCl3 |
|
|
CH2CH3 |
|||||||||
|
|
|
|
|
|
|
|
|
|
+ ClCH2CH3 |
|
|
|
|
|
|
+ HCl |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
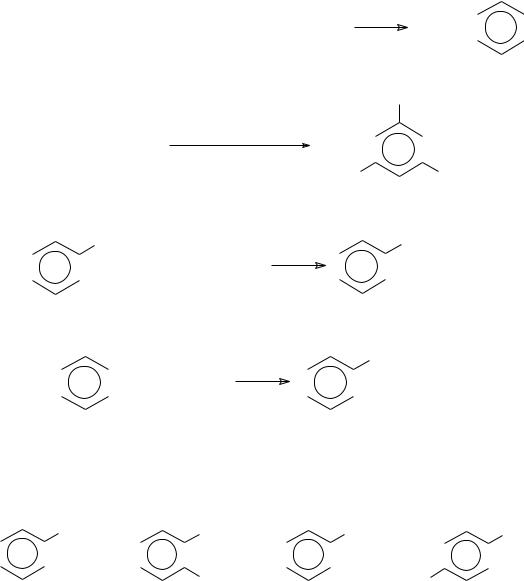
Изомерия. Первый гомолог бензола – метилбензол или толуол, как и любые монозамещенные производные бензола, не имеет изомеров положения. Для второго гомолога – этилбензола − существуют четыре изомерные формы:
|
|
CH2CH3 |
|
|
CH |
|
|
|
CH |
|
|
CH |
|
|
|
3 |
3 |
3 |
|||||||
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
CH3 |
|
|
|
||
этилбензол |
орто- ксилол, |
мета -ксилол, |
пара-- ксилол, |
|||||||||
, |
|
|
|
, |
|
|
|
, |
|
|
||
|
|
1 2- диметилбензол |
1 3- диметилбензол |
1 4- диметилбензол |
||||||||
Физические свойства. Ароматические углеводороды представляют собой бесцветные жидкости или твердые тела с характерным запахом. Низшие члены гомологического ряда бензола легче воды (d 0.86 ÷ 0.90 г/см3), хорошо перегоняются с водяным паром. Температура кипения, плотность и показатель преломления у них значительно выше, чем у соответствующих алифатических углеводородов. Так, например, t кип. гексана равна 68.80С, тогда как бензола – 80.10С. Температуры плавления твердых аренов также
114
заметно выше, особенно у конденсированных многоядерных углеводородов. Все арены нерастворимы в воде и хорошо растворимы в органических растворителях. Из-за высокого содержания углерода все ароматические соединения горят сильно коптящим пламенем. Ароматические углеводороды ядовиты.
Арены имеют три основные полосы УФ-поглощения, связанные с переходами *, в диапазоне 180 300 нм. Наличие аренов с помощью ИК-спектроскопии может быть обнаружено по поглощению в трех областях: по валентным колебаниям С – Н (3000 см-1), по скелетным колебаниям ароматических углерод-углеродных связей (1600 1500 см-1) и по поглощению переменной интенсивности ниже 900 см-1, обусловленному деформационными колебаниями С – Н. В спектрах ПМР сигналы ароматических протонов наблюдаются в области низкого экранирования (6.5 8 м.д.) благодаря эффекту диамагнитной анизотропии, обусловленному кольцевыми токами - электронов.
Химические свойства. В молекулах аренов можно наблюдать 4 реакционных центра. Из них 3 нуклеофильных: sp3-гибридный углеродный атом боковой цепи, sp2-гибридный углеродный атом кольца в орто- и пара- положениях и -электронное облако над (под) плоскостью кольца; и 1 электрофильный центр − sp2-гибридный углеродный атом кольца в мета-
положении:
..−н.ц.
|
|
− |
|
|
|
|
|
− |
R |
|
CH |
|
|
|
.. |
||
|
|
|||||||
|
.. |
2 |
|
|
|
|
н.ц. |
|
|
н.ц. |
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
− |
+ |
||||
|
|
|
|
|
||||
|
|
|
|
|
.. н.ц. |
|
э.ц. |
|
Электрофильные свойства аренов проявляются очень слабо, но зато очень сильно выражены нуклеофильные свойства. Арены обладают тремя отличительными химическими свойствами.
1. Бензольное кольцо представляет собой сопряженную систему. В силу высокой симметричности молекулы и делокализации (сопряжения) р- электронов в -молекулярных орбиталях бензольного кольца над и под его плоскостью молекулы бензола обладают особым химическим свойством − ароматичностью, то есть высокой устойчивостью к действию обычных окислителей (например, KMnO4) и, несмотря на наличие непредельной структуры, − склонностью к реакциям замещения (как и предельные углеводороды), но не присоединения.
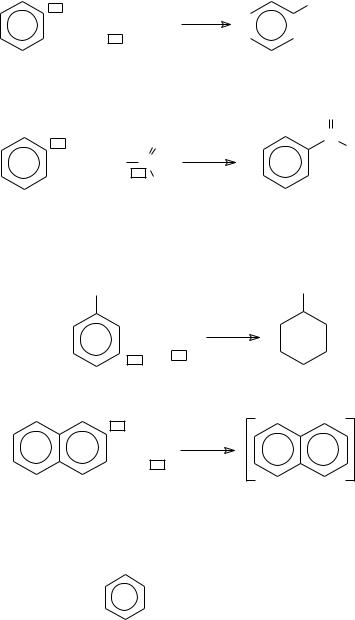
2. Благодаря положительному индуктивному эффекту (+I-эффект) алкильных радикалов в боковой цепи, сообщающих ядру бензола общую повышенную электронную плотность, причем, за счет эффекта сопряжения
115
наибольшую − в орто- и пара-положениях, углеродные атомы в этих положениях являются нуклеофильными центрами, а в мета-положении −электрофильным центром.
3. У гомологов бензола благодаря наличию сравнительно мягкого sp3-гибридного атома углерода в боковой цепи и более жесткого sp2- гибридного атома углерода в бензольном ядре реакция замещения будет протекать в зависимости от жесткости электрофильного партнера: либо по боковой цепи, либо по кольцу – C, C-конкуренция (cм. 2.5 «Принцип ЖМКО»).
1. Нуклеофильные свойства sp3-гибридного углерода С− боковой цепи – реакции с электрофилами:
а) кислородными (SR-механизм): − окисление кислородом
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
OH |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
H3C |
|
|
CH |
|
|
CH3 |
H3C |
|
C |
|
|
|
CH3 |
|
|
OH |
|
|
|
|
||||||||||
.. |
|
|
|
|
|
|
|
|
CH3 |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
+ O |
|
O |
нагрев. |
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
H3C |
C |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
б) азотными − нитрование (SR-механизм):
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH2NO2 |
|
|||||||
|
|
|
|
.. |
+ HONO |
100 |
0 |
C |
|
|
|
|
|
|
|
|
H O |
||||||||
|
|
|
|
|
|
|
[NO.] |
|
|
|
|
|
|
|
+ |
||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
в) галогенными – галогенирование (SR-механизм): |
|
||||||||||||||||||||||||
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
CH2Cl |
|
|
|||||||
|
|
|
|
.. |
3 |
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
+ HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
+ Cl |
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
[Cl.] |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
г) металлическими – окисление перманганатом калия |
|
||||||||||||||||||||||||
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
.. |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
+ 6KMnO4 + 9H2SO4 |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
5 |
|
|
|
|
|
C OH + 6 MnSO4 |
+ 3K SO + 14 H O |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
4 |
2 |
2. Нуклеофильные свойства sp2-гибридных углеродных ато- |
|||||||||||||||||||||||||
мов C− кольца – реакции с электрофилами: |
|
|
|
||||||||||||||||||||||
а) кислородными: |
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
||||||||||
− окисление полное |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
+ 15O |
|
O |
|
12CO2 + 6 H2O |
|||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
116 |
|
|
|
|
|
|
|
|
|
|
||||
− окисление неполное
.. |
|
|
V2O5 |
||
|
|
|
|||
+ O |
|
O |
|
|
|
|
|
|
|||
. . |
450 |
0 |
C |
||
− озонирование
O
CH C
CH C O + CO2 O
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
CH |
|
|
CH |
|
|
|
O |
|
|
|
|
CH |
|
O |
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 H2O |
|
|
||
+ 3O3 |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
C |
|
C + 3 H2O2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
CH |
|
|
CH |
|
|
O |
|
|
|
|
CH |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
б) азотными (нитрование):
|
CH3 |
|
CH3 |
||
.. |
.. |
низкая t, O2N |
|
NO2 |
|
|
|
+ 3 HNO |
конц. H2SO4 |
|
+ 3H O |
|
|
|
|||
|
|
3 |
+ |
|
2 |
|
.. |
|
[NO2 ] |
|
|
|
|
|
|
|
|
в) галогенными: −галогенирование
CH3
..

 ..
..
2 |
+ 2 Cl |
..
NO2
в присутствии AlCl3
CH3 CH3
|
AlCl3 |
Cl |
|
|
Cl |
+ |
+ 2 HCl |
||
[Cl+] |
||||
|
|
|
Cl
− галогенирование при УФ-облучении (SR-механизм)
|
|
|
|
|
|
|
|
Cl |
|||
|
|
|
|
|
h |
Cl |
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ 3Cl2 |
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|||
г) серными (сульфирование): |
|
|
|
|
|
|
|||||
.. |
|
|
|
|
|
|
|
|
SO3H |
||
|
|
+ H2SO4 |
(конц.) |
|
|
|
|
|
+ H2O |
||
|
|
|
|
|
[S+O H] |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
д) углеродными: |
|
|
|
|
|
|
|
|
|||
−алкилирование |
|
|
|
|
|
|
|
|
|||
|
|
|
|
117 |
|
|
|
|
|
|
|
.. |
AlCl3 |
|
CH2CH3 |
+ ClCH2CH3 |
|
+ HCl |
|
|
|
− ацилирование
|
|
|
O |
|
|
.. |
O |
AlCl3 |
C |
CH3 |
|
+ H3C |
C |
|
+ HCl |
||
|
|
|
|||
|
Cl |
|
|
|
|
3. Электрофильные свойства sp2-гибридного углеродного
атома C + кольца – реакции с нуклеофилами:
а) водородными (гидрирование):
CH |
|
CH3 |
3 |
|
|
|
+ 3H |
Pt |
|
|
|
|
.. 2 |
|
б) щелочными металлами (образование ион-радикальной соли):
|
− |
+ Na |
Na+ |
. |
|
4. Нуклеофильные свойства -электронного облака бензольного кольца – реакции с электрофилами ( - комплексообразование):
галогенными:
+ Br2  C6H6 . Br2 ( -комплекс, tпл. = − 140 С)
C6H6 . Br2 ( -комплекс, tпл. = − 140 С)
Практическое значение аренов. Бензол – простейший представитель ароматических соединений, является важным промышленным продуктом. Используется в качестве растворителя, для производства этилбензола, кумола, циклогексана и т.д. Толуол применяется в производстве взрывчатых веществ, бензальдегида, бензойной кислоты, сахарина и т.д. Ксилолы, являющиеся смесью трех трудноразделимых изомеров, используются в качестве растворителя, а также в производстве моторного топлива. Уже упоминавшийся кумол применяется для получения фенола и ацетона. Нафталин используют как ядохимикат, в производстве тетралина и декалина, которые, в свою очередь, применяются в качестве горючего и растворителей в технике. Антрацен является сырьем для получения красителя – ализари-
на.
118

3.7. Галогенуглеводороды
Галогенуглеводороды – класс органических соединений, содержащих галогенуглеводородную функциональную группу:
C X , где X F, Cl, Br, I
Классификация. Галогенуглеводороды подразделяются по количеству
атомов галогена в молекуле. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
1. |
Моногалогенуглеводороды: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3I, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
иодметан |
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бромбензол |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
2. Дигалогенуглеводороды: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
а) геминальные (два атома галогена присоединены к одному угле- |
||||||||||||||||||||||||||||||||||||||||||||||||||
родному атому): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
H3C |
|
|
CH |
|
CH3 |
|
C |
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
− дихлорэтан |
2,2 |
− |
дихлорпропан |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
1 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
б) вицинальные (атомы галогены присоединены к соседним углерод- |
||||||||||||||||||||||||||||||||||||||||||||||||||
ным атомам): |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||||||||||
|
|
|
|
|
Cl |
|
|
|
CH2 |
|
CH2 |
|
|
Cl |
|
|
|
|
|
Cl |
|
CH2 |
|
CH |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
1,2 − дихлорэтан |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
||||||||||||||||
3. Тригалогенуглеводороды: |
|
|
|
|
|
|
|
|
|
|
1,2 − дихлорпропан |
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
а) геминальные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) |
вицинальные |
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
CCl3 |
|
|
|
|
Cl |
|
|
|
|
|
CH2 |
|
|
CH |
|
|
CH2 |
|
|
Cl |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,2,3 − трихлорпропан |
|
|
|
|
||||||||||||||
|
|
|
бензотрихлорид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
4. Полигалогенуглеводороды: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
Cl |
|
|
|
|
|
|
CH |
|
|
|
|
|
|
Cl |
|
CBr3 |
|
|
|
|
CBr3 |
|
( |
CH2 |
|
|
CHCl |
)n |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
CCl3 |
|
|
|
|
|
|
|
|
|
гексабромэтан |
|
поливинилхлорид |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
ДДТ
Кроме того, галогенуглеводороды классифицируются по характеру углеродного атома, к которому присоединяется галоген:
119
а) первичные: H3C |
|
|
CH2 |
|
|
|
|
CH2 |
|
|
CH2 |
|
Cl |
|||||||
|
|
|
|
|
|
|
|
|||||||||||||
б) вторичные: H3C |
|
|
CH |
|
|
CH2 |
|
CH3 |
||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
Cl |
|
|
|
CH3 |
|
|
|
|
||||||||
в) третичные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
H3C |
|
|
|
C |
|
CH3 |
|||||||||||
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|||||
Нахождение в природе. Галогенуглеводороды в природе не встречаются. Методы получения. Все методы синтеза галогенуглеводородов сводятся к двум основным типам.
1. Реакция присоединения (реакции с ненасыщенными углеводородами):
а) галогенирование:
CH2 |
|
CH2 + Cl2 |
Cl |
|
CH2 |
|
CH2 |
|
Cl |
|
|
|
|
б) гидрогалогенирование:
CH |
|
CH + HCl |
CH2 |
|
CHCl |
+HCl |
CH3 |
|
CHCl2 |
|
|
|
|
2. Реакция замещения:
а) галогенирование насыщенных углеводородов:
h
CH4 + Cl2  CH3Cl + HCl
CH3Cl + HCl
h
CH3Cl + Cl2  CH2Cl2 + HCl
CH2Cl2 + HCl
h
CH2Cl2 + Cl2  CHCl3 + HCl
CHCl3 + HCl
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
CHCl3 + Cl2 |
CCl4 + HCl |
||||||||||
|
|
б) галогенирование ароматических углеводородов: |
||||||||||||
|
|
|
|
AlCl3 |
|
|
|
|
Cl |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ Cl2 |
|
|
|
|
|
+ HCl |
||||
|
|
в) галогенирование спиртов: |
|
|
|
|
|
|
|
|
|
|
||
R |
|
OH+ PCl5 |
RCl+HCl +POCl3 |
(здесь R − Alk) |
||||||||||
|
||||||||||||||
|
|
|
|
|
+ |
|
|
|
|
|||||
|
|
г) разложение арилдиазониевых |
|
|
|
|
|
N |
|
N |
|
− >50 C |
||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||||||
|
|
|
солей: |
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X
+ N2
Изомерия. Для галогенуглеводородов характерны 2 подтипа изомерии: а) структурная изомерия скелета углеводородной цепи; структурны-
ми изомерами скелета углеводородной цепи являются:
H C |
|
CH |
|
|
CH |
|
|
CH |
|
|
Cl 1- хлорбутан |
|||
|
|
|
|
|
|
|
||||||||
3 |
2 |
2 |
2 |
|
|
|||||||||
H C |
|
CH |
|
CH |
|
Cl |
2-метил -1- хлорпропан |
|||||||
|
|
|
||||||||||||
3 |
|
|
|
|
|
2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
CH3 |
|
|
|
|
|
|
|
120 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
