
796
.pdf
жащие асимметрический атом углерода, существуют в виде двух изомеров, которые отличаются оптическими свойствами. Один из них вращает поляризованные лучи света вправо, а другой – влево на такой же угол. Поэтому изомерия называется оптической, а изомеры – оптическими изомерами.
По своему строению оптические изомеры являются зеркальным отражением друг друга. Поэтому оптическую изомерию называют иначе зеркальной:
H H
HO C* CH3 H3C C* OH
COOH HOOC
D − молочная |
L − молочная |
кислота |
кислота |
D-изомер вращает поляризованные лучи вправо (+), а L-изомер – влево (-) на такой же угол. D и L-изомеры называются оптическими антиподами или энантиомерами. Молекулярные комплексы, образованные из равного количества энантиомеров называют рацематами. Рацематы оптически неактивны. Число оптических изомеров определяют по формуле N = 2n, где n
– число асимметрических атомов углерода. Оптические изомеры отличаются не только оптическими, но и биологическими свойствами. Так, из четырех оптических изомеров левомицетина только один обладает терапев-
тическим действием: |
H |
|
H |
||||||||||
O2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
CH2OH |
||||||||
|
|
||||||||||||
|
|
|
|
|
|
||||||||
|
OH NHC |
|
|
|
|
|
CHCl2 |
||||||
|
|
|
|
|
|
||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
O |
|||||||
Известно, что оптической активностью обладают вещества, образованные в живых организмах под действием ферментов, что связано со стереоспецифичностью ферментов. Синтетические органические соединения с асимметрическими атомами углерода, как правило, оптической активностью не обладают. Это объясняется образованием в условиях синтеза смеси эквимолекулярных количеств D- и L-изомеров – рацематов.
По IUPAC оптические антиподы обозначают символами R (правовращающий) от латинского rectus – правый и S (левовращающий) от латинского simster – левый. Эти обозначения основаны не на сравнении с эталоном, а на правилах, учитывающих последовательное и пространственное расположение заместителей.
Существующая в настоящее время система Кана-Ингольда-Прелога использует символы R или S для обозначения каждого хирального центра,
41

в зависимости от его конфигурации. Сущность ее заключается в следующем:
a
C*
c
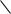 d b
d b
Предположим, в вышеуказанной структуре заместители по старшинству (заместители, связанные с хиральным центром, имеющие бóльшую молекулярную массу являются более старшими) располагаются в такой последовательности:
a b
b c
c d
d
Если из точки расположения младшего заместителя d смотреть на плоскость, в которой расположены заместители a, b и с, то R, S обозначения определяют следующим образом: если поворот от а к с происходит по часовой стрелке, то такой хиральный центр является R-конфигурацией. Если этот поворот происходит против часовой стрелки, S-конфигурацией.
Пример:
|
CHFClBr (фторхлорбромметан) |
|||
|
Br |
Cl |
F |
H |
|
Cl |
|
H |
Cl |
|
H |
|
|
|
|
Br |
F |
F |
Br |
R |
конфигурация |
S конфигурация |
||
- |
|
|
- |
|
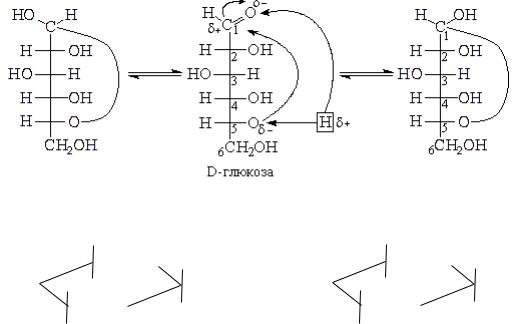
3. Конформационная (поворотная) изомерия. Конформационная изомерия связана со свободным тепловым вращением атомов или групп атомов вокруг одинарной С – С-связи. При свободном вращении вокруг - связи органические молекулы приобретают различные формы, которые называются конформациями или конформационными изомерами (конформерами, ротамерами).
42
Для алканов характерно наличие двух конформеров:
CH3 CH3
|
HH |
|
H |
|
|
H |
H |
H |
H |
H |
H |
H |
|||
|
H |
|
H |
|
|
|
|
|
А |
|
Б |
заслоненная |
конформация |
скошенная (заторможенная) конформация |
|
(проекции Ньюмена)
Заторможенная конформация энергетически более выгодна. Конформационная изомерия циклоалканов вызвана угловым напря-
жением, обусловленным большой разницей между тетраэдрическим (109028’) и геометрическим углом в плоской молекуле (например, в циклогексане этот угол равен 1200). Угловое напряжение способствует выходу атомов 1 и 4 из плоскости и приводит к образованию конформаций «ванны» и «кресла» с углом 1110:
|
|
1 |
|
|
|
6 |
1200 |
2 |
|
|
|
|
||
|
5 |
|
3 |
|
|
|
4 |
|
|
|
4 |
|
|
1 |
1 |
|
|
|
|
|
|
|
6 |
|
|
5 |
|
|
|
|
|
5 |
1110 |
|
6 |
1110 |
|
|
2 |
3 |
|
|
3 |
|
|
|
|
||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
"ванна" |
|
"кресло" |
|
(заслоненная |
|
(заторможенная |
||
конформация) |
|
конформация) |
||
|
|
43 |
|
|
1.4.3. Таутомерия
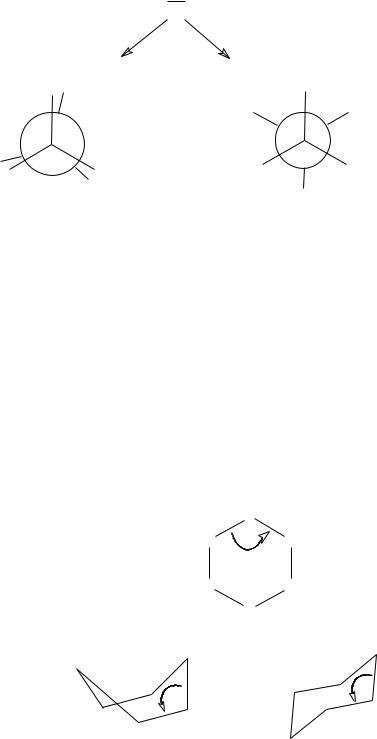
Таутомерия – изомерия, при которой происходит быстрое обратимое самопроизвольное взаимопревращение структурных изомеров – таутомеров. При установившемся равновесии вещество содержит одновременно молекулы таутомеров в определенном соотношении. Процесс такого взаимопревращения таутомеров называется таутомеризацией. Она протекает с обязательным разрывом одних химических связей и образованием других связей между атомами одной молекулы (внутримолекулярная таутомерия) или агрегата молекул (межмолекулярная таутомерия).
Известно несколько десятков видов таутомерии. Наиболее важными из них являются следующие:
1. Кето-енольная таутомерия:
+ |
H3C C CH2 |
H3C C CH2 |
|
O H + |
OH |
− |
|
кетон |
енол (непре− |
|
дельный спирт) |
2.Лактим-лактамная таутомерия:
α-оксипиридин
|
|
N OH |
|
N |
O |
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
лактим |
|
лактам |
|
|
|
|
OH |
|
O |
|
OH |
|
|
O |
|
N |
H |
N |
N |
|
CH3 |
H |
N |
CH3 |
|
|
|
|
|
||||
HO N |
O N |
HO |
N |
|
O |
N |
|
|
урацил |
|
H |
|
|
тимин |
|
H |
|
|
|
|
|
|
|
|
||
NH |
|
NH2 |
OH |
|
|
O |
|
|
2 |
|
|
|
|
|
|
|
|
N |
N |
N |
N |
H N |
|
|
N |
|
HO N |
O N H2N N N |
H2N N N |
|
|||||
|
|
H |
|
H |
|
|
H |
|
цитозин |
|
|
|
гуанин |
|
|
|
|
|
|
|
44 |
|
|
|
|
|
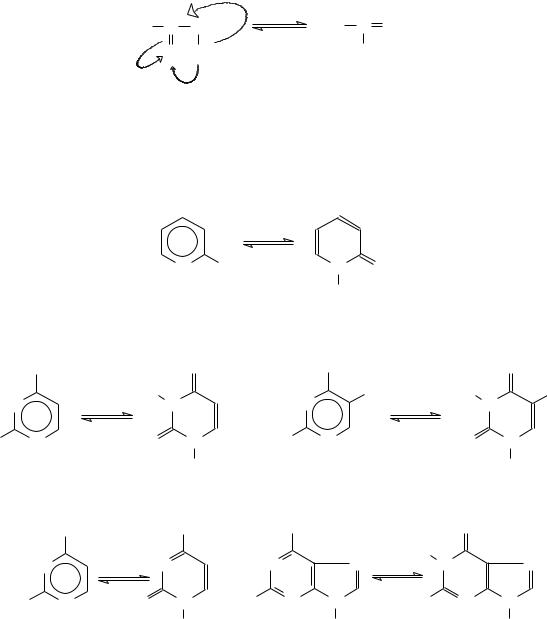
в) кольчато-цепная таутомерия:
или
|
|
CH2OH |
|
|
|
CH2OH |
|
||||||||
H |
|
|
|
O |
OH |
H |
|
|
|
O |
H |
||||
|
|
|
|
|
|
||||||||||
|
5 |
|
|
|
5 |
|
|
||||||||
|
H |
|
|
H |
|
||||||||||
|
4 OHH |
1 |
|
4 OHH |
1 |
||||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
3 |
2 |
|
|
|
|
OH |
3 |
2 |
|
|
|
||
OH |
|
|
H |
|
|
|
OH |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
H |
OH |
|
|
H |
OH |
|
||||||||
|
- D- глюкопираноза |
|
α -D - глюкопираноза |
||||||||||||
1.5. Физические методы исследования органических соединений
На протяжении всей истории химии перед учеными неизменно возникала необходимость знать, какова природа синтезированных соединений, каковы их структура и свойства, во что и как быстро они превращаются при заданных условиях. Визуальное наблюдение за строением органических молекул невозможно из-за их микроскопичности. Простые качественные или количественные химические методы далеко не всегда объясняют поведение химического соединения, исходя из его элементного состава и обнаруженных в нем функциональных групп. В решении этой проблемы огромную роль сыграли физико-химические методы. Строгого разграничения между физико-химическими и физическими методами исследования нет. Однако под физическими методами обычно понимают многие, особенно современные методы, разработанные физиками и используемые в химии, с помощью которых исследуемые вещества, находящиеся в определенном агрегатном состоянии, зондируются электромагнитным излучением различной частоты, начиная с радиоволн и кончая космическими лучами. То есть имеет место взаимодействие вещества с электромагнитным полем, а информация извлекается из характеристики излучения, прошедшего через вещество или отраженного им. Полный спектр электромагнитных волн представлен на рис.1.5[6].
45

Рис.1.5. Спектр электромагнитных колебаний.
В настоящее время наиболее популярными и информативными физическими методами исследования структуры и свойств химических соединений являются спектральные методы. Область, охватываемую спектроскопией, можно условно разделить на спектроскопию эмиссионную и абсорбционную. Первая исследует излучательную, вторая − поглощательную способность веществ. Наиболее эффективно используются некоторые виды абсорбционной спектроскопии: оптическая (ультрафиолетовая, инфракрасная) и радиоспектроскопия (ядерный магнитный резонанс).
Хотя механизмы взаимодействия электромагнитного излучения с веществом в ультрафиолетовой (УФ), инфракрасной (ИК) областях и области ядерного магнитного резонанса (ЯМР) существенно отличаются друг от друга, в любом случае при наличии резонансных условий происходит поглощение молекулой определенного количества энергии. При этом происходят переходы из состояния с низшей энергией в состояние с высшей энергией. Это изменение энергии молекул определяется известным соотношением Бора:
E = Eк – Eн = h
где Eк и Eн – энергия системы в конечном и начальном состояниях, h
– постоянная Планка, −частота электромагнитного излучения. При поглощении системой энергии E > 0, то есть мы имеем дело со спектром поглощения. Частота и длина волны электромагнитного излучения связаны соотношением:
= c/ ,
где с – скорость света в вакууме, равная 2.998 1010 см/сек. Волновой параметр в диапазоне оптической спектроскопии (в зависимости от области исследования) может быть выражен в ангстремах (Å), нанометрах (нм) или миллимикронах (ммк) для видимой и УФ областей и в микронах (мк), волновых числах (k = 2 / , измеряемых в см-1), изредка в сек-1 в ИК области.
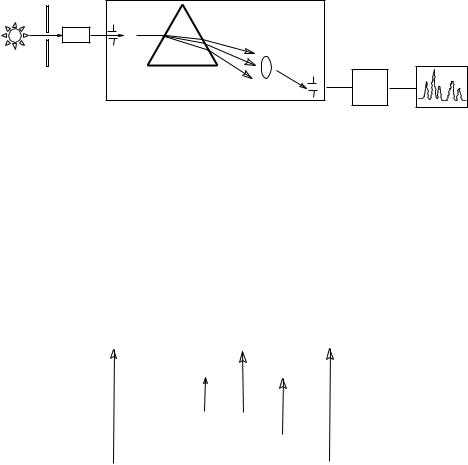
Приборы для измерения поглощения в оптической области электромагнитного излучения принципиально не отличаются друг от друга. Для наблюдения оптических спектров поглощения при любых длинах волн необходимы следующие основные элементы, изображенные на рис.1.6. В качестве источника излучения в УФ-спектроскопии используется водородная разрядная лампа, в видимой области – вольфрамовая лампа; в ИКспектрофотометрах – раскаленная проволока, излучающая тепло.
1.5.1.УФ-спектроскопия
УФ-область для практических целей разделена на три части. Область длин волн менее 200 нм (2000Å) называют вакуумной ультрафиолетовой
областью. Область 200 ÷ 360 нм называется ближней ультрафиолетовой или просто ультрафиолетовой областью. Область 360 ÷ 700 нм представ-
47
ляет собой видимую область. Поглощение световой энергии органическими соединениями в УФ-области связано с возбуждением валентных электронов - - и n-орбиталей и переходом их из основного состояния в состояние с более высокой энергией (рис.1.7), поэтому УФ-спектры называют еще электронными спектрами. Возбужденные состояния соответствуют молекулярным орбиталям, свободным в основном (невозбужденном) состоянии.
|
3 |
() |
|
1 |
5 |
6 |
|
|
|
5 |
|
|
2 |
7 |
|
|
|
||
|
|
8 |
|
|
|
6 |
|
|
|
4 |
9 |
|
|
|
Рис .1.6.
Схема прибора для измерения оптического спектра.
1 – источник излучения, 2 – щель, 3 – кювета с образцом, 4 – монохроматор, 5 – входная и выходная щели монохроматора, 6 – фокусирующая оптика,
7 – диспергирующая система (призма или дифракционная решетка), 8 – приемник излучения, 9 – записывающее устройство.
Эти орбитали называются разрыхляющими и обозначаются *- и *- орбиталями соответственно - и -cвязям. Существуют следующие типы электронных переходов (рис.1.7):
Э |
|
|
|
* |
|
|
|
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
||
н |
|
|
|
|
|
* |
|
(2) |
|
|
|
|
|
|
|||||
е |
|
|
|
|
|
(1) |
|
||
|
|
|
|
|
|
|
|||
р |
|
|
|
n |
|
(3) |
(4) |
||
|
|
|
|
|
|||||
|
|
|
|
||||||
г |
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
я |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||||
Рис.1.7. Относительные энергии молекулярных орбиталей
Переходы (1), (2), (3) и (4) называются n – *, n – *, – * и – * соответственно.
Изолированную функциональную группу, не сопряженную с какойлибо другой группой, называют хромофором, если она проявляет характеристическое поглощение в УФ или видимой областях спектра. Спектральные характеристики некоторых изолированных хромофорных групп приведены в табл.1.5 [6]. Группы, которые сами по себе не поглощают свет с длиной волны выше 200 нм, но при включении в какую-либо хромофорную систему вызывают смещение соответствующей полосы в длинноволновую область (батохромный сдвиг), называются ауксохромами.
Поглощение света, вызванное переходами – *, имеет настолько высокую энергию, что оно наблюдается только в вакуумной ультрафиоле-
48

товой области и поэтому не имеет большого значения для количественной интерпретации спектра.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Характеристики простых хромофорных групп |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хромофор |
|
Соединение |
|
макс, нм |
макс |
Раствори- |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тель |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
3 |
4 |
|
|||
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
С |
|
Этилен (газ) |
|
171 |
15530 |
− |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Октен-1 |
|
177 |
12600 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гептан |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
178 |
10000 |
― |
|
|
|
C |
|
|
C |
|
|
|
|
|
|
|
|
|
|
196 |
2100 |
― |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
223 |
160 |
― |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Октин-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
Ацетальдегид |
|
160 |
20000 |
− |
|||||||||||
|
|
|
|
|
|
|
|
|
(газ) |
|
180 |
10000 |
− |
||||||||||||
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
O |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
290 |
17 |
Гексан |
|||||||
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
COOH |
|
Уксусная |
|
208 |
32 |
Этанол |
|||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|
|
|
|
|
|
COCl |
|
Хлористый |
|
220 |
100 |
Гексан |
|||||||||||||
|
|
|
|
|
|
|
ацетил |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
178 |
9500 |
|
|
|
|
|
|
|
|
CONH2 |
|
Ацетамид |
|
220 |
63 |
Вода |
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Этилацетат |
|
211 |
57 |
|
|
|
|
|
|
|
|
COOC2H5 |
|
|
|
|
|
Этанол |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
201 |
5000 |
|
|
|
|
|
|
|
|
|
|
NO2 |
|
Нитрометан |
|
274 |
17 |
Метанол |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
−ONO2 |
|
Бутилнитрат |
|
270 |
17 |
Этанол |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
220 |
14500 |
|
|
|
|
|
ON O |
|
Бутилнитрит |
|
356 |
87 |
Гексан |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
300 |
100 |
|
|
|
|
|
NO2 |
|
|
|
|
|
|
Нитрозобутан |
|
665 |
20 |
Эфир |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|
|
|
N |
|
|
|
Ацетоксим |
|
190 |
5000 |
Вода |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
49 |
|
|
|
|
|
|
|
C |
|
|
N |
Ацетонитрил |
167 |
Небольшой |
|
||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(газообразный) |
|
|
|
|
|
|
|
|
|
N3 |
Азид уксусной |
285 |
20 |
Этанол |
|||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
410 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диазометан |
249 |
10050 |
Этанол |
|
|
|
|
|
|
N2 |
Диазоуксусный |
378 |
16 |
газообраз- |
|||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфир |
|
|
ный |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
338 |
4 |
― |
|
|
|
|
|
|
|
|
N |
|
N |
|
|
Азометан |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поглощение света олефиновыми двойными связями в области 160−180 нм обусловлено – *-переходами. Поглощение карбонильными группами альдегидов и кетонов при 150 160 нм связано с переходами n–*, при 180 190 нм − с переходами – * и при 275 295 нм – с n– *- переходами.
Большинство регистрирующих спектрофотометров записывает поглощение в зависимости от длины волны, поэтому для того, чтобы получить из УФили видимого спектра максимальную информацию, необходимо точно измерить длину волны макс и интенсивность каждого максимума поглощения.
Для вычисления интенсивности полосы поглощения пользуются законами Бугера-Ламберта и Бэра. Согласно закону Бугера-Ламберта, интенсивность света, проходящего через однородную среду, падает с ростом толщины слоя по экспоненциальному закону, который в логарифмической форме выглядит как
D = lg |
I0 |
= d |
|
|
I |
||||
|
|
|
где I0 – интенсивность падающего света; I – интенсивность прошедшего света; - коэффициент мольной экстинкции (погашения), d – толщина поглощающего слоя, см. Коэффициент мольной экстинкции является индивидуальной характеристикой вещества для любой длины волны.
Закон Бэра дополняет предыдущий закон зависимостью между поглощающей способностью и концентрацией поглощающего вещества в растворе. Оба закона в объединенном виде могут быть представлены как
D = lg |
I0 |
= cd |
|
I |
|||
|
|
где с – концентрация раствора исследуемого вещества. Экспериментальное определение выполнения закона Бэра для данно-
го вещества заключается в исследовании зависимости оптической плотно-
50
