
796
.pdf
б) структурная изомерия положения функциональной группы:
|
|
|
Cl |
|
|
Cl |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
Cl |
|
|
|
Cl |
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
1,2- |
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
Cl дихлорбензол |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
1,3-дихлорбензол |
1,4-дихлорбензол |
||||||||||||
CH3 |
|
CH2 |
|
CH2 |
|
CH2Br |
CH3 |
|
CH2 |
|
CHBr |
|
CH3 |
|||||||
|
|
|
|
|
|
|||||||||||||||
|
нормальный первичный |
|
норм альный втор ичный |
|||||||||||||||||
|
|
бро мистый бутил |
|
|
бромистый бу тил |
|||||||||||||||
|
|
(1− бромбу тан) |
|
|
( 2 −бром бутан) |
|||||||||||||||
Физические свойства. Галогенуглеводороды существуют в трех агрегат-
ных состояниях: CH3F, C2H5F, C3H7F, C4H9F, CH3Cl, C2H5Cl и CH3Br
−газы, остальные – жидкие или твердые вещества. В ряду RF < RCl < RBr < RI температуры кипения и плотности галогенуглеводородов возрастают. Все галогенопроизводные органические соединения гидрофобны, но легко растворяются в органических растворителях (лиофильны). Галогеналканы имеют сладковатый запах. Галогенпроизводные ароматического ряда представляют собой тяжелые жидкости или кристаллические вещества. Галогенопроизводные с галогеном, непосредственно связанным с ароматическим ядром, обладают слабым запахом, а −с галогеном в боковой углеводородной цепи имеют запах, раздражающий слизистые оболочки и вызывающий слезотечение. Галогенуглеводороды с одним или двумя атомами галогена (хлора и брома) горят характерным пламенем с зеленой каймой; трех- и четырехгалогенопроизводные метана (CHCl3, CCl4) негорючи. Все галогенуглеводороды ядовиты.
В УФ-области галогенуглеводороды имеют очень слабые полосы поглощения ( < 300) в следующих диапазонах: хлорпроизводные – 172 нм, бром-производные – 204 нм, иодпроизводные – 257 нм. В области ИКпоглощения валентные колебания групп С – F, C – Cl, C – Br, C – I расположены соответственно в диапазонах 1400 1000 см-1, 800 600 см-1, 600 500 см-1, ~ 500 см-1 [6]. Для насыщенных молекул положение ПМР-сигнала коррелирует с электроотрицательностью атома, с которым связан данный углеводородный радикал, например, для метилгалогенидов наблюдается следующая зависимость [5]:
|
CH3F |
CH3Cl CH3Br CH3I |
CH3H |
||
(CH3), м.д. |
4.13 |
2.84 |
2.45 |
1.98 |
0.13 |
Е (по Полингу) |
4.0 |
3.0 |
2.8 |
2.6 |
2.1 |
Влияние электроотрицательных групп на величину химического сдвига быстро убывает по мере удаления их в углеводородной цепи от ис-
121

следуемого протона, и на расстоянии, большем, чем две насыщенные угле- род-углеродные связи, оно практически не обнаруживается.
Химические свойства. В молекулах галогенуглеводородов можно выделить 4 реакционных центра, которые формируют важнейшие химические свойства данного класса органических соединений:
+
э.ц.H
C
− |
+ |
− |
|
где X −F, Cl, Br, I |
||
|
С |
|
X |
, |
||
.. |
|
|||||
|
э.ц. .. |
|
|
|||
н.ц. |
|
|
||||
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
||
Нуклеофильные свойства углерода С - (α-углерода) и электрофильные свойства водорода Н + (при -углеродном атоме) выражены очень сла-
бо, но электрофильные свойства α-углерода выражены очень сильно (главное химическое свойство) и реагируют со всеми нуклеофильными реагентами, образуя любые классы органических соединений.
Из-за сравнительно высокой электроотрицательности галогенов (нуклеофильный центр Х−) их нуклеофильная активность занимает про-
межуточное положение.
Жесткость акцепторных атомов галогенуглеводородов зависит как от характера углеводородного радикала, так и от природы галогенов. Так, например, CH3I является мягким электрофилом, а (CH3)3CCl – промежуточным. Поэтому в реакциях нитрит-иона с алкилгалогенидами имеет место конкуренция нуклеофильных центров. В случае метилиодида происхо-
дит N-алкилирование, а в случае трет-бутилхлорида – О-алкилирование (см. 2.5 «Принцип ЖМКО»).
Галогенуглеводороды являются очень удобными объектами реакций, для которых характерны различные типы конкуренций нуклеофильных
центров (см. 2.5 «ЖМКО»). Их можно проследить в реакциях галогенуглеводородов с цианидами и нитритами натрия и серебра.
1. Нуклеофильные свойства галогена Х− – реакции с электрофилами:
а) кислородными (окисление) − образование иодозобензола:
C H I |
+ CH COOH |
C H I |
|
O + CH COOH |
||
|
||||||
|
||||||
6 5.. |
3 |
|
. |
6 5 |
3 |
|
|
O |
|
|
|
||
б) галогенными (хлорирование) – образование дихлориодбензола:
|
|
|
|
Cl |
C H I + Cl |
Cl |
C H |
|
I |
|
||||
6 5.. |
.. |
6 5 |
Cl |
|
|
|
|
|
|
в) углеродными (солеобразование) – образование солей иодония, бромония и хлорония:
122
[C6H5N N]+BF4− t > 50 C C6H5+ + N2 + BF4− C6H5X.. + C6H5+  [C6H5XC6H5]+ ,
[C6H5XC6H5]+ ,
где X − Cl, Br, I
2. Электрофильные свойства углерода C + – реакции с нуклеофилами:
а) водородными −реакции с боргидридом натрия и триэтилсиланом:
− |
CH I +NaBH |
CH |
+ NaI + BH |
|
|
3 |
.. 4 |
4 |
3 |
− |
RCl |
+ HSi(C2H5)3 |
|
RH + ClSi(C2H5)3 |
|
|
.. |
|
|
б) кислородными:
− гидролиз; первичные и вторичные галогенуглеводороды гидролизуются по SN2-механизму, а третичные – по SN1-механизму
CH Cl + H |
|
OH |
NaOH |
||||
|
−HCl |
||||||
3 |
.. |
||||||
H C |
|
CHCl + 2 H |
|
OH |
|||
|
|
||||||
3 |
2 |
.. |
|||||
CH3OH |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
NaOH |
|
|
|
|
O |
|
|
|
|||||
|
H3C CH |
H3C |
|
C +Н2О |
||
−2HCl |
|
|
||||
|
OH |
|
|
|
H |
|
|
|
|
|
|
||
|
|
|
||||
H C |
|
CCl |
|
CH |
+ 2 H |
|
OH |
|
|
|
|||||
3 |
2 |
3 |
.. |
||||
NaOH |
|
|
OH |
|
|
|
O |
|
|||||
|
|
|
|
||||||||||
|
H3C C |
|
CH3 |
|
|
|
|
|
|
|
+ H O |
||
|
|
H C |
|
C |
|
CH |
|||||||
−2HCl |
|
|
|
|
|||||||||
|
|
|
|
||||||||||
|
|
OH |
|
3 |
3 |
2 |
|||||||
|
|
|
|
|
|
O |
|
||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
CCl3 |
|
|
C(OH)3 |
C |
OH |
|
+ 3H OH |
NaOH |
|
|||
|
− H2O |
|
||||
|
|
.. |
−3HCl |
|
||
(CH ) CCl + H OH |
NaOH |
(CH ) COH + HCl |
|
|
||
3 3 |
.. |
−HCl |
|
3 3 |
|
|
− алкоксилирование и феноксилирование (реакция Вильямсона). Реакция первичных галогенуглеводородов с алкоголятами или фенолятами щелочных металлов в полярных растворителях (метиловый спирт) приводит к образованию простых эфиров. В случае вторичных и третичных галогенуглеводородов в условиях реакции Вильямсона часто наблюдается
образование олефинов в результате реакции дегидрогалогенирования
R |
|
CH2 |
|
|
X |
+ NaOR' |
R |
|
CH |
|
|
O |
|
|
R' + NaX |
||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
.. |
2 |
|
|
|
|
|
|
|||||
− образование сложных эфиров карбоновых кислот |
|||||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|
C6H5CH2Cl + |
R |
|
C |
|
C6H5CH2 |
|
O |
|
|
C |
|
+ NaCl |
|||||||
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
ONa |
|
|
|
|
|
|
|
|
|
|
R |
||
в) азотными: |
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
123 |
|
|
|
|
|
|
|
|
|
|
|
− аммонолиз – расщепление химической связи под действием амми-
ака
RCH2 X + 2 NH.. 3 RCH2NH2 + NH4X
RCH2NH2 + NH4X
−аминирование
|
RCH |
|
|
|
Br + NaNH |
|
|
RCH NH |
+ NaBr |
||||||||||||
|
|
|
|
||||||||||||||||||
|
2 |
|
|
|
|
.. 2 |
|
|
2 |
|
2 |
|
|
|
|
||||||
|
CH Cl + |
2CH NH |
|
CH NHCH |
+ |
[CH NH ]Cl |
|||||||||||||||
3 |
|
|
|
|
|
3.. 2 |
|
|
3 |
|
3 |
|
3 3 |
||||||||
−нитрование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
RCH |
|
|
|
X + NaNO |
2 |
|
|
RCH NO |
+ NaX |
|||||||||||
|
|
|
|||||||||||||||||||
|
2 |
.. |
|
|
|
|
2 |
|
2 |
|
|
|
|||||||||
−реакция галогенуглеводородов с цианидом серебра (образование |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
изонитрила |
|
|
|
|
|
|
|
|||||
|
RCH |
|
|
X + Ag[C |
|
N]− |
|
|
RCH |
|
|
N |
|
C + AgX |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
2 |
|
|
|
|
|
.. |
|
|
|
|
2 |
|
|
|
||||||
г) галогенными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
− гидрирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
R |
|
|
X + 2HI |
|
R |
|
H + I |
|
+ HX |
|||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
.. |
|
|
2 |
|
|
|
|
|
|
|||||
д) металлическими:
− металлирование (реакция введения металла в молекулу органического соединения)
CH CH CH CH Cl |
+ 2 Na |
CH CH CH CH Na + NaCl |
|||||||||||
3 |
2 2 |
2 |
|
. |
|
|
3 |
|
2 2 2 |
|
|
|
|
|
CH3CH2Br + Mg эфир |
|
CH CH MgBr |
|
|
|
|
||||||
|
|
|
|
.. |
|
|
3 |
|
2 |
|
|
|
|
− дегалогенирование |
R |
Cl |
|
R |
|
|
|
H |
|||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
HC |
|
CH + Zn |
C |
|
C + ZnCl2 |
||||
|
|
|
|
|
|||||||||
|
|
|
Cl |
R' |
.. |
|
|
||||||
|
|
|
|
|
H |
|
|
|
R' |
||||
– алкилирование (реакция Вюрца) |
|
|
|
|
|
|
|
||||||
2 |
CH CH Cl + |
|
Na |
CH3CH2CH2CH3 + 2NaCl |
|||||||||
3 |
2 |
|
2 . |
|
|||||||||
|
|
ClCH2CH2CH2Cl |
+ |
Na |
|
H2C |
|
|
|
CH2 |
|||
|
|
|
|
|
|
||||||||
−циклизация |
|
|
|
|
|
+ 2 NaCl |
|||||||
|
2 . |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
CH2 |
||
е) серными:
− тиолирование – реакция введения тиольной группы в молекулу органического соединения
CH CH CH Br + NaHS |
CH CH CH SH + NaBr |
|
3 2 2 |
.. |
3 2 2 |
− сульфурирование – реакция введения двухвалентной серы в молеку-
2CH CH Cl + Na S |
|
CH CH |
|
S |
|
CH CH + 2 NaCl |
|
|
|
|
|||||
3 2 |
2 .. |
124 |
3 2 |
2 3 |
|||
|
|
|
|
|
|
|
|
лу органического соединения |
|
|
|
|
|
|
|
|
|
||
− сульфирование |
|
|
NaO |
|
|
O |
|||||
|
|
|
|
|
|
|
|||||
|
|
CH3I + S |
|
|
|
|
|
|
|
OH + NaI |
|
|
|
O |
CH3 |
|
S |
|
|||||
|
|
|
|
||||||||
|
|
|
HO .. |
|
|
|
|
|
|
|
|
ж) углеродными: |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
−арилирование (реакция Фриделя-Крафтса) |
|||||||||||
CH3CH2Cl + |
AlCl3 |
|
+ HCl |
||||||||
.. |
|
|
|||||||||
|
|
|
|
CH2CH3 |
|||||||
|
|
|
|
|
|||||||
− арилирование |
|
|
|
|
|
|
|
|
|
|
|
(C6H5)3CCl |
+ (C6H5)2Hg |
|
(C6H5)4C + C6H5HgCl |
||||||||
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
− алкилирование |
|
|
|
|
|
|
|
|
|
|
|
CH3CH2Cl + CH3CH2CH2CH.. 2Li  CH3CH2CH2CH2CH2CH3 + LiCl
CH3CH2CH2CH2CH2CH3 + LiCl
CH3CH2Br + CH3CH.. 2MgBr  CH3CH2CH2CH3 + MgBr2
CH3CH2CH2CH3 + MgBr2
CH CH Cl + Zn(CH ) |
CH CH CH |
|
+ CH ZnCl |
|||||||||||
3 2 |
.. |
3 2 |
3 2 |
3 |
3 |
|||||||||
R |
|
CH2 |
|
X + K[C |
|
N]− |
R |
|
CH2 |
|
C |
|
N + KX |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|||||||||||
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
з) фосфорными:
−фосфинирование − реакция введения фосфиногруппы в молекулу органического соединения
Cl |
|
PH2 |
+ NaPH |
+ NaCl |
|
.. |
2 |
|
– фосфорилирование − реакция введения фосфорильной группы в молекулу органического соединения реакция Арбузова
|
|
|
|
|
|
O |
||
CH CH Cl + |
P(OCH ) |
H3C |
|
CH2 P |
|
OCH3 + CH3Cl |
||
|
|
|||||||
3 |
2 |
.. |
3 3 |
|
|
|
|
|
|
|
|
|
|
OCH3 |
|||
|
|
|
|
|
|
|||
реакция Михоэлиса-Беккера
|
|
|
|
OCH3 |
|
|
|
O |
|
|
CH CH Cl + NaO |
|
P |
CH CH |
P |
|
OCH |
+ NaCl |
|||
|
|
|
||||||||
|
3 |
2 |
.. OCH3 |
3 |
2 |
3 |
||||
|
|
|
|
|
|
OCH3 |
|
|||
|
|
|
|
|
125 |
|
|
|
|
|
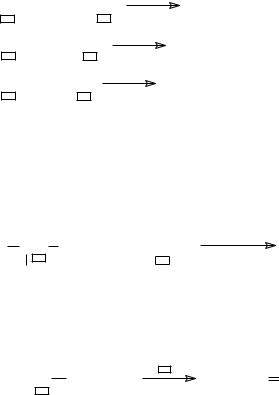
3.Нуклеофильные свойства углерода (α-углеродного атома)
–реакция с электрофилом:
CH |
|
Cl + Cl |
|
h |
CH Cl |
+ HCl |
|||
|
|
|
|||||||
.. 3 |
|
|
2 |
|
|
|
2 |
2 |
|
CH Cl |
+ Cl |
h |
|
CHCl |
+ |
HCl |
|||
|
|
||||||||
.. 2 |
2 |
2 |
|
|
|
3 |
|
|
|
CHCl |
+ Cl |
h |
|
CCl |
+ |
HCl |
|||
|
|
||||||||
.. |
3 |
2 |
|
|
4 |
|
|
||
4. Электрофильные свойства водорода H + (при - углеродном атоме) − реакции с нуклеофилами:
а) дегидрогалогенирование первичных галогенуглеводородов спиртовой щелочью (Е2-механизм, см. 2.3. «Механизмы органических реак-
ций»):
H3C CH CH2Br + NaOH
..
CH3
спиртовой |
H3C |
|
C |
|
CH2 |
|
−HBr |
|
|
||||
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
CH3 |
|||
б) дегидрогалогенирование третичных галогенуглеводородов (Е1механизм (см 2.3. «Механизмы органических реакций»):
RONa
..
(CH3)2CH (CH3)2Br −HBr (CH3)2C C(CH3)2
Практическое значение. Многие галогенпроизводные используются в качестве реагентов в синтезе других веществ (например, хлоропрен при синтезе каучука). Наряду с этим они применяются в медицине как наркотические, анестезирующие и дезинфицирующие препараты (хлороформ, хлорэтан, иодоформ). В сельском хозяйстве приоритетной областью применения галогенуглеводородов является использование их в качестве пестицидов (гексахлоран, ДДТ, хлорофос, 2,4-Д, 2,4,5-Т и др.). Хлорэтан – сырье для получения тетераэтилсвинца. Полигалогеналканы (CH2Cl2, CHCl3, CCl4, ClCH2CH2Cl) – негорючие растворители. Четыреххлористый углерод применяется для тушения пожаров, особенно при тушении горящего бензина и нефти: тяжелые пары его изолируют горящий бензин от кислорода. Полифторхлоруглеводороды (фреоны − СCl2F2) – хладагенты в холодильных агрегатах. Непредельные галогенуглеводороды (СH2=CHCl) –
сырье для производства пластмасс, изоляционных материалов, искусственной кожи, пленочных материалов технического и бытового назначения. Гексабромэтан используется в качестве антипиренов.
126

3.8. Спирты и фенолы
Спирты и фенолы – классы органических соединений, содержащих
функциональную гидроксильную группу C OH. . Спирты представ-
ляют собой соединения, в которых гидроксильная группа (или гидроксил) соединена с алкильным или циклоалкильным радикалом, и выражаются
общей формулой: |
Alk OH, где Alk CH3, C2H5, C3H7 |
и т.д. |
|
Примером спирта с алициклическим радикалом может служить циклогексанол: H2C CH2
H2C CHOH
H2C CH2
В фенолах гидроксил связан непосредственно с ароматическим кольцом
OH |
OH |
фенол |
−нафтол |
(карболовая кислота) |
|
Классификация. По количеству гидроксильных групп, содержащихся в |
|||||||||||||||||||||
молекуле, спирты и фенолы подразделяются на: |
|
|
|
HO |
|||||||||||||||||
а) одноатомные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
CH |
|
CH3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
CH3 |
||||
|
|
|
изопропиловый спирт |
|
|
|
крезол |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||
б) двухатомные: |
|
|
CH2 |
|
|
|
|
CH2 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||
|
|
этиленгликоль |
гидрохинон |
||||||||||||||||||
в) трехатомные: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||
|
CH2 |
|
|
CH |
|
|
|
|
CH2 |
|
HO |
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
OH |
OH |
|
OH |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
глицерин |
|
|
|
флороглюцин |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
127 |
|
|
|
|
|
|
|
||||

г) 4,5,6-атомные спирты:
|
|
|
|
CH2OH |
|
|
|
|
CH2OH |
|
|
|
|
CH2OH |
||||||||
H |
|
C |
|
OH |
H |
|
C |
|
|
OH |
H |
|
C |
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
C |
|
H |
HO |
|
|
C |
|
|
H |
HO |
|
|
C |
|
|
H |
|||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
H |
|
C |
|
|
OH |
H |
|
C |
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
CH2OH |
H |
|
C |
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
||||
эритрит |
|
|
ксилит |
|
|
сорбит |
||||||||||||||||
В зависимости от того, при каком атоме углерода находится гидроксил, спирты подразделяются на:
а) первичные: CH3CH2CH2CH2 OH
первичный бутиловый спирт
|
CH3 |
||
б) вторичные: |
CH |
|
OH |
|
|||
|
CH3CH2 |
||
|
вторичный бутиловый |
||
|
спирт |
||
|
|
|
|
CH3 |
||
в) третичные: |
H3C |
|
С |
|
OH |
|
|
|
|||||
|
|
|
|
|
||
|
|
|
CH3 |
|||
|
третичный бутиловый |
|||||
|
|
|
|
спирт |
||
Нахождение в природе. Спирты и фенолы широко распространены в живой природе: этиловый спирт вырабатывается в организме человека, а также содержится в небольших количествах в виноградном соке и молочнокислых продуктах; шестиатомный спирт – маннит входит в состав растительного сока ясеня. Простейший фенол (карболовая кислота) содержится в количестве 1% в моче лошадей. Непредельный спирт – гераниол содержится в розовом масле; алициклический спирт – ментол присутствует в мяте; в животных организмах находится алициклический спирт – холесте-
рин.
128

Методы получения
Спирты
1. Биотехнологический метод − сбраживание сахаристых веществ с использованием одноклеточных грибков:
дрожжи пивные− фермент зимаза
C6H12O6 |
|
2 CH3CH2OH + 2 CO2 |
||||
2. Гидратация алкенов: |
|
|
|
|||
CH2 |
|
CH2 + |
H2O |
H+ |
|
CH3CH2OH |
|
H3PO4 |
или |
||||
|
|
|
|
|
||
|
|
|
|
H2SO4 |
разб. |
|
3.Гидролиз галогенуглеводородов (см. 3.7. «Галогенуглеводороды»)
исложных эфиров (см. 4.1. «Липиды»).
4.Гидрирование альдегидов и кетонов:
O
H3C |
|
|
CH2 |
|
C + H2 |
|
Ni |
H3C |
|
CH2 |
|
CH2OH |
|||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
CH2CH3 + H2 |
Pt |
|
|
|
|
|
|
|
|
|
|
|||
H3C C |
|
|
|
H3C |
|
CH |
|
CH2CH3 |
|||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
||||||||||||||
OH
5. Восстановление альдегидов и кетонов магнийорганическими соединениями:
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
CH3 |
|
|
|
C |
|
+ C2H5MgBr |
|
|
эфир |
H C |
|
CH |
|
|
|
C H |
H2O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
3 |
|
|
2 |
5 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMgBr |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
CH |
|
|
C2H5 + Mg(OH)Br |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфир |
|
|
|
|
|
|
|
CH3 |
|
H2O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H3C |
|
C |
|
CH3 + C2H5MgBr |
|
H3C |
|
C |
|
C2H5 |
||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OMgBr |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
H3C |
|
|
C |
|
|
C2H5 + Mg(OH)Br |
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Фенолы
1. Сплавление натриевых солей арилсульфокислот с щелочами (кау-
стическая сода): |
SO3Na |
OH |
|
+ NaOH |
+ Na2SO3 |
|
129 |
|
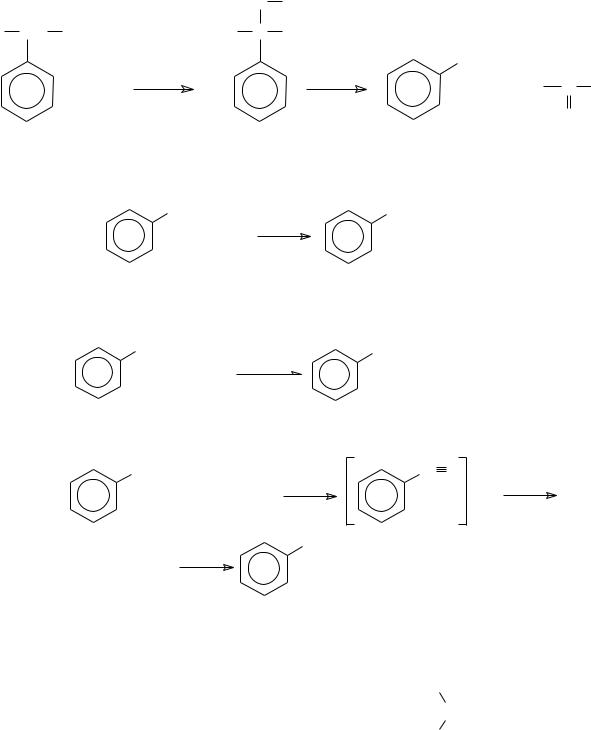
2. Окисление кумола с последующим разложением его гидроперок-
сида: |
O OH |
|
|
H3C CH CH3 |
H3C C CH3 |
|
OH |
t 0 |
H+ |
+ O2 |
+ CH3 C CH3 |
|
O |
3. Гидролиз хлорбензола:
Cl
+ HOH
|
OH |
NaOH |
+ HCl |
Cu, 2500 C |
фенол
4. Окислительное декарбоксилирование:
COOH |
OH |
|
|
H O, Cu 2+ |
|
|
|
2 |
+ CO2 |
|
|
+ O2 |
|
|
|
5. Реакция ароматических аминов с азотистой кислотой: |
|
|
|
NH |
N N + |
|
|
2 |
− H2O |
||
|
|||
+ NaNO2 + HCl −NaCl |
Cl |
>50 |
C |
|
|||
OH
+ N2 + HCl
+ HCl
Изомерия спиртов зависит от изомерии углеводородной цепи и положения гидроксила.
1. Структурная изомерия скелета углеводородной цепи:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|||
|
CH3 |
|
|
CH2 |
|
|
CH2 |
|
|
CH2 |
|
OH |
|
|
CH |
|
|
CH2 |
|
|
OH |
|||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|||
|
|
|
|
н. бутиловый спирт |
|
изобутиловый спирт |
||||||||||||||||||||||
2. Структурная изомерия положения гидроксильной группы: |
|
|
|
|||||||||||||||||||||||||
CH3 |
|
CH2 |
|
|
CH2 |
|
|
CH2 |
|
|
OH |
CH3 |
|
CH2 |
|
|
|
CH |
|
|
CH3 |
|||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|||
|
|
|
бутанол-1 |
|
|
|
|
|
|
|
бутанол -2 |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
130 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
