
796
.pdf
шение летучести, увеличение вязкости и, следовательно, повышение температуры кипения и плавления. Различают два вида водородной связи:
1. Межмолекулярная водородная связь (ММВС):
.. |
+ .. C2H5 |
|
||||||
C2H5 |
|
O |
.. H...O |
+ |
− ассоциат этанола, tкип. =780С |
|||
|
||||||||
|
|
H...O |
H |
|
||||
|
|
+ |
C2H5 |
|
|
|||
|
|
C2H5 |
|
O |
|
C2H5 |
− диэтиловый эфир, водородная |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
связь отсутствует, t кип. = 360С |
2. Внутримолекулярная водородная связь (ВМВС), образование ко-
торой обусловлено структурой самой молекулы. Она более прочная и подавляет возможные ММВС; это проявляется в изменении химических и физических свойств вещества: возрастает способность к ионизации, лету-
честь и т.д.: |
|
|
|||
|
|
− |
+ |
|
|
|
|
O |
|
||
|
|
|
|
H |
- |
|
|
|
|
||
|
|
|
|
. |
− о оксибензойная кислота |
|
|
|
|
|
|
|
|
C |
O |
t кип. = 2110 C ( 2.67кПа) |
|
|
|
||||
|
|
|
t пл. = 1590 C , Ка= 1.1 . 10-3 |
||
|
|
|
|
|
|
|
|
OH |
|
||
Чрезвычайно важна роль водородных связей в биохимических процессах. Благодаря им фиксируются вторичные и третичные структуры белков, образуются связи в двойных спиралях ДНК и т.д. Решающая роль ВС часто объясняет малые энергии, необходимые для многих биохимических превращений.
Ионная связь – предельный случай поляризации ковалентной полярной связи − осуществляется за счет взаимодействия сильно различающихся по электроотрицательности атомов благодаря электростатическому притяжению:
CH3COO Na  [CH3COO−][Na+]
[CH3COO−][Na+]
ОЭЭ |
3. 5 |
0.93 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
SO2 |
|
O |
|
Na |
|
|
|
SO2 |
|
O− |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Na+ |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОЭЭ |
3. 5 |
0.93 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
Резкой границы между ионной и ковалентной связями не существует.
31
1.3. Электронные эффекты в органической химии
Атомы в молекулах органических соединений оказывают взаимное электронное влияние друг на друга, в результате которого происходит смещение и перераспределение электронной плотности в молекуле. Эти явления получили название электронных эффектов. Существуют два важней-
ших электронных эффекта - индуктивный и мезомерный.
Индуктивный эффект (I) - это смещение электронной плотности по системе -связей от менее электроотрицательного атома или группы атомов к более электроотрицательному.
Индуктивный эффект может быть отрицательным (− I-эффект), если атомы или группы атомов являются электроноакцепторами, притягивающими к себе электронную плотность от другой части молекулы. К ним относятся:
|
|
+ |
− |
|
|
|
|
|
|
|
|
C |
|
X , где X |
|
F, Cl, Br, I, CN, NO2, OH, CH |
|
CH2, C6H5, C |
|
O, |
|||
|
|
|
|
||||||||
|
|
|
|
||||||||
|
|
|
O |
|
O |
O |
O |
||||
|
|
|
C , C , C , C , NH2 и др. |
||||||||
|
|
|
H |
|
R |
OH |
OR |
||||
Индуктивный эффект может быть положительным (+I – эффект), если атомы или группы атомов являются электронодонорами, отдающими свою электронную плотность другой части молекулы. К ним можно отнести:
|
− |
+ |
|||
C |
X , где X |
|
Alk(CH3, C2H5, C3H7 и др.), металлы (Li, Na, Mg и др.) и |
||
|
|||||
|
|
||||
|
|
|
|
|
|
неметаллы с меньшей электроотрицательностью, чем у атома углерода
(PH2, AsH2 и др.).
I-эффект передается по цепи -связей и быстро ослабляется при удалении от заместителя, вызвавшего этот эффект:
+ |
'+ |
− |
|
|
|
" |
' |
|
|
||
СH3 |
CH2 |
Cl |
+ |
+ |
|
|
> " |
Влияние индуктивного эффекта можно наглядно продемонстриро-
вать на примере электролитической диссоциации замещенных уксусных
кислот: |
|
O |
|
|
|
|
|
|
|
|
O |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
X |
|
CH2 |
|
C |
|
|
|
|
X |
|
CH2 |
|
C |
+ H+ , где |
||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
O− |
|
||
|
X |
|
|
NO2, |
F, |
Cl, |
|
Br, |
|
I, |
H, |
CH3 |
||||||
|
|
|
|
|||||||||||||||
pKa= 1.68 |
2 .66 |
2.85 |
2.86 |
3.12 |
4 .76 |
4.87 |
||||||||||||
Чем меньше pKa , тем сильнее кислота.
32
Заместители, проявляющие −I−эффект, оттягивают на себя электронную плотность и усиливают диссоциацию кислоты, а заместители, проявляющие +I−эффект, подавая электронную плотность к карбоксильной группе, тем самым ослабляют диссоциацию кислоты. По мере удаления заместителя от карбоксильной группы влияние его на диссоциацию кислоты ослабевает, и сила кислоты уменьшается:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
|||
CH3 |
|
CH2 |
|
|
|
|
|
CH |
|
|
C |
CH3 |
|
|
CH |
|
CH2 |
|
C |
|
Cl |
|
CH2 |
|
CH2 |
|
CH2 |
|
C |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
Cl |
|
|
OH |
|
|
Cl |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
OH |
||||||||
pK a = |
2.84 |
|
|
|
|
|
4.06 |
|
|
|
|
|
|
|
|
|
|
4.52 |
|
|
|
|
||||||||||||||
|
|
Увеличение количества заместителей вызывает усиление влияния |
||||||||||||||||||||||||||||||||||
индуктивного эффекта: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pKa |
|
|
|
|
|
|
|
|
|
|
|
|
pKa |
|||||||
|
Cl |
|
CH2 |
|
|
COOH |
2.86 |
|
|
|
|
H |
|
|
COOH |
3.75 |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
Сl2CH |
|
COOH |
1. 29 |
|
|
|
|
CH |
|
|
|
COOH |
4. 76 |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Cl3С |
|
COOH |
0.89 |
|
|
(CH3)3C |
|
|
COOH |
5.05 |
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
Чем больше заместителей с -I−эффектом, тем сильнее кислота. Чем больше заместителей с +I−эффектом, тем слабее кислота.
Индуктивный эффект оказывает влияние на реакционную способность органических соединений. Спирты не реагируют с растворами щелочей, а фенолы образуют феноляты
|
|
+ |
|
|
+ I - эффект CH3 |
O |
H |
+ NaOH |
|
− I - эффект |
|
+ |
|
ONa + H O |
O |
H |
+ NaOH |
||
|
|
|
|
2 |
+I–эффектом алкильного радикала объясняется правило Марковникова в ряду непредельных углеводородов (алкены, алкины): в реакциях протоноподвижных соединений с несимметричными непредельными углеводородами водород присоединяется к наиболее гидрированному атому, а остаток − к наименее гидрированному атому кратной связи:
+ |
|
− |
+ |
− |
|
|
|
|
|
|
H3C CH |
|
CH2 |
+ H |
Cl |
H3C |
|
|
CH |
|
CH3 |
|
|
|
||||||||
|
|
|
|
|||||||
|
|
|
|
|
|
|
Cl |
|||
33
Впервые русский химик В.В. Марковников установил, что в ряду алканов легкость замещения водородных атомов падает:
|
|
CH |
|
> |
|
CH2 |
|
|
> |
|
CH3 |
(правило Марковникова), |
||||||||
|
|
|
|
|
|
|
||||||||||||||
что связано +I-эффектом алкильных радикалов: |
||||||||||||||||||||
|
|
− |
|
|
|
|
|
+ |
− |
h |
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H3C CH |
CH2 |
CH3 |
+ Cl |
Cl |
|
H3C |
|
C |
|
CH2 |
|
CH3 + HCl |
||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
||||||||||||||||
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
Cl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Любые соединения, содержащие карбонильную группу (альдегиды, кетоны, карбоновые кислоты и их производные – ангидриды, галогенангидриды, сложные эфиры, амиды и др.), обладают электрофильными свойствами. Причиной этого является поляризация оксогруппы и появление электрофильного центра на атоме углерода. Примерами таких реакций являются реакции нуклеофильного присоединения к альдегидам и кетонам и реакции нуклеофильного замещения в карбоновых кислотах и их производных:
|
|
|
|
|
− |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
||||||
|
|
|
+ |
O |
|
+ |
|
− |
|
|
|
|
|
|||||||||||
|
|
|
|
|
NaOH |
|
|
|
|
|
|
|
|
|
|
|
||||||||
H3C |
|
C |
+ H |
|
C |
|
N |
H3C |
|
C |
|
|
C |
|
N |
|||||||||
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
||
|
+ O |
|
+ − |
|
H+ |
|
|
|
O |
|
|
|
|
|||||||||||
|
|
|
|
|
|
+ H |
|
OH |
|
|
|
|
|
+ |
C2H5OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
H3C C |
− |
|
|
H3C C |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
OC2H5 |
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
||||||
Мезомерный эффект (эффект сопряжения) характерен для соединений, содержащих сопряженную систему: двойные связи чередуются с одинарными связями. К сопряженным системам относятся:
|
H2C |
|
CH |
|
CH |
|
CH2 |
H2C |
|
C |
|
CH |
|
CH2 ( |
|
CH |
|
CH |
|
)n и др. |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|||||
бензол |
бутадиен- 1,3 |
|
изопрен |
полиены |
|||||||||||||||||
Иногда двойные связи в сопряженных системах могут быть заменены атомами с неподеленной электронной парой (N, O, S и др.). Примерами таких сопряженных систем являются:
пятичленные гетероциклы |
.. |
, где X |
|
N, O, S |
|||||||||||
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.. X |
|
|
|
хлорвинил |
H C |
|
|
|
CH |
|
Cl |
|
|
|
|||||
|
|
|
|
|
|
|
|||||||||
ацетамид |
2 .. |
|
|
|
и др. |
||||||||||
O |
|
C |
|
|
NH2 |
|
|||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
CH3 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
34 |
|
|
|
|
|
|
|
Под мезомерным эффектом или эффектом сопряжения понимают перераспределение (делокализацию) -электронной плотности, в результате чего происходит образование единой электронной системы. Двойные и одинарные связи в молекуле исчезают и появляются полуторные как по длине, так и по энергии (табл. 1.4).
|
|
|
|
|
|
Таблица 1.4 |
|
|
|
Характеристика химической связи |
|
||
Соединение |
|
Длина связи, нм |
|
Энергия связи, |
||
|
|
|
|
|
|
кДж/моль [1] |
H3С − СH3 |
|
0.154 |
|
339 |
||
H2С = CH2 |
|
0.134 |
|
611 |
||
|
|
|
|
0.139 |
|
459 |
|
|
|
|
|
||
|
|
|
|
|
|
|
Мезомерный эффект обусловливает особые химические свойства сопряженных систем. Так, например, для диеновых углеводородов наряду с 1,2-присоединением характерно 1,4−присоединение:
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
CH |
|
|
CH |
|
CH2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
H2C |
|
CH |
|
CH |
|
CH2 + Cl2 |
|
Cl |
|
|
Cl |
|||||||||||||||
|
|
|
|
|
1, 2-присоединение |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
Cl |
|
|
CH2 |
|
CH |
|
CH |
|
CH2 |
|
Cl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
1, 4-присоединение |
|||||||||||||||||
Мезомерный эффект обусловливает особые химические свойства аренов, называемые ароматичностью. Сущность ароматичности заключается в том, что арены, имея непредельный состав, более склонны к реакциям замещения (галогенирование, нитрование, сульфирование, алкилирование и т.д.):
+ Cl2 |
AlCl3 |
+ |
HCl |
|
|||
|
|
|
 Cl
Cl
Эффект сопряжения проявляется не только в реакциях замещения, но и в реакциях присоединения. В реакциях присоединения участвуют не одна или две, а три двойных связи одновременно (гидрирование и галогенирование):
35
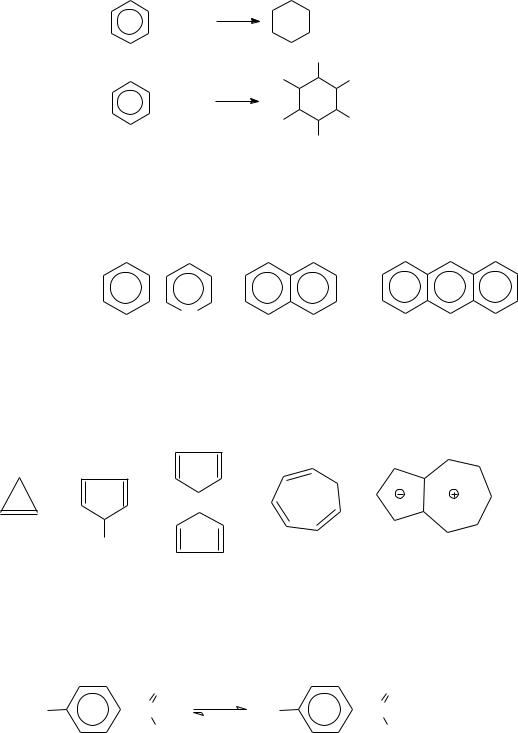
Ni
+ 3H2
|
Cl |
Cl |
Cl |
h |
|
+ 3Cl2 |
|
Cl |
Cl |
|
Cl |
Установлено, что ароматическими свойствами обладает не только бензол и его производные, но и любые плоские циклические системы, содержащие в системе сопряжения (4n + 2) −электронов правило Хюкке-
ля:
|
n = 1 |
n = 2 |
n = 3 |
число |
|
N |
|
|
|
|
|
- электронов 4 n + 2 = |
6 |
10 |
14 |
число -связей |
3 |
5 |
7 |
К небензоидным ароматическим системам относятся циклопропенилкатион, циклопентадиенильный анион, ферроцен, катион тропилия, азулен:
n=0 |
n=1 |
n=2 |
n=1 |
n=2 |
+ |
|
- |
+ |
|
|
Fe+2 |
|
||
|
- |
|
|
|
|
- |
|
|
|
циклопропе- |
|
|
|
|
|
|
|
|
|
нил-катион |
H |
|
катион |
азулен |
циклопента- |
|
тропилия |
||
ферроцен |
|
|||
диенильный |
|
|||
|
|
|
||
анион
Смещение -электронной плотности в сопряженной системе можно показать на примере электролитической диссоциации паразамещенной бензойной кислоты (в водном растворе):
|
|
|
|
O |
|
|
|
|
|
O |
Z |
|
|
C |
|
|
Z |
|
|
C + H+ |
|
|
|
|
|
|||||||
|
|
|
|
|||||||
|
|
|
|
OH |
|
|
|
|
|
O− |
Z − NH2, OH, OCH3, CH3, |
H, |
Cl, |
CN, COOH, NO2 |
|||||||
pKa = 4.85 4.58 4.49 |
4.36 |
4.19 |
3.99 |
3.55 3.54 |
3.44. |
|||||
Таким образом, мезомерные эффекты заместителей бензольного ядра подразделяются на две группы:
а) мезомерный эффект может быть положительным (+М-эффект или С+ эффект), если атомы или группы атомов подают электронную плот-
ность бензольному кольцу (−OH, −OR, −NH2,−NHR, −NR2,−CH3,−CH2CH3,
галогены и др.) и этим понижают электролитическую диссоциацию. Ис-
36

ключение составляют галогены. У галогенов, например, у хлора –I-эффект сильнее выражен, чем +М-эффект. По этой причине хлор в бензольном кольце повышает кислотность;
б) мезомерный эффект может быть отрицательный (−М-эффект или −С- эффект) если атом или группы атомов (−NO2, −COH, −C(O)R, −C N,
− CCl3 и т.д.) оттягивают электронную плотность от бензольного кольца и повышают кислотную диссоциацию.
С мезомерным эффектом связано правило ориентации. Бензольное кольцо представляет собой плоский равносторонний шестиугольник. Первый заместитель может занять любое из шести положений. Второй заместитель не может занять любое из пяти оставшихся положений, поскольку первый заместитель ориентирует (направляет) второй заместитель в определенное относительно себя положение:
Z
орто  орто
орто
мета 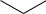 мета пара
мета пара
Закономерность влияния первого заместителя (Z) относительно второго известна в органической химии как правило ориентации. По ориентирующему влиянию все заместители делятся на ориентанты I и II рода.
К ориентантам I рода относят электронодонорные заместители:
алкилы (−CH3,C2H5, ), −NH2, −NHAlk, −NAlk2,−OH,−OAlk, галогены (Cl, Br, I, F), −SH, −SR, которые направляют электрофильные реагенты в орто- и пара-положения (с повышенной электронной плотностью), но пока неизвестны реакции с нуклеофильными реагентами в мета-положении (с пониженной электронной плотностью).
|
OH |
|
|
OH |
|
|
|
− |
− |
+ |
|
Br |
|
Br |
|
|
|
− |
|
|
|
|
|
|
|
+ 3 Br |
Br |
|
|
|
+ 3HBr |
Cl − |
|
Cl |
Br |
Cl |
|
||
|
|
|
Cl |
|
|
||
|
|
AlCl3 |
|
|
|
|
|
|
+ Cl2 |
|
+ |
|
+ |
HCl |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
1, 2 |
-дихлорбензол, |
|
Cl |
|
|
|
|
незначительное |
|
|
|
||
|
|
1, 4 |
- дихлорбензол, |
||||
|
|
|
|
||||
образование |
преимущественное |
|
|
|
образование |
37 |
|
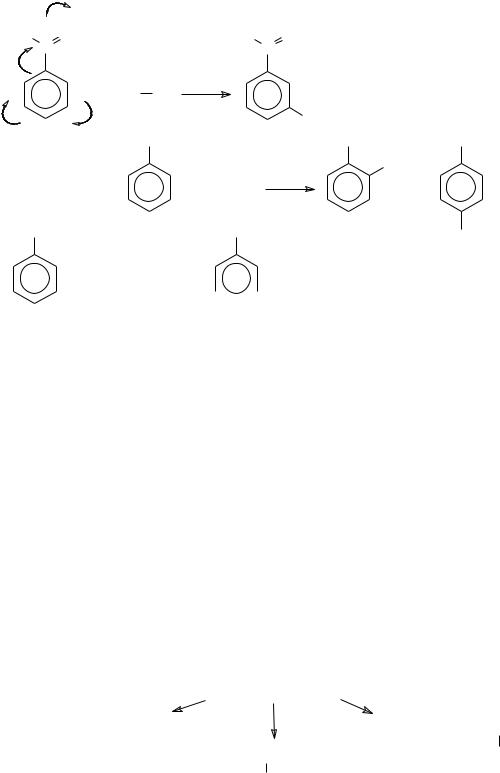
К ориентантам II рода относятся электроноакцепторные замести-
тели (-SO3H, -NO2,-CHO, -COR, -COOH, -COOR, -C N, -CCl3, -CF3, -NH3+, NR3+ др.) Они ориентируют электрофильные реагенты в мета-положение (с повышенной электронной плотностью), а нуклеофильные в орто- и па- ра-положения (с пониженной электронной плотностью):
|
+ |
− |
|
|
|
|
|
|
H |
O |
|
|
H |
C |
O |
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
+ |
− |
|
|
|
|
+ |
|
+ |
AlBr3 |
|
+ HBr |
|
||
|
|
|
+ Br |
Br |
|
|
||
− |
|
− |
|
|
|
|||
|
|
|
|
|
Br |
|
||
|
+ |
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
NO2 |
NO2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
+ 2NaOH |
|
|
+ |
NO2 |
|
|
|
NO2 |
|
|
OH |
|
+ HONO2 
 NO2
NO2
мета - динитробензол
1.4. Типы изомерии органических соединений
Для органических соединений характерно явление изомерии. Изомерия – это явление существования двух и более веществ с одинаковым качественным и количественным составом, но отличающихся друг от друга химическим строением, а, следовательно, физическими, химическими и биологическими свойствами. В современной органической химии разли-
чают структурную, пространственную изомерии и таутомерию.
1.4.1. Структурная изомерия
Структурная изомерия обусловлена различным порядком расположения атомов в молекуле. По своему характеру она подразделяется на 3 подтипа:
а) структурная изомерия скелета, которую можно представить на примере пентана:
|
|
|
|
|
|
|
|
|
|
С5Н12 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||
CH3 |
|
CH2 |
|
CH2 |
|
CH2 |
|
CH3 |
CH3 |
|
|
CH CH2 |
|
CH3 |
CH3 |
|
C |
|
CH3 |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
н.пентан, tкип. 36.10 C |
|
|
СH3 |
|
|
CH3 |
||||||||||||||
изопентан, t кип. 27.85. 0 C |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
неопентан, tкип. 9.50 C |
|||||||||||
|
|
|
|
|
|
|
|
|
38 |
|
|
|
|
|
|
|
|
|
||

б) структурная изомерия положения функциональной группы, при-
мером которой могут послужить пропиловые спирты:
|
|
|
|
|
|
|
|
|
|
C3H7OH |
|
|
|
|
|
|
|||
CH3 |
|
CH2 |
|
|
CH2 |
|
OH |
|
H3C |
|
|
CH |
|
CH3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
||
пропанол − |
1 |
, tкип. |
97. 2 |
0 |
C |
пропанол − |
2 , |
t |
82 2. |
0 |
C |
||||||||
|
|
|
.кип. |
|
|||||||||||||||
Эти изомеры отличаются не только физическими, но и химическими свойствами. При окислении пропанола-1 образуется альдегид, а пропанола-2 − кетон:
|
|
|
|
|
|
|
|
|
|
|
|
t 0 |
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
CH3 + CuO |
|
|
|
|
|
|
|
|||
H3C |
|
CH2 |
|
|
|
CH2 |
|
H3C |
|
|
CH2 |
|
C + H2O + Cu |
||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
t 0 |
|
|
|
|
|
|
|
||
|
H3C |
|
|
|
CH |
|
CH3 + CuO |
H3C |
|
|
C |
|
CH3 + H2O + Cu |
||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
OH |
|
|
|
O |
||||||||||||
в) валентная изомерия, при которой изомеры можно перевести друг в друга за счет перераспределения связей. Примером могут служить валентные изомеры бензола:
бензол |
бензол |
бензол |
бензвален |
|
''Дьюара'' |
Ладенбурга |
|
|
|
(призман) |
|
Валентная изомерия обусловлена изменением геометрии молекулы – длин химической связей и валентных углов.
1.4.2. Пространственная (конфигурационная) изомерия
Пространственная изомерия обусловлена различным расположением атомов в пространстве, различной ориентацией атомов в молекуле. Пространственная изомерия подразделяется на 3 подтипа.
1. Геометрическая (цис-, транс-) изомерия обусловлена жесткостью двойной связи в ряду алифатических соединений или невозможностью свободного вращения вокруг С-С связи в ряду алициклических соедине-
39

ний. Геометрическую изомерию можно показать на примере бутендионовой кислоты и 1,3-диметилциклобутана:
HOOC CH CH COOH
CH COOH
HOOC |
|
COOH |
HOOC |
|
H |
||||||||
|
|
C |
|
C |
|
|
C |
|
C |
||||
|
|
||||||||||||
|
|
||||||||||||
|
H |
|
H |
|
|
H |
|
COOH |
|||||
цис-бутендионовая (малеиновая) |
транс-бутендионовая (фумаровая) |
||||||||||||
кислота, t пл.= 1300 С, ядовита, |
кислота, t пл.= 2870 С, неядовита, |
||||||||||||
растворима в воде |
нерастворима в воде |
||||||||||||
|
|
|
|
|
CH3 |
|
|
|
|
|
H |
||
|
CH3 |
|
|
CH3 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
CH3 |
||
H |
|
|
|
|
H |
|
|
|
|
||||
цис - 1,3 - диметилциклобутан |
транс - 1,3 - диметилциклобутан |
||||||||||||
Геометрические изомеры отличаются друг от друга не только физическими, но и биологическими и химическими свойствами. Малеиновая кислота при нагревании с Р2О5 образует малеиновый ангидрид, фумаровая кислота не способна к образованию ангидрида:
H C COOH H C COOH
H C COOH
|
|
|
|
|
|
|
|
O |
|
H |
|
C |
|
C |
|
||||
|
|
|
|||||||
t, P2O5 |
|
|
|
|
|
O |
+ H O |
||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
2 |
H |
|
C |
|
C |
|
||||
|
|
|
|||||||
O
малеиновый ангидрид
2. Оптическая (зеркальная) изомерия. Особенность оптической изомерии обусловлена наличием в молекуле асимметрического атома (хиральный центр), в частности, углерода С*. Атом называется асимметри-
ческим, если все его валентные связи затрачены на соединение с различными атомами или группами атомов.
Одним из примеров соединения с асимметрическим атомом углерода может служить молочная кислота (2-гидроксипропановая кислота):
|
|
|
H |
O |
|
|
||
|
|
|
|
|
|
|
|
|
Известно, что ор- |
H3C |
|
C* |
|
C |
ганические |
соединения, |
|
|
|
|||||||
|
|
|
|
OH |
||||
|
|
OH |
||||||
|
|
|
|
|
||||
|
|
|
|
|
|
40 |
|
|
