
796
.pdf
в) число частиц, принимающих участие в лимитирующей стадии процесса (указывается арабской цифрой).
Механизмы радикальных реакций. Химические процессы, протекаю-
щие с промежуточным образованием радикалов (радикальный механизм), называются радикальными реакциями. Классическими примерами радикальной реакции служат:
а) галогенирование алканов:
h
CH4 + Cl2  CH3Cl + HCl
CH3Cl + HCl
SR-механизм:
зарождение цепи |
|
Cl : Cl h |
Cl. + Cl. |
развитие цепи |
|
H3C : H + Cl. |
CH3. + HCl |
CH3. + Cl : Cl |
CH3Cl + Cl. и т.д. |
Возможен обрыв цепи при столкновении радикалов между собой.
б) нитрование алканов:
|
|
|
|
400 |
0 C |
|
|
R |
|
H |
+ |
HNO3 |
|
RNO2 |
+ H2O |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SR-механизм:
зарождение цепи
|
|
4000 C |
HO. + NO2. |
HO : NO2 |
|||
продолжение цепи |
|
||
R |
|
H + HO. |
R. + H2O |
|
|||
R. + HO : NO2 |
RNO2 + HO. и т.д. |
||
Механизмы ионных реакций. Химические реакции, протекающие с промежуточным образованием ионов (ионный механизм), называются ионными реакциями:
а) реакции нуклеофильного замещения, протекающие по SN2 и SN1-
механизмам. Этот тип замещения удобно показать на примере реакции гидролиза галогенуглеводородов SN 2-механизм характерен для первичных и вторичных галогенуглеводородов:
|
|
|
|
|
CH Cl + HOH NaOH |
|
|
CH |
|
|
OH + HCl |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
3 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SN 2 - механизм: |
|
|
|
|
|
|
|
|
||||||
|
|
H |
+ |
− |
|
|
|
H |
|
|
|
− |
|
H |
|
|
||||||
HO− + |
|
|
|
|
|
71 |
|
|
|
|
|
|
|
|
+ Cl− |
|||||||
H |
C |
|
|
|
Cl |
|
HO ... |
C |
... Cl |
|
HO |
|
C |
|
||||||||
|
H |
H |
H |
|||||||||||||||||||
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|||||
SN 1-механизм типичен для третичных галогенуглеводородов:
|
|
|
CH3 |
OH− |
CH3 |
||||||
H3C |
|
C |
|
Cl + HOH |
|
||||||
|
|
H3C |
|
C |
|
OH + Cl− |
|||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
CH3 |
||||||
SN 1 - механизм:
|
|
|
|
CH3 |
|
|
|
CH3 |
||||||||||
H3C |
|
|
C |
|
Cl |
|
H3C |
|
C + + Cl− (медленно) |
|||||||||
|
|
|
||||||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
CH3 |
|
|
CH3 |
||||||||||||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|||||
H3C |
|
|
C + + OH− |
|
H3C |
|
C |
|
OH (быстро) |
|||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
CH3 |
|
|
|
|
|
CH3 |
||||||||
В случае асимметрического галогенуглеводорода возможно вальденовское обращение конфигурации молекулы.
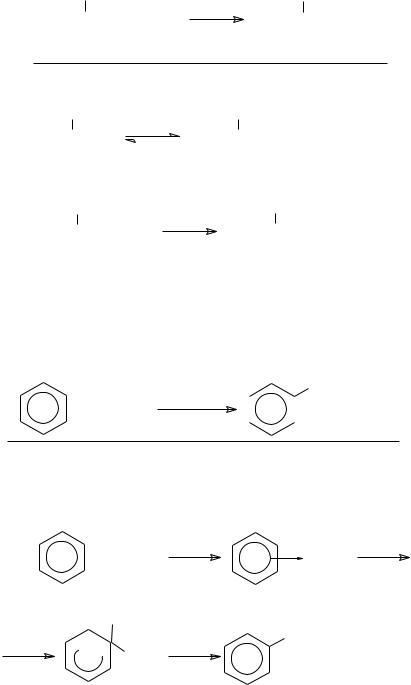
б) реакции электрофильного замещения в ароматическом ряду про-
текают по SE 2-механизму:
H2SO4 |
конц. |
|
NO2 |
|
+ H2O |
||
+ HNO3 |
|
|
SE 2- механизм:
HNO3 + 2H2SO4(конц.)  NO2+ + H3O+ + 2HSO4−
NO2+ + H3O+ + 2HSO4−
+ NO2+ |
NO2+ |
|
- комплекс |
H |
NO2 |
|
|
+ NO2 |
+ H+ |
в) ход реакции нуклеофильного присоединения синильной кислоты к альдегидному карбонилу осуществляется по AN 2-механизму:
72

|
+ O |
− |
|
|
OH |
|
|
|
|
|
|
|
|
||
R |
|
N |
NaOH |
R C C |
N |
||
C + H C |
|
||||||
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
AN 2 - механизм: |
|
|
|
||
H C N + Na+ + OH− |
|
H2O + Na+ + C N− |
|||||
|
O |
|
|
O− |
|
|
OH |
R C |
|
− |
R C C N |
H2O |
− |
||
+ C N |
|
R C C N + OH |
|||||
|
H |
|
|
H |
|
|
H |
г) реакции электрофильного присоединения по АЕ2-механизму мож-
но продемонстрировать на примере реакции бромирования алкенов:
|
|
|
+ |
− |
|
|
|
|
|
|
|
H2C |
|
CH2 + Br |
Br |
H2C |
|
CH2 |
|||||
|
|
||||||||||
|
|
||||||||||
|
|
|
|
|
Br |
Br |
|||||
|
|
|
|
|
|
+ |
− |
||||
|
|
|
|
|
−комплекс |
||||||
|
|
H2C |
|
CH2Br− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
H2C |
CH2 |
|||||||||
+ |
|
||||||||||
|
|
|
Br |
|
|
|
Br |
|
Br |
||
−комплекс
д) реакции отщепления (элиминирования) можно показать на приме-
ре дегидрогалогенирования галогенпроизводных углеводородов спиртовыми растворами щелочей. Они протекают как по мономолекулярному (Е1), так и по бимолекулярному (Е2) механизмам. В случае первичных и вторичных галогенуглеводородов реакция отщепления в большинстве случаев протекает по механизму Е2:
CH3 CH2 Br + HO- |
спиртовый |
H2O + H3C CH CH2 + Br- |
раствор |
Е2 – механизм:
|
+ |
|
|
|
|
H |
|
OH |
H |
H C |
CH |
CH + HO- |
H C |
CH CH |
3 |
|
2 |
3 |
2 |
|
|
− |
|
|
|
|
Br |
|
Br |
H2O + H3C CH CH2 + Br-
В случае третичных галогенуглеводородов элиминирование прохо-
дит по механизму Е1: |
|
|
|
|
CR + + Cl− (медленно) |
|||
R CH |
|
CR |
2 |
|
Cl |
R CH |
|
|
|
|
|
||||||
2 |
|
|
|
|
2 |
2 |
||
R2CH CR2+ R2C CR2 + H+ (быстро)
R2C CR2 + H+ (быстро)
73
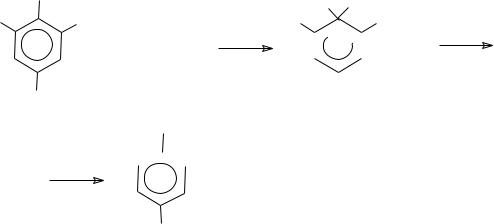
е) реакция нуклеофильного замещения в ароматическом ряду по АЕмеханизму (механизм присоединения-замещения). В бимолекулярной реак-
ции атакующий нуклеофил может образовать новую связь раньше, чем по-
рвется старая связь. В качестве промежуточного соединения образуется - комплекс, распадающийся далее на продукты реакции. Первая стадия обычно определяет скорость всей реакции. В отличие от реакции SN 2 в этом случае образование новой и разрыв старых связей происходит несинхронно. Поэтому говорят о механизме присоединения-отщепления:
|
OCH3 |
CH3O |
|
OC2H5 |
|||
O2N |
|
|
|||||
NO2 |
O2N |
|
|
|
NO2 |
||
|
+ CH3CH2OK |
|
|
− |
|
+ |
|
|
|
|
|
|
|
K |
|
|
NO2 |
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
NO2 |
|
|||
OC2H5 O2N
 NO2
NO2
+ CH3OK
NO2
комплекс Мезенгеймера
2.4. Кислотность и основность
Понятия «кислоты» и «основания» введены в химию французским химиком Лавуазье в XVIII веке. Однако общепризнанная теория кислот и оснований была разработана в XIX веке. В 1887 г. шведский химик С.Аррениус выдвинул теорию электролитической диссоциации. По Аррениусу кислоты − это электролиты, которые диссоциируют с образованием катиона водорода и аниона кислотного остатка, а основания − это электролиты, диссоциирующие на гидроксид-анион и катион металла:
HCl  H+ + Cl−
H+ + Cl−
NaOH  Na+ + OH−
Na+ + OH−
Сущность кислотно-основных процессов заключается во взаимодействии катиона водорода с гидроксид-анионом (реакция нейтрализации):
HCl + NaOH  NaCl + H2O H+ + OH-
NaCl + H2O H+ + OH-  H2O
H2O
Недостатком теории электролитической диссоциации кислот и оснований является узость сферы ее действия. Эта теория применима только для электролитов.
74
В 1923 г. датский химик И.Бренстед опубликовал протолитическую теорию кислот и оснований. Согласно этой теории кислоты – это доноры, а основания – акцепторы протонов. По Бренстеду кислотами могут быть любые соединения, содержащие водород и способные отщеплять водород в виде протона. При отщеплении протона кислоты превращаются в сопряженные основания:
Кислота  H+ + анион−(основание)
H+ + анион−(основание)
HCl  H+ + Cl−
H+ + Cl−
CH3COOH  H+ + CH3COO−
H+ + CH3COO−
CH3OH  H+ + CH3O−
H+ + CH3O−
 NH2
NH2  H+ +
H+ + 
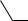 NH−
NH−
В соответствии с теорией Бренстеда основаниями могут быть любые соединения, способные акцептировать (связывать) протон. При связывании протона основания превращаются в сопряженные кислоты:
Основание + H+ |
|
|
|
|
катион+ (кислота) |
|
|||||||
|
|
|
|
||||||||||
H2O + H+ |
|
|
|
|
H3O+ |
||||||||
|
|
|
|
||||||||||
NH3 + H+ |
|
|
|
|
NH4+ |
||||||||
|
|
|
|
||||||||||
CH3OH + H+ |
|
|
|
|
|
|
(CH3OH2)+ |
||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
NH2 + H+ |
|
|
|
|
|
|
NH3 |
|
|||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, сущность кислотно-основных процессов заключается в переносе протона от кислоты к основанию:
|
|
|
|
+ |
|
NH |
+ H SO |
4 |
NH |
HSO |
− |
2 |
2 |
3 |
|
4 |
Мерой кислотности служит константа равновесия (Ka кислотности):
|
+ |
− |
|
HX |
|
H+ + X−Κ a= [H ] [X]/[HX] . |
|
|
|||
Так, для уксусной кислоты Ka = 1.76 10-5 = 10-4.7. Однако, пользоваться числами с отрицательными степенями неудобно. Поэтому вместо подлинного значения кислотности указывают его отрицательный логарифм, обозначаемый pKa = −lgKa (то есть, рКа уксусной кислоты равно 4.7). Значения pKa некоторых кислот Бренстеда приведены в табл.2.1.
75

Таблица 2.1
Значения Ка и рКа некоторых кислот
Кислоты |
Ка |
pКа |
|
|
|
HClO4 |
108 |
-8 |
HCl |
103 |
-3 |
HNO3 |
102 |
-2 |
2,4,6-(NO2)3C6H2OH |
10 |
-1 |
HCOOH |
1.7 10-4 |
3.77 |
CH3COOH |
1.76 10-5 |
4.70 |
С увеличением pKa кислотность уменьшается. Основность pKb сопряженной кислоты (например, CH3COO−) вычисляется по формуле:
pK b = pHH2O − pKa , где pHH2O = 14 (показатель ионного произведения воды)
Например, основность ацетат-иона pKb = 14− 4.7 = 9.3.
С помощью теории Бренстеда были изучены главные закономерности кислотно-основных процессов. Однако сфера действия этой теории очень узка. Она справедлива только для протонных кислот (кислоты Бренстеда).
Наиболее обобщенной теорией кислот и оснований является электронная теория Г. Льюиса (1923 г.). Согласно этой теории кислоты – ак-
цепторы электронов, а основания – доноры электронов.
К кислотам Льюиса относятся катионы и электронейтральные молекулы, способные принимать электроны на низшую свободную молекуляр-
ную орбиталь (НСМО):
H+, Ag+, Mg+2, Hg+2, AlCl3, HgSO4, SO3, HNO3(NO2+), R3C+ и др.
К основаниям Льюиса относятся анионы и электронейтральные молекулы, способные отдавать электроны с высшей занятой молекулярной орбитали (ВЗМО):
OH− Cl− Br−Ι− RO− R− RS− ROH RSH ROR, RSR, NH , RNH , и др. |
|||
.. .. .. .. .. .. .. .. .. .. |
.. |
.. 3 |
.. 2 |
Все кислоты Льюиса являются электрофильными реагентами, а основания Льюиса – нуклеофильными реагентами.
Сущность кислотно-основных процессов, согласно теории Льюиса, заключается в передаче электронной пары от нуклеофила к электрофилу, например:
(CH3)3N..  +
+ BF3
BF3  (CH3)3N+: B−F3
(CH3)3N+: B−F3
76

2.5. Принцип жесткости и мягкости кислот и оснований (ЖМКО)
В 1963 г. на международном конгрессе в Лиссабоне американский химик Дж. Пирсон выступил с докладом на тему «Принцип ЖМКО», сущность которого может быть выражена следующими основными положениями.
1. Молекулы любых веществ рассматриваются как продукты координации льюисовских кислот с льюисовскими основаниями:
H+ + H− |
H2 |
.. |
|
H+ + HO− |
H2O |
.. |
|
H+ + CH O− |
CH OH |
3 .. |
3 |
2. Льюисовские кислоты и основания подразделяются на жесткие, промежуточные и мягкие (табл. 2.2). Это деление основано на различии электроотрицательности акцепторных и донорных атомов. Жесткие кислоты и основания характеризуются высокой электроотрицательностью и низкой поляризуемостью их акцепторных и донорных центров, малыми размерами, большими положительными или отрицательными зарядами, низким значением энергий граничных орбиталей.
Мягкие кислоты и основания – это соединения, акцепторные и донорные атомы которых обладают низкой электроотрицательностью, высокой поляризуемостью, большими размерами, малыми положительными и отрицательными зарядами, высоким значением энергий граничных орбиталей.
Промежуточные кислоты и основания имеют средние значения вы-
шеуказанных параметров.
|
|
Таблица 2.2 |
|
Эмпирическая классификация кислот и оснований по Пирсону |
|||
|
|
|
|
|
Основания (доноры) |
|
|
|
|
|
|
жесткие |
мягкие |
промежуточные |
|
|
|
|
|
H2O, O−H, F−, |
R2S, RSH, RS-, |
C6H5NH2, |
|
CH3CO2−, PO3−3, SO4−2, |
I−, SCN−, S2O3−, |
C5H5N, N3−, |
|
Cl −, CO3−2, ClO4−, NO3−, |
R3P, R3As, (RO)3P, |
Br −, NO2−, SO3−2, |
|
ROHa, RO−, R2O−, |
CN−, RNC, CO, |
N2 |
|
NH3, RNH2, N2H4 |
C2H4, C6H6, |
|
|
|
H−, R− |
|
|
|
|
|
|
|
77 |
|
|

Кислоты (акцепторы)
жесткие |
мягкие |
промежуточные |
|
|
|
H+, Li+, Na+, K+, |
Сu+, Ag+, Au+, Tl+, Hg+, |
Fe+2, Co+2, Ni+2, |
Be+2, Mg+2, Ca+2, Sr+2, |
Pd+2, Cd+2, Pt+2, Hg+2, |
Cu+2, Zn+2, Pb+2, |
Mn+2, Al+3, Sc+3, Ga+3, |
CH3Hg+, Co(CN)5-2, |
Sn+2, Sb+3, |
In+3, La+3, N+3, Cl+3, |
Pt+4, Te+4, |
Be+3, Rh+3, |
Gd+3, Lu+3, |
Ti+3, Tl(CH3)3, BH3, |
Ir+3, B(CH3)3, |
Cr+3, Co+3, Fe+3, CH3Sn+3, |
Ga(CH3)3, GaCl3, GaI3, |
SO2, NO+, Ru+2, |
As+3, Si+4, Ti+4, Zr+4, |
InCl3, RS+, RSe+, Rte+, |
Os+2, R3C+, |
Th+4, |
I+, Br+, HO+, RO+, I2, Br2, ICN |
C6H5+, GaH3 |
U+4, Pu+4, Ce+4, Hf+4, |
и др., |
|
WO+4, |
тринитробензол и др., |
|
UO2+2, (CH3)2Sn+2,VO+2, |
хлоранил, хиноны и др., |
|
MoO+3, BeMe2, BF3, B(OR)3, |
тетрацианэтилен и др., |
|
Al(CH3)3, AlCl3, AlH3, |
O, Cl, Br, I, N, RO, RO2 |
|
RPO2+, ROPO2+, |
Me0 (атомы металлов), |
|
RSO2+, ROSO2+, SO3, I+7, I+5, |
тяжелые металлы, СН2, |
|
Cl+7, Cr+6, RCO+, CO2, NC+, |
карбены. |
|
HX (молекулы с |
|
|
водородной связью) |
|
|
|
|
|
3.Жесткие льюисовские кислоты реагируют преимущественно с жесткими льюисовскими основаниями (зарядно-контролируемые реакции), а мягкие льюисовские кислоты – с мягкими льюисовскими основаниями (орбитально-контролируемые реакции).
4.При сочетании жестких кислот с жесткими основаниями и мягких кислот с мягкими основаниями достигается наибольшая термодинамическая устойчивость продуктов и наивысшая скорость их образования (симбиоз). Различают жесткость относительную и абсолютную.
Относительная жесткость акцепторных и донорных атомов не имеет
размерности, однако, она тесно связана с такими функциями строения и свойствами атомов, как электроотрицательность, поляризуемость, заряды, радиус, энергии граничных орбиталей и другими. Следовательно, жесткость также является функцией строения атомов и подчиняется периодическому закону Д.И. Менделеева.
Из рассмотренных функций строения атомов наибольший интерес представляет электроотрицательность. Она имеет численное выражение.
78
Относительная электроотрицательность определяется по шкале Л. Полинга
(табл. 1.2).
Поскольку жесткость акцепторных и донорных атомов и их электроотрицательность симбатно связаны между собой как функции строения атомов, то мы вправе судить о жесткости атомов по величине их электроотрицательности на качественном уровне.
Электроотрицательность, а значит, жесткость акцепторных и донорных атомов зависит от следующих факторов:
а) от их положением в таблице Менделеева. С увеличением порядкового номера элемента в периодах жесткость атомов возрастает, а в группах
– падает:
CH3−< NH2−< OH−< F−;
F2 > Cl2 > Br2 > I2;
NR3 > AsR3 > SbR3
б) от степени окисления. С увеличением степени окисления жест-
кость атомов повышается: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni 0 |
|
|
Ni +2 |
Ni +3; |
|
|
|
|
|
|
|
|||||
кислота |
|
кислота |
кислота |
|
|
|
|
|
|
|
||||||
мягкая |
промежуточная |
жесткая |
|
|
|
|
|
|
|
|||||||
в) от типа гибридизации. Так, например, с уменьшением доли р- |
||||||||||||||||
электронов жесткость атомов углерода растет: |
|
|
|
|
|
|
|
|||||||||
Тип гибридизации sp3 |
|
C |
|
C |
|
|
, sp2 C |
|
C |
, sp |
|
C |
|
C |
|
|
|
|
|
|
|
|
|
|
|||||||||
Относительная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
электроотрицательность |
2.5 |
|
|
2.8 |
|
3.1 |
|
|
||||||||
(жесткость) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г) от электронной природы окружающих их заместителей (электронный эффект). Как правило, заместители, обладающие +I-эффектом, повышают жесткость донорных атомов (нуклеофильный центр) и понижают жесткость акцепторных атомов (электрофильный центр). А заместители с – I-эффектом, наоборот, понижают жесткость донорных атомов и повышают жесткость акцепторных атомов. Это можно показать на ряде примеров:
79
− I -эффект |
+ I -эффект |
|
|||||||||||||
C H NH |
CH CH NH |
||||||||||||||
6 |
5 .. |
2 |
|
3 |
|
2 .. |
|
2 |
|||||||
промежуточный |
жесткий |
|
|||||||||||||
нуклеофил |
нуклеофил |
|
|||||||||||||
− I - эффект |
+ I -эффект |
|
|||||||||||||
C H OH |
CH3OH |
|
|||||||||||||
6 |
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
электрофил |
электрофил |
||||||||||||||
жестче |
мягче |
|
|||||||||||||
− I - эффект |
+ I - эффект |
|
|||||||||||||
|
|
|
|
|
|
O − |
|
|
+ O |
− |
|||||
|
|
|
+ |
|
|
|
|
||||||||
Cl3C |
|
|
C |
H C |
|
|
C |
|
|||||||
|
|
|
|
|
|||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
H |
3 |
|
|
|
|
H |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
электрофил |
электрофил |
|
|||||||||||||
жестче |
мягче |
|
|||||||||||||
д) от степени мягкости: радикалы мягче, чем молекулы и ионы.
Например, атом хлора (Cl) мягче молекулы хлора (Cl2) и катиона хлора
(Cl+).
Как было отмечено выше, максимальная стабильность продуктов реакции достигается при комбинации жестких кислот с жесткими основаниями и мягких кислот с мягкими основаниями. При иной комбинации реагирующих частиц образуются менее устойчивые продукты. Они подвергаются различным превращениям:
а) разложение 2 Hg |
|
|
O |
t0 |
|
2Hg + O2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
мягкая |
жесткое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
кислота |
основание |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
б) диспропорционирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2 H2C |
|
|
O (г) |
|
CH4 (г) + CO2 (г) |
( H2980 |
= −236.4 кДж/моль) |
|
|
|||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||
мягкая |
жесткое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
кислота |
основание |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2CH2F2 |
|
|
|
|
|
CH4 (г) + CF4 |
|
|
|
|
|
( H2980 |
= −108. 8 кДж/моль) |
|
||||||||||||||
мягкая |
жесткое |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
кислота |
основание |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
в) перегруппировка |
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
|
|
|
|
|
||||||||||
C6H5NH2 + [N |
|
N |
|
C6H5]+ |
|
|
C H NH |
|
N |
|
NC H |
|
|
|
|
|
−4 |
|||||||||||
|
|
+ |
|
|
|
|
C H N |
|
NC H NH |
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
.. |
|
|
|
|
− H |
|
6 |
5 |
|
|
|
|
6 |
5 |
|
6 |
5 |
6 |
4 |
2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Установлена зависимость скорости химических реакций от характера сочетания льюисовских кислот с льюисовскими основаниями. Чем бли-
80
