
796
.pdf
2. Структурная изомерия положения функциональной группы:
|
|
|
|
|
O |
|
|
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H3C |
|
|
C |
|
CH2CH2CH3 |
|
|
|
CH3CH2 |
|
C |
|
CH2CH3 |
|||||||||
|
|
|
|
|
|||||||||||||||||||
|
|
пентанон -2 |
|
|
|
|
пентанон -3 |
||||||||||||||||
H С O |
|
H С O |
|
|
|
|
|
H С O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
орто -толуиловый |
мета -толуиловый |
|
|
пара -толуиловый |
|||||||||||||||||||
альдегид |
|
|
альдегид |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
альдегид |
|||||||||||||||
(2-метилбензальдегид) |
(3-метилбензальдегид) |
(4-метилбензальдегид) |
|||||||||||||||||||||
Физические свойства. Альдегиды существуют в трех агрегатных состо-
яниях: |
|
|
|
O |
|
O |
||
|
|
|
|
|
|
|
||
газообразном (H2C |
|
|
O), жидком H3C |
|
C ... C11H23 |
|
C |
|
|
|
|||||||
|
|
|
|
|||||
|
|
|
|
O |
|
H |
|
H |
|
|
|
|
|
|
|
||
и твердом C12H25 |
|
|
|
C и выше . |
|
|
|
|
|
|
|
|
|
|
|||
H
Низшие альдегиды (С1 – С8) обладают резким запахом, средние альдегиды (С8 – С12) – душистые вещества, высшие альдегиды (С12 и выше) – без запаха.
Кетоны имеют более высокие температуры кипения, чем соответствующие им альдегиды и существуют только в жидком и твердом состояниях. Все альдегиды и кетоны хорошо растворяются в органических растворителях. Низшие альдегиды и кетоны (С1 – С3) хорошо растворимы в воде. С повышением молекулярной массы оксосоединений уменьшается их растворимость в воде и повышается температура кипения. Альдегиды и кетоны кипят при более низких температурах, чем соответствующие им спирты, из-за отсутствия водородных связей:
|
|
|
O |
CH3CH2CH2OH |
CH3CH2 |
|
C |
|
|||
|
|
|
H |
tкип. = 970 С |
tкип. = 490 С |
||
УФ-поглощение карбонильными группами альдегидов и кетонов при 150 ÷ 160 нм связано с переходами n - σ*, при 180 ÷ 190 нм – с переходами π - π* и при 275 ÷ 295 нм – с n - π*-переходами. Функциональная карбонильная группа в ИК-области дает характеристическую полосу 1600 ÷ 1900 см-1. В ПМР-спектроскопии альдегидные протоны имеют характерные химические сдвиги в области 8.0 ÷ 10.0 м.д. Слабое экранирование их обу-
141
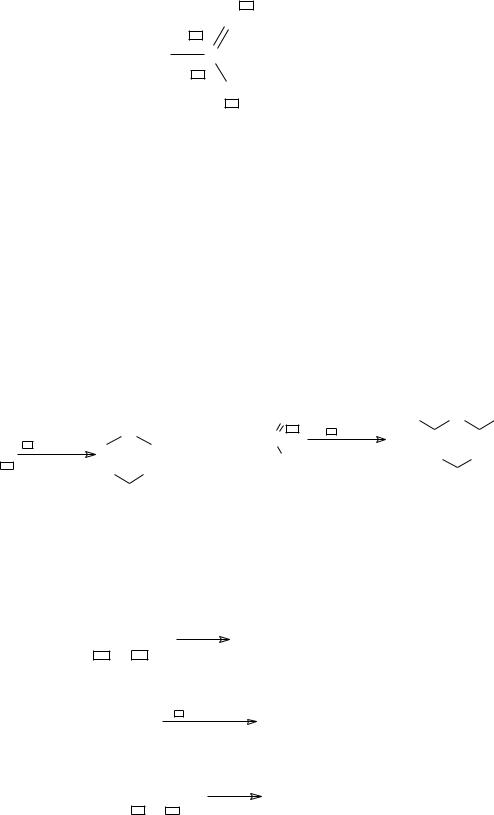
словлено разэкранирующим магнитоанизотропным эффектом карбонильной группы.
Химические свойства. Функциональная карбонильная группа содержит 4 реакционных центра. 5-й реакционный центр находится в углеводо-
родном радикале: |
− .. |
+ |
O н.ц. |
э.ц−.C
.. +
н.ц. H
э.ц.
У альдегидов и кетонов сильно выражены электрофильные свойства углерода (Сδ+). Остальные свойства проявляются слабее. Здесь следует отметить, что только некоторые жесткие альдегиды и кетоны (хлораль, гекса-
фторацетон, индантрион и др.) способны вступать в реакцию гидратации, образуя диоксипроизводные, например, хлоральгидрат, нингидрин и другие. Кетоны окисляются труднее, чем альдегиды. Окисление кетонов сопровождается разрывом углеродной цепи. Кетоны, в отличие от альдегидов, не окрашивают бесцветный раствор фуксинсернистой кислоты.
1. Нуклеофильные свойства Оδ- - реакции с жесткими электрофилами (кислотами Бренстеда – H2SO4 и кислотами Льюиса –
AlCl3):
а) водородными: − полимеризация
|
|
|
|
|
|
|
|
|
|
|
O |
|
H C |
|
|
|
O CH |
|||
|
|
|
|
|
O |
|
|
|
|
|
|
.. |
H2SO4 |
3 |
|
|
|
3 |
||
|
|
|
H2SO4, разб. |
|
|
|
|
3H3C |
|
C |
|
|
|
|
|
|
|
|||
3 H C |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
O |
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2 .. |
|
O |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
триоксиметилен, t пл.= 63 |
0 |
С |
паральдегид, t кип. |
= 124.5 |
0 |
С |
CH3 |
|||||||||||||
При повышении температуры образуется тетрамер – метальдегид;
б) металлическими:
− комплексообразование с жесткой кислотой Льюиса
RR'C |
|
O + AlCl3 |
RR'C |
|
O+ : Al−Cl3 |
|
|
||||
|
|
||||
.. |
|
|
|
||
|
− полимеризация |
|
|
|
||
|
|
|
Fe(CO) , 1850 C |
|
|
|
|
4 |
|
|
)n |
||
|
n H2C |
|
O совершенно |
(H2CO |
|
|
|
|
|
||||
|
|
|
сухой |
полиформальдегид |
||
в) фосфорными:
RR'C |
|
O + PCl |
RR'CCl |
+ POCl |
|
|
|||||
|
|||||
.. |
5 |
2 |
3 |
||
|
|
|
|
142 |
|
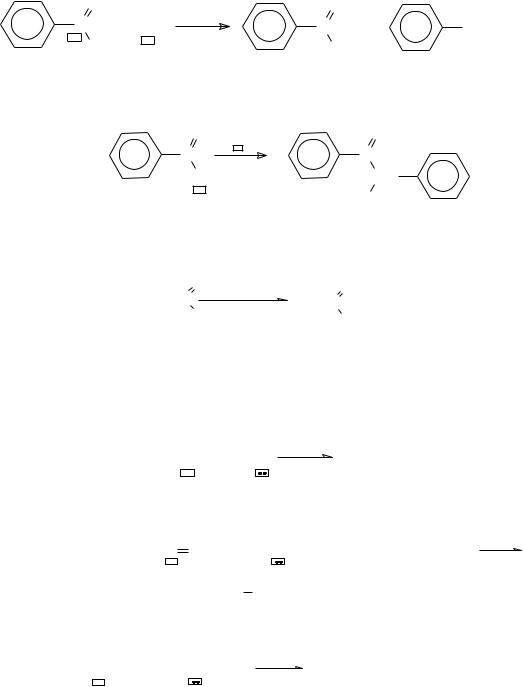
2. Электрофильные свойства водорода Нδ+. Под влиянием ка-
тализаторов происходит гидридный переход:
а) реакция Канниццаро (в реакцию Канниццаро вступают лишь альдегиды, не имеющие водородного атома у α-углеродного атома альдегида, то есть ароматические альдегиды в присутствии концентрированного раствора гидроксидов щелочных и щелочноземельных металлов):
|
O |
|
O |
|
2 |
C + KOH |
C + |
CH2OH |
|
|
H |
.. |
OK |
|
|
|
|
||
б) бензоиновая конденсация (при действии водно-спиртовых растворов цианида калия ароматические альдегиды димеризуются в α-оксике-
тоны): |
O |
|
O |
|
KCN |
||
|
|
|
|
2 |
C |
.. |
C |
|
|||
|
H |
|
CH |
|
|
|
HO |
в) реакция Кляйзена-Тищенко (в реакцию Кляйзена-Тищенко вступают любые альдегиды):
|
|
O |
(RCH2O)3A l |
|
|
O |
2R |
|
C |
|
R |
|
C |
|
|
|||||
|
|
|
||||
|
|
H |
|
|
|
OCH2R |
3. Электрофильные свойства углерода Сδ+- реакции с нуклеофилами:
а) водородными:
− гидрирование водородом
RR'C |
|
O + H2 |
Pt |
RR'CH |
|
OH |
|
|
|
э.ц. н.ц.
− гидрирование алюмогидридом лития
RR'C O + Li[AlH4] [RR'CHOAlH3]Li 4H2O
[RR'CHOAlH3]Li 4H2O
э.ц. н.ц.
 RR'CH OH + Li[Al(OH)4] + 3H2 − реакция Мейервейна-Пондорфа-Верлея (гидрирование)
RR'CH OH + Li[Al(OH)4] + 3H2 − реакция Мейервейна-Пондорфа-Верлея (гидрирование)
|
|
|
|
Al(C3H7O)3 |
||||
(СH3)2C |
|
O + RR'CH |
|
OH бензол (CH3)2CH |
|
OH + RR' |
|
O |
|
|
|||||||
|
|
|
||||||
|
|
|||||||
э.ц. |
н.ц. |
|||||||
б) кислородными (кислородные нуклеофилы жесткие, поэтому они реагируют с карбонильными соединениями избирательно):
143

− гидратация (вода – самый жесткий нуклеофил, она образует устой-
чивые продукты только с жесткими карбонильными соединениями: хлора-
лем, трикетоинданом, аллоксаном и др.)
O |
|
|
OH |
|
Сl3C C |
H + HOH |
Cl3C C |
OH |
|
э.ц. |
н.ц. |
H |
|
|
|
|
|
|
|
− алкоксилирование (образование ацеталей)
|
|
O |
|
|
|
OR' |
|
||||||
|
|
|
|
|
|
|
H+ |
|
|
|
OR' + H2O |
||
|
|
|
|
|
|
|
|
||||||
R |
|
C |
|
H + HOR' |
R |
|
C |
|
|||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|||||||
|
э.ц. |
н.ц. |
|
|
H |
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
в) азотными (азотные нуклеофилы мягче кислородных и вступают в реакции со всеми карбонильными соединениями):
− реакция с аммиаком
6H2C O + 4NH3  (CH2)6N4 + 6H2O
(CH2)6N4 + 6H2O
э.ц. н.ц. гексаметилентетрамин (уротропин)
− реакция с аминами (реакция Шиффа)
|
RR'C |
|
|
O + NH2 |
|
|
|
|
|
|
R" |
RR'C |
|
|
NR" + H2O |
|||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
э.ц. |
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
− |
реакция с гидроксиламином |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
RR'C |
|
O + NH2 |
|
|
|
|
|
|
OH |
RR'C |
|
NOH + H2O |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
э.ц. |
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
− |
реакция с фенилгидразином |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
RR'C |
|
O + NH2NH |
|
|
|
|
|
C6H5 |
RR'C |
|
|
NNH |
|
|
C6H5 + H2O |
||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
э.ц. |
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
−реакция с семикарбазидом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
RR'C |
|
O + NH2NH |
|
C |
|
NH2 |
RR'C |
|
NNH |
|
C |
|
NH2 + H2O |
||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
э.ц. |
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
O |
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
В некоторых случаях промежуточно образующиеся азометины подвергаются дальнейшим превращениям. Так, например, из формальдегида и ароматических аминов образуются триазины, а из алифатических альдегидов (например, ацетальдегида) и ароматических аминов – хинолиновые основания. Аналогичная ситуация наблюдается в реакциях аммиака с формальдегидом (уротропин), с ацетальдегидом (альдегидаммиак), бензальдегидом (гидробензамид);
144

г) металлическими: − реакция Клеменса
RR'C |
|
|
O + Zn + HClамальгама |
RR'CH2 |
+ ZnCl2 + H2O |
||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||
|
|
э.ц. |
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
− пинаконовое восстановление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
амальгама |
|
|
|
|
|
|
|
CH3 |
CH3 |
||||||||||||
|
|
|
|
|
|
|
2(СH ) C |
|
|
O + Na |
H C |
|
|
C |
|
|
|
C |
|
|
CH |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
3 2 |
|
|
|
|
|
|
|
+2H |
3 |
|
|
|
|
|
|
|
|
|
|
|
3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
э.ц. |
|
|
|
|
|
|
|
|
|
|
OH OH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
д) серными: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
− с фуксинсернистой кислотой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
C |
|
|
+ H SO фуксин |
|
|
СH |
|
|
CH SO H + фуксин |
|||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
э.ц. H |
2 |
3 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
краситель |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
красного |
||||||||||
|
|
|
|
|
|
|
|
|
|
бесцветная фуксин- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
цвета |
||||||||
|
|
|
|
|
|
|
|
|
|
сернистая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
− с гидросульфитом натрия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
RR'C |
|
O + NaHSO3 |
|
|
|
|
RR'C |
|
|
|
SO2ONa |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
− с меркаптанами |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
RR'C |
|
|
O + HS |
|
CH2 |
|
|
CH2 |
|
SH |
|
|
|
|
RR'C |
|
S |
|
|
CH2 |
+ H2O |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
S |
|
|
CH2 |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
э.ц. |
|
|
|
н.ц. |
|
|
|
|
|
н.ц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
е) углеродными (все реакции с углеродными нуклеофилами в при-
сутствии щелочи протекают по единому механизму: на первой стадии об-
разуется карб-анион, который внедряется в электронный пробел карбо-
нильного углерода):
− циангидрирование
RR'C O + H C N NaOH |
RR'C C N |
|
э.ц. |
н.ц. |
OH |
|
|
|
−реакция Фаворского (см. 3.3. «Алкины»)
−реакция Гриньяра (см. 3.8. «Спирты и фенолы») − альдольная конденсация
|
C |
O |
NaOH |
|
O |
2CH |
|
CH3 CH CH2 C |
|
||
3 |
|
H |
|
|
H |
н.ц. |
э.ц. |
|
OH |
||
|
|
|
|||
|
|
|
|
145 |
|
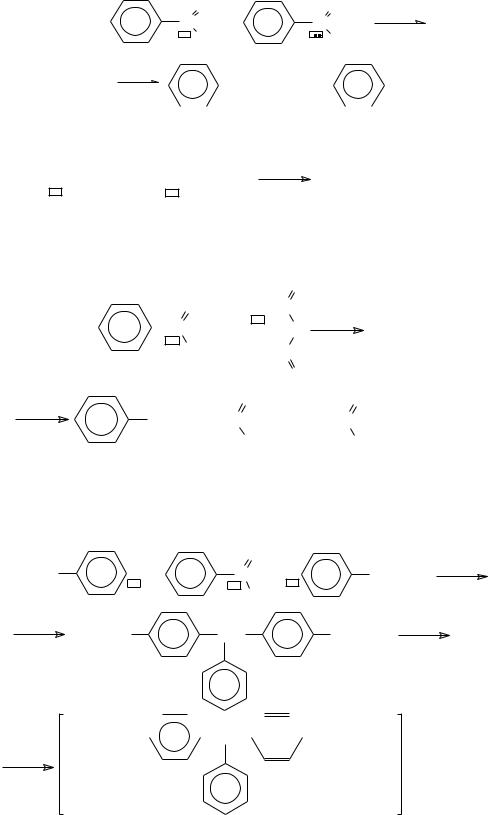
Особым случаем альдольной конденсации является реакция Кляйзе- на-Шмидта
O |
O |
NaOH |
|
C + |
C |
||
|
|||
э.ц. H |
н.ц. CH |
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
CH |
|
H |
|
C |
|
|
|
|
|
|
|
|
|
+ H2O |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
− реакция Кневенагеля |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
R C |
|
O + N |
|
C |
|
CH COOR' NaOH |
R C |
|
C |
|
COOR' + H O |
|||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||
2 |
|
|
|
|
|
.. |
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
||||||
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
N |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
− реакция Перкина
|
|
|
|
|
|
|
|
|
O |
||
|
|
|
O |
|
|
H C |
|
C |
|||
|
|||||||||||
|
|
C |
3.. |
|
O NaOH |
||||||
|
|
+ |
|
|
|
||||||
|
|
|
|||||||||
|
|
|
H |
|
|
H3C |
|
C |
|||
|
|||||||||||
|
|
|
|
|
|
|
|
|
O |
||
|
|
|
|
|
|
|
O |
|
|
O |
|
CH |
|
CH |
|
C + H3C |
|
C + H2O |
|||||
|
|
|
|||||||||
|
|
|
|
|
|
|
ONa |
|
|
ONa |
|
− конденсация бензальдегида с третичными аминами
|
|
|
O |
|
|
|
|
(CH3)2N |
.. |
+ |
C + |
.. |
N(CH ) |
ZnCl2 |
|
|
|
|
|
3 2 |
|||
|
|
|
H |
|
|
|
− H2O |
|
|
|
|
|
|
|
|
|
(CH3)2N |
|
CH |
|
N(CH3)2 |
PbO2 |
|
|
|
|
HCl |
|
|||
|
|
|
|
|
|
|
|
(CH3)2N
 C
C
 N+ (CH3)2
N+ (CH3)2
Cl−
малахитовый зеленый
146
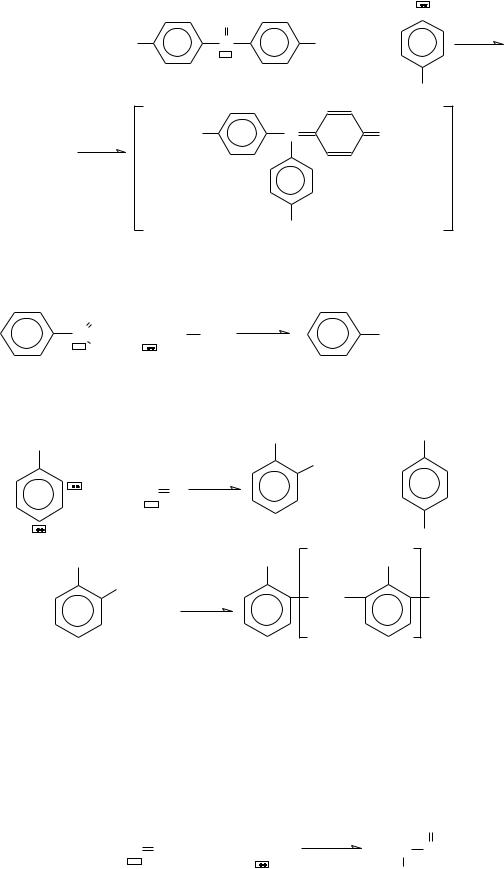
− конденсация кетона Михлера с третичным амином
|
O |
|
|
н.ц. |
|
|
|
|
|
(СH3)2N |
C |
|
N(CH3)2 + |
POCl3 |
|
|
|||
|
э.ц. |
|
|
|
|
|
|
|
N(CH3)2 |
|
(CH3)2N |
C |
N+(CH3)2 Cl- |
|
N(CH3)2
кристаллический фиолетовый
− конденсация ароматических альдегидов с фенолами
|
O |
|
|
ZnCl2 |
|
|
|
|
C |
+ 2C6H5 OH |
CH(C6H4OH-4)2 + H2O |
||||
|
|
||||||
|
э.ц.H |
н.ц |
|
|
|
|
|
|
− поликонденсация фенола с формальдегидом |
|
|
||||
|
OH |
|
|
OH |
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
|
CH2OH |
|
|
2 |
н.ц + 2H2C O |
|
+ |
|
|
||
|
|
|
|
||||
|
|
|
|
|
|||
|
|
э.ц. |
|
|
|
|
|
|
н.ц |
|
|
|
|
CH2OH |
|
|
OH |
|
|
OH |
OH |
|
|
|
|
CH2OH |
H+ |
|
CH2 |
CH2OH |
|
(n+2) |
|
|
+ nH2O |
||||
|
|
|
|
|
|||
|
|
|
|
|
|
n |
|
|
|
|
|
резольная смола |
|
|
|
|
|
|
|
(продукт линейной структуры) |
|
||
При дальнейшем нагревании резольная смола превращается в ново-
лачную смолу (продукт сетчатой структуры);
ж) фосфорными:
− реакция Абрамова
|
|
O |
RR'C O + (R"O)2POH R"ONa |
RR'C P(OR")2 |
|
э.ц. |
н.ц |
OH |
|
|
|
|
147 |
|
4. Нуклеофильные свойства sp2-гибридного углерода – реакции с электрофилами:
а) кислородными:
|
|
|
O |
|
h |
|
O |
|
|
2R |
C |
|
+ O O |
2R C |
|
||
|
|
н.ц H |
э.ц. э.ц. |
|
|
OH |
|
|
б) галогенными: |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
O |
|
|
|
C |
H |
|
|
|
C |
Cl |
|
|
.. |
Cl |
Cl |
|
|
HCl |
||
|
|
+ |
|
|
+ |
|||
в) металлическими: |
|
|
|
|
|
|
|
|
− реакция серебряного зеркала |
|
|
|
|
||||
R C O + 2[Ag(NH ) ]OH |
R C O + 2Ag + 4NH3 + H2O |
|||||||
н.ц H |
|
|
3 2 |
|
OH |
|
|
|
э.ц. |
|
|
|
|
|
|||
− восстановления оксида меди
R COH + CuO R COOH + Cu
R COOH + Cu
н.ц э.ц.
5. Нуклеофильные свойства sp3-гибридного углерода кетонов – реакции с электрофилами:
а) галогенными:
− бромирование
C H |
CO CH |
+ Br Br |
C H |
CO CH Br + HBr |
||
6 |
5 |
3 |
|
6 |
5 |
2 |
|
|
н.ц |
э.ц. |
|
|
|
б) металлическими: −окисление кетонов
|
|
O |
|
|
|
|
|
|||||
CH3 |
|
C |
|
CH2 |
|
CH2 |
|
CH3 + K2Cr2O7 + 4H2SO4 |
||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
O |
O |
||||
|
|
H3C |
|
C |
+ CH3CH2 |
|
C + Cr2(SO4)3 + K2SO4 +4H2O |
|||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
OH |
OH |
||||
Практическое значение. К промышленно важным альдегидам и ке- то-нам относятся: муравьиный альдегид, широко применяемый в производстве фенолформальдегидных смол. 40% раствор формальдегида в воде – формалин – применяется как консервант скоропортящихся органических
148
материалов. Муравьиный альдегид с аммиаком образует уротропин, который применяется в медицине как мочегонное средство; при взрывных работах используется гексоген; комплекс уротропина с хлоридом кальция − кальцекс − применяется при лечении почечных заболеваний. Метальдегид используется в качестве сухого горючего. Полиформальдегид применяется для приготовления синтетического волокна и разнообразных изделий. Уксусный альдегид незаменим при получении синтетической уксусной кислоты. Хлораль используется для получения хлоральгидрата, который в медицине известен как снотворное средство. Хлораль также применяется для получения ДДТ и других инсектицидов. Бензальдегид используется в производстве красителей, душистых веществ, коричный альдегид является важным компонентом в парфюмерной промышленности. Ацетон применяется в качестве растворителя в очень больших количествах в лакокрасочной промышленности. Ацетофенон и бензофенон имеют приятный запах и используются для производства духов и одеколонов. Бензофенон и его производные используются для изготовления красителей трифенилметанового ряда (кристаллический фиолетовый, кристаллический синий, малахитовый зеленый и др.)
149
3.10. Карбоновые кислоты
Карбоновые кислоты – класс органических соединений, содержащих
функциональную карбоксильную группу O |
|
|
|
||||||
|
|
|
|
C |
( |
|
COOH) |
||
|
|
|
|
|
|||||
Примерами карбоновых кислот |
|
OH |
|
|
|
||||
|
|
|
|
|
|
|
|||
могут служить: |
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
|
|
O |
|
|
|
|
|
|
|
||||
H3C |
|
C |
|
|
|
|
C |
||
|
|
|
|
|
|||||
|
|
OH |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
||||
уксусная кислота |
бензойная кислота |
||||||||
Классификация. По характеру радикала карбоновые кислоты подразделяются на следующие классы.
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
||
1. Предельные: |
CH3CH2CH2 |
|
|
C |
|
|
|
|
|
|
масляная кислота |
||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
O |
|
||
2. Непредельные: |
|
CH2 |
|
CH |
|
|
|
C |
акриловая кислота |
||||||
|
|
|
|
||||||||||||
|
|
|
|
O |
|
|
|
|
|
OH |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
3.Алицик лические: |
|
C |
|
|
|
циклогексанкарбоновая кислота |
|||||||||
|
|
|
|
OH |
O |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
4. Ароматические: |
|
|
|
|
|
|
|
|
С OH |
− нафтойная кислота |
|||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5. Гетероциклические: |
|
|
|
C OH |
никотиновая кислота |
||||||||||
|
|
|
|
|
|
||||||||||
 N
N
По количеству карбоксильных групп карбоновые кислоты делятся на группы:
1. Одноосновные: H |
|
COOH |
муравьиная кислота. |
|||||
|
||||||||
2. Двухосновные: HOOC |
|
COOH |
щавелевая кислота. |
|||||
|
||||||||
3. Трех-, четырех-, пяти- и шестиосновные: |
|
|
|
|||||
|
|
|
|
|
|
COOH |
||
|
|
|
|
|
HOOC |
|
|
COOH |
|
|
|
|
|
|
|
||
|
|
|
|
|
HOOC |
|
|
COOH |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
||
150 |
мелитовая кислота |
|||||||
