- •Вопросы к экзамену
- •Предмет химии. Химия и окружающая среда. Связь химии с медициной.
- •1.1) Предмет химии. Химия и окружающая среда
- •1.2) Химия и медицина
- •2.1) Основные понятия термодинамики
- •2.2. Типы термодинамических систем
- •2 .3)Параметры системы
- •2.4) Термодинамический процесс
- •3.1. Первое начало термодинамики
- •3.2) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •3.3) Закон Гесса.
- •3.4) Применение первого начала термодинамики к биосистемам.
- •4.1) Энергетические эффекты химических реакций. Факторы, влияющие на энергетический эффект химической реакции.
- •4.2) Термохимические уравнения.
- •4.3) Теплота и энтальпия химической реакции.
- •4.3) Закон Гесса и следствия из него.
- •5. Второе начало термодинамики. Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности. Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •5.1) Второе начало термодинамики
- •5.2) Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности.
- •5.3) Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •6.1) Изобарный потенциал реакции (свободная энергия Гиббса)
- •6.2) Критерий самопроизвольности реакций.
- •6.3) Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
- •7.1. Скорость химической реакции (средняя и истинная).
- •7.2. Закон действующих масс (к.Гульдберг и п.Вааге)
- •7.3. Молекулярность и порядок химических реакций.
- •Порядок реакции
- •7.4. Экспериментальное определение порядка реакции по одному из веществ и общего.
- •7.5. Факторы, влияющие на скорость химической реакции.
- •8. Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Ферментативный катализ.
- •8.1) Энергия активации Уравнение Аррениуса
- •8.2) Экспериментальное определение энергии активации
- •8.3) Катализ (гомогенный, гетерогенный).
- •Особенности катализатора
- •8.4) Автокатализ
- •8.5) Ферментативный катализ
- •8.6) Уравнение Михаэлиса-Ментен.
- •9. Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •10. Общая характеристика растворов. Компонент. Фаза. Гомогенные и гетерогенные системы.
- •11. Способы выражения концентрации растворов.
- •12. Растворимость. Механизмы растворения. Произведение растворимости.
- •Механизм растворения
- •2. Идеальные растворы.
- •3. Закон Рауля и следствия из него.
- •Рауль установил:
- •4. Осмос и осмотическое давление.
- •Закон Вант-Гоффа.
- •Закон Рауля применим для растворов неэлектролитов. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
- •Роль осмоса в биологических системах. Осмотическое давление крови человека – 740 – 780 кПа
- •14. Процесс электролитической диссоциации как взаимодействие веществ.
- •15. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •16. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •17. Протолитические равновесия. Кислоты, основания, амфолиты по Бренстеду.
- •18. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •19. Автопротолиз. Ионное произведение воды. РН.
- •1.Автопротолиз
- •2.Ионное произведение воды
- •20. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчет рН.
- •20.1) Гидролиз по катиону и аниону. Необратимый гидролиз
- •21. Буферные растворы, природные буферные системы. Расчет рН буферных систем, буферная ёмкость.
- •Расчет рН буферных систем
- •22. Кислоты и основания по Льюису.
- •23. Гетерогенные равновесия. Произведение растворимости.
- •24. Химическая связь: типы связи, механизмы образования, характеристики.
- •Типы связи
- •Механизмы образования химической связи
- •25. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1. Комплексные соединения (кс). Строение кс.
- •2. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1.Номенклатура кс
- •2.Классификация кс
- •3.Характер связи в кс
- •26. Диссоциация комплексных ионов. Константа нестойкости (устойчивости). Комплексообразование в организме.
- •26.1) Диссоциация комплексных ионов
- •26.2) Константа нестойкости (устойчивости).
- •Чем меньше Кнест, нет более прочно кс
- •26.3) Комплексообразование в организме.
- •27. Изомерия кс. Комплексообразование в организме. Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины.
- •Комплексообразование в организме.
- •28. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
- •29. Овр и их биологическая роль. Редокс-равновесия и редокс-процессы. Разновидности редокс-реакций. Электродные потенциалы, уравнение Нернста. Эдс гальванического элемента.
- •Классификация овр
- •Прогнозирование направления редокс-процессов по величинам редокс-потенциалов
- •Константа окислительно-восстановительного процесса
- •33. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •34. Методы очистки коллоидных растворов. Диализ, электродиализ, ультрафильтрация.
- •35. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •36. Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •37. Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди. Взаимная коагуляция. Значение коагуляции в медицине. Коллоидная защита и пептизация.
- •Значение в медицине
- •Коллоидная защита и пептизация
- •38. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Уравнение Гиббса.
- •38.1) Поверхностные явления и адсорбция.
- •38.2) Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Изотерма Ленгмюра
- •38.3) Изотерма Генри
- •Уравнение Гиббса ( , если сравнивается с водой)
- •40. Поверхностное натяжение и методы его определения.
- •41. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция.
- •42. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция.
- •43. Применение адсорбционных процессов в медицине.
- •44. Хроматография.
- •45. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул. Механизм набухания и растворения вмс. Зависимости величины набухания от различных факторов.
- •45.1) Свойства растворов вмс
- •45.2) Особенности растворения вмс как следствие их структуры.
- •45.3) Форма макромолекул
- •45.4) Механизм набухания и растворения вмс
- •П роцесс набухания количественно характеризуется степенью набухания, α:
- •45.5) Зависимости величины набухания от различных факторов.
- •48. Химия биогенных элементов s- блока.
- •49. Химия биогенных элементов d- блока.
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
- •50. Химия биогенных элементов р- блока.
- •Свойства р-элементов
- •Iiiа – группа
- •Iva группа
- •Viia – группа
7.4. Экспериментальное определение порядка реакции по одному из веществ и общего.
Определение порядка реакции способствует выяснению ее механизма. Существует несколько способов нахождения порядка реакции.
Метод подстановки. По этому методу в начале определяют концентрации веществ в различные моменты времени от начала реакции, а затем производят расчет констант скоростей, используя уравнения нулевого, первого, второго, третьего порядка. Выясняют, по какому уравнению расчет дает практически постоянную величину константы с небольшими отклонениями. Этому порядку подчиняется исследуемая реакция.
Графический метод заключается в построении графика, выражающего зависимость различных функций концентрации от времени: для реакции первого порядка – lgС = f(t), для реакции второго порядка – 1/C = f (t), для реакции третьего порядка 1/C2 =f(t). Отложив на оси абсцисс время t, а на оси ординат lgС, 1/C и 1/C2
для изучаемой реакции получают при линии. Та из них, которая будет прямой, соответствует этому порядку реакции, две другие линии окажутся кривыми.
Метод определения периода полу-превращений основан на определении промежутка времени, в течение которого концентрации или количества исходных веществ уменьшаются ровно в два раза. Если период полу превращений не зависит от концентрации, то реакция является реакцией первого порядка, если обратно пропорционален начальной концентрации в первой степени, то реакция второго порядка; если период полу превращений обратно пропорционален начальной концентрации во второй степени, то реакция третьего порядка.
Метод Вант-Гоффа или изоляции (избытка) заключается в экспериментальном определении, каким образом влияет изменение концентрации только одного из реагентов на скорость реакции.
Определяя скорость реакции при различных концентрациях реагентов и строя график зависимости логарифма скорости реакции от логарифма концентрации, определяют угол наклона полученной прямой. Тангенс угла наклона прямой равен порядку реакции относительно вещества, концентрация которого изменялась. Если начальные концентрации реагентов отличаются, то определяют частные порядки реакции, сумма которых дает полный порядок реакции.
|
7.5. Факторы, влияющие на скорость химической реакции.
1. Природа веществ
2. Концентрации веществ (давление - для газофазных реакций)
3. Температура
4. Энергия активации
5. Катализаторы
6. Степень измельчённости – для гетерогенных процессов.
8. Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Ферментативный катализ.
8.1) Энергия активации Уравнение Аррениуса
В большинстве случаев, скорость химической реакции увеличивается при повышении температуры. При этом возрастает константа скорости реакции. Зависимость константы скорости реакции от температуры выражается уравнением Аррениуса:
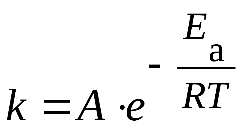
где k - константа скорости реакции;
A - константа, называемая предэкспоненциальным множителем;
- основание натурального логарифма;
Еa - энергия активации, Дж/моль;
Т - температура, К;
R - газовая постоянная, 8,31 Дж/моль*К.
Избыточная энергия (по сравнению со средней энергией при данной температуре), которой должны обладать молекулы, для протекания реакции, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами.
Уравнение Аррениуса позволяет расчитать cкорость реакции при:
1)
Различных температурах(Т,К):
![]()
2)
Изменении энергии активации: