
- •Вопросы к экзамену
- •Предмет химии. Химия и окружающая среда. Связь химии с медициной.
- •1.1) Предмет химии. Химия и окружающая среда
- •1.2) Химия и медицина
- •2.1) Основные понятия термодинамики
- •2.2. Типы термодинамических систем
- •2 .3)Параметры системы
- •2.4) Термодинамический процесс
- •3.1. Первое начало термодинамики
- •3.2) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •3.3) Закон Гесса.
- •3.4) Применение первого начала термодинамики к биосистемам.
- •4.1) Энергетические эффекты химических реакций. Факторы, влияющие на энергетический эффект химической реакции.
- •4.2) Термохимические уравнения.
- •4.3) Теплота и энтальпия химической реакции.
- •4.3) Закон Гесса и следствия из него.
- •5. Второе начало термодинамики. Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности. Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •5.1) Второе начало термодинамики
- •5.2) Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности.
- •5.3) Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •6.1) Изобарный потенциал реакции (свободная энергия Гиббса)
- •6.2) Критерий самопроизвольности реакций.
- •6.3) Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
- •7.1. Скорость химической реакции (средняя и истинная).
- •7.2. Закон действующих масс (к.Гульдберг и п.Вааге)
- •7.3. Молекулярность и порядок химических реакций.
- •Порядок реакции
- •7.4. Экспериментальное определение порядка реакции по одному из веществ и общего.
- •7.5. Факторы, влияющие на скорость химической реакции.
- •8. Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Ферментативный катализ.
- •8.1) Энергия активации Уравнение Аррениуса
- •8.2) Экспериментальное определение энергии активации
- •8.3) Катализ (гомогенный, гетерогенный).
- •Особенности катализатора
- •8.4) Автокатализ
- •8.5) Ферментативный катализ
- •8.6) Уравнение Михаэлиса-Ментен.
- •9. Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •10. Общая характеристика растворов. Компонент. Фаза. Гомогенные и гетерогенные системы.
- •11. Способы выражения концентрации растворов.
- •12. Растворимость. Механизмы растворения. Произведение растворимости.
- •Механизм растворения
- •2. Идеальные растворы.
- •3. Закон Рауля и следствия из него.
- •Рауль установил:
- •4. Осмос и осмотическое давление.
- •Закон Вант-Гоффа.
- •Закон Рауля применим для растворов неэлектролитов. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
- •Роль осмоса в биологических системах. Осмотическое давление крови человека – 740 – 780 кПа
- •14. Процесс электролитической диссоциации как взаимодействие веществ.
- •15. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •16. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •17. Протолитические равновесия. Кислоты, основания, амфолиты по Бренстеду.
- •18. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •19. Автопротолиз. Ионное произведение воды. РН.
- •1.Автопротолиз
- •2.Ионное произведение воды
- •20. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчет рН.
- •20.1) Гидролиз по катиону и аниону. Необратимый гидролиз
- •21. Буферные растворы, природные буферные системы. Расчет рН буферных систем, буферная ёмкость.
- •Расчет рН буферных систем
- •22. Кислоты и основания по Льюису.
- •23. Гетерогенные равновесия. Произведение растворимости.
- •24. Химическая связь: типы связи, механизмы образования, характеристики.
- •Типы связи
- •Механизмы образования химической связи
- •25. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1. Комплексные соединения (кс). Строение кс.
- •2. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1.Номенклатура кс
- •2.Классификация кс
- •3.Характер связи в кс
- •26. Диссоциация комплексных ионов. Константа нестойкости (устойчивости). Комплексообразование в организме.
- •26.1) Диссоциация комплексных ионов
- •26.2) Константа нестойкости (устойчивости).
- •Чем меньше Кнест, нет более прочно кс
- •26.3) Комплексообразование в организме.
- •27. Изомерия кс. Комплексообразование в организме. Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины.
- •Комплексообразование в организме.
- •28. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
- •29. Овр и их биологическая роль. Редокс-равновесия и редокс-процессы. Разновидности редокс-реакций. Электродные потенциалы, уравнение Нернста. Эдс гальванического элемента.
- •Классификация овр
- •Прогнозирование направления редокс-процессов по величинам редокс-потенциалов
- •Константа окислительно-восстановительного процесса
- •33. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •34. Методы очистки коллоидных растворов. Диализ, электродиализ, ультрафильтрация.
- •35. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •36. Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •37. Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди. Взаимная коагуляция. Значение коагуляции в медицине. Коллоидная защита и пептизация.
- •Значение в медицине
- •Коллоидная защита и пептизация
- •38. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Уравнение Гиббса.
- •38.1) Поверхностные явления и адсорбция.
- •38.2) Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Изотерма Ленгмюра
- •38.3) Изотерма Генри
- •Уравнение Гиббса ( , если сравнивается с водой)
- •40. Поверхностное натяжение и методы его определения.
- •41. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция.
- •42. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция.
- •43. Применение адсорбционных процессов в медицине.
- •44. Хроматография.
- •45. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул. Механизм набухания и растворения вмс. Зависимости величины набухания от различных факторов.
- •45.1) Свойства растворов вмс
- •45.2) Особенности растворения вмс как следствие их структуры.
- •45.3) Форма макромолекул
- •45.4) Механизм набухания и растворения вмс
- •П роцесс набухания количественно характеризуется степенью набухания, α:
- •45.5) Зависимости величины набухания от различных факторов.
- •48. Химия биогенных элементов s- блока.
- •49. Химия биогенных элементов d- блока.
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
- •50. Химия биогенных элементов р- блока.
- •Свойства р-элементов
- •Iiiа – группа
- •Iva группа
- •Viia – группа
15. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
Влияние концентрации на скорость химической реакции выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ. Вещества, которые растворяются в воде с образованием растворов, проводящих электрический ток, называются электролитами.
Электролитическая диссоциация- распад веществ на ионы.
Степень диссоциации (a) равна отношению распавшихся на ионы молекул(n) к общему числу молекул (N)электролита, введëнных в раствор.
a = (n/N) • 100%
Степень диссоциации электролитов зависит от концентрации растворов с уменьшением концентрации она растет.
a = i - 1/([n - 1)
Сильный электролит представляет собой раствор/растворенное вещество, которое полностью или почти полностью ионизируется или диссоциирует в растворе. Эти ионы являются хорошими проводниками электрического тока в растворе.
а > 30%
Слабые электролиты — раствор/растворëнное вещество, которое диссоциирует не полностью (уменьшается с ростом концентрации).
3 < а < 30
16. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
Эта теория была создана в 1923 г Дебаем и Хюккелем. Поскольку в растворе сильные электролиты практически полностью диссоциируют на ионы, постольку в растворе резко увеличивается концентрация частиц (ионов), расстояние между ними резко снижается и усиливается кулоновское взаимодействие между ионами.
Кулоновским взаимодействием пренебречь нельзя, что делала теория Аррениуса. Поэтому законы, выведенные для слабых электролитов, оказались не действительны для сильных электролитов. Вследствие этого было введено понятие АКТИВНОСТИ.
Активность – это действительная концентрация, которая может быть равна концентрации в разбавленных растворах, а в концентрированных - может изменяться в большую или меньшую сторону.
Активность связана с концентрацией уравнением:
a f C,
где f – коэффициент активности изменяется в зависимости от концентрации.
При f = 1, а = С (в разбавленных растворах).
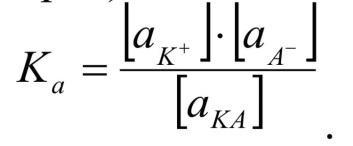
![]() то
правильно записать
то
правильно записать
В этом уравнении принимает участие не концентрация вещества, а его активность. Существует параметр, позволяющий определить коэффициент активности, который называют ионной силой раствора (Z) :
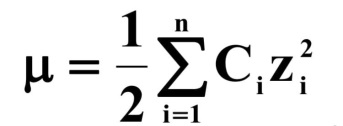
Физический смысл ионной силы раствора: она характеризует суммарную величину электрического поля, образованного всеми ионами раствора, на произвольно выбранный ион в этом растворе.
Ионная сила раствора позволяет определить коэффициент активности.
Исходя из методов Дебая, коэффициент активности не зависит от природы ионов, т.к. в этих уравнениях используется заряд ионов и ионная сила, связанная с концентрацией. Таким образом, эти уравнения не учитывают природу ионов.
17. Протолитические равновесия. Кислоты, основания, амфолиты по Бренстеду.
Протолитические равновесия, т. е. реакции, связанные с переносом протона (реакции нейтрализации, гидролиза и диссоциации).
Определение Бренстеда — Лоури. Данная система представлений характеризует кислоты вещества, высвобождающие протоны (доноры протонов), а основания — как вещества, способные соединяться с протонами (акцепторы протонов). Из этого следует, что реакция нейтрализации сводится к переносу протонов от кислоты к основанию. Такая взаимосвязь между кислотами и основаниями может быть выражена уравнениями, сумма которых представляет собой реакцию нейтрализации
А 1↔В1+ Н +
к о п
В 2 + Н + ↔ А2
о п к
А 1 + B2 ↔ А2 + В1
к о к о
Таким образом, реакция нейтрализации может рассматриваться как процесс, в котором осуществляется конкуренция за обладание протоном.
СНзСООН ↔ Н + +СНзСОО -
Из представлений Бренстеда — Лоури следует, что вода, как и другие вещества, способные не только отдавать, но и принимать к себе протоны, обладает амфотерными свойствами.
Согласно представлениям Бренстеда — Лоури сила кислоты определяется константой кислотности Ка. Исходя из равновесия: HA↔Н + + А -
К а=С(Н + )*С(А - )/С(НА)
Для осуществления этого равновесия в растворе необходимо присутствие акцептора протона, благодаря которому осуществляется переход протона от кислоты к основанию:
НА + В - ↔ НВ + А -
к о к о
Реакции данного типа называются протолитическими, количественная сторона которых характеризуется константой равновесия (константой протолиза):
К п = С(НВ)С(А - )/С(В - )С(НА)
Значения К для НА и НВ можно определить следующим путем:
К 1= С(Н + )*С(А - )/С(НА), К2 = С(Н + )*С(B - )/С(НB)
Тогда Кп = К 1/К2
Сила основания определяется константой основности Кb, которая соответствует равновесию
ВОН↔В + +ОН -
К b=С(OН - )*С(B + )/С(BOН)
При протолитическом равновесии образуются кислотно-основные пары. Согласно протонной теории, гидролиз, реакции ионизации и нейтрализации не рассматриваются как особое явление, а считаются обычным переходом протонов от кислоты к основанию.
+Реакции гидролиза, нейтрализации и ионизации являются частными случаями протолитических равновесий и называются реакциями протолиза. Равновесия, установившиеся в растворах между кислотами и сопряженными основаниями, называются протолитическими.
Многие гидроанионы, например HCO3-, являются в водном растворе амфолитами:
Приведем примеры записи уравнений гидролиза солей, включающих анион-амфолит:
(1) Na2HPO4= 2 Na+ + HPO42-
