
- •Вопросы к экзамену
- •Предмет химии. Химия и окружающая среда. Связь химии с медициной.
- •1.1) Предмет химии. Химия и окружающая среда
- •1.2) Химия и медицина
- •2.1) Основные понятия термодинамики
- •2.2. Типы термодинамических систем
- •2 .3)Параметры системы
- •2.4) Термодинамический процесс
- •3.1. Первое начало термодинамики
- •3.2) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •3.3) Закон Гесса.
- •3.4) Применение первого начала термодинамики к биосистемам.
- •4.1) Энергетические эффекты химических реакций. Факторы, влияющие на энергетический эффект химической реакции.
- •4.2) Термохимические уравнения.
- •4.3) Теплота и энтальпия химической реакции.
- •4.3) Закон Гесса и следствия из него.
- •5. Второе начало термодинамики. Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности. Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •5.1) Второе начало термодинамики
- •5.2) Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности.
- •5.3) Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •6.1) Изобарный потенциал реакции (свободная энергия Гиббса)
- •6.2) Критерий самопроизвольности реакций.
- •6.3) Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
- •7.1. Скорость химической реакции (средняя и истинная).
- •7.2. Закон действующих масс (к.Гульдберг и п.Вааге)
- •7.3. Молекулярность и порядок химических реакций.
- •Порядок реакции
- •7.4. Экспериментальное определение порядка реакции по одному из веществ и общего.
- •7.5. Факторы, влияющие на скорость химической реакции.
- •8. Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Ферментативный катализ.
- •8.1) Энергия активации Уравнение Аррениуса
- •8.2) Экспериментальное определение энергии активации
- •8.3) Катализ (гомогенный, гетерогенный).
- •Особенности катализатора
- •8.4) Автокатализ
- •8.5) Ферментативный катализ
- •8.6) Уравнение Михаэлиса-Ментен.
- •9. Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •10. Общая характеристика растворов. Компонент. Фаза. Гомогенные и гетерогенные системы.
- •11. Способы выражения концентрации растворов.
- •12. Растворимость. Механизмы растворения. Произведение растворимости.
- •Механизм растворения
- •2. Идеальные растворы.
- •3. Закон Рауля и следствия из него.
- •Рауль установил:
- •4. Осмос и осмотическое давление.
- •Закон Вант-Гоффа.
- •Закон Рауля применим для растворов неэлектролитов. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
- •Роль осмоса в биологических системах. Осмотическое давление крови человека – 740 – 780 кПа
- •14. Процесс электролитической диссоциации как взаимодействие веществ.
- •15. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •16. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •17. Протолитические равновесия. Кислоты, основания, амфолиты по Бренстеду.
- •18. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •19. Автопротолиз. Ионное произведение воды. РН.
- •1.Автопротолиз
- •2.Ионное произведение воды
- •20. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчет рН.
- •20.1) Гидролиз по катиону и аниону. Необратимый гидролиз
- •21. Буферные растворы, природные буферные системы. Расчет рН буферных систем, буферная ёмкость.
- •Расчет рН буферных систем
- •22. Кислоты и основания по Льюису.
- •23. Гетерогенные равновесия. Произведение растворимости.
- •24. Химическая связь: типы связи, механизмы образования, характеристики.
- •Типы связи
- •Механизмы образования химической связи
- •25. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1. Комплексные соединения (кс). Строение кс.
- •2. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1.Номенклатура кс
- •2.Классификация кс
- •3.Характер связи в кс
- •26. Диссоциация комплексных ионов. Константа нестойкости (устойчивости). Комплексообразование в организме.
- •26.1) Диссоциация комплексных ионов
- •26.2) Константа нестойкости (устойчивости).
- •Чем меньше Кнест, нет более прочно кс
- •26.3) Комплексообразование в организме.
- •27. Изомерия кс. Комплексообразование в организме. Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины.
- •Комплексообразование в организме.
- •28. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
- •29. Овр и их биологическая роль. Редокс-равновесия и редокс-процессы. Разновидности редокс-реакций. Электродные потенциалы, уравнение Нернста. Эдс гальванического элемента.
- •Классификация овр
- •Прогнозирование направления редокс-процессов по величинам редокс-потенциалов
- •Константа окислительно-восстановительного процесса
- •33. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •34. Методы очистки коллоидных растворов. Диализ, электродиализ, ультрафильтрация.
- •35. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •36. Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •37. Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди. Взаимная коагуляция. Значение коагуляции в медицине. Коллоидная защита и пептизация.
- •Значение в медицине
- •Коллоидная защита и пептизация
- •38. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Уравнение Гиббса.
- •38.1) Поверхностные явления и адсорбция.
- •38.2) Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Изотерма Ленгмюра
- •38.3) Изотерма Генри
- •Уравнение Гиббса ( , если сравнивается с водой)
- •40. Поверхностное натяжение и методы его определения.
- •41. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция.
- •42. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция.
- •43. Применение адсорбционных процессов в медицине.
- •44. Хроматография.
- •45. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул. Механизм набухания и растворения вмс. Зависимости величины набухания от различных факторов.
- •45.1) Свойства растворов вмс
- •45.2) Особенности растворения вмс как следствие их структуры.
- •45.3) Форма макромолекул
- •45.4) Механизм набухания и растворения вмс
- •П роцесс набухания количественно характеризуется степенью набухания, α:
- •45.5) Зависимости величины набухания от различных факторов.
- •48. Химия биогенных элементов s- блока.
- •49. Химия биогенных элементов d- блока.
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
- •50. Химия биогенных элементов р- блока.
- •Свойства р-элементов
- •Iiiа – группа
- •Iva группа
- •Viia – группа
11. Способы выражения концентрации растворов.
Способы выражения концентраций раствора
Концентрация раствора – кол-во растворённого вещества, содержащееся в определённом кол-ве раствора или растворителя.
Массовая доля компонента(ω) – отношение массы растворённого вещества к массе раствора:

Мольность (С) определяется числом моль вещества в единице объема раствора. В системе СИ она выражается в моль/м.
Молярная концентрация (СМ) равна числу моль растворенного вещества, содержащихся в 1 л раствора. (МОЛЬ/Л)
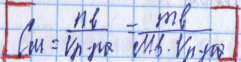
Нормальность (СН) или эквивалентная концентрация–равна числу моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора.(МОЛЬ-ЭКВ/Л)


Моляльная концентрация (Сm) равна числу моль растворенного вещества в 1000 г растворителя.

Мольной долей компонента называется число молей компонента, приходящихся на 1 моль раствора. Мольная доля компонента равна отношению числа молей компонента к сумме чисел молей всех компонентов в растворе:

Титр раствора(Т)– масса растворённого вещества(грамм) в 1 см3(1мл) раствора(г/см3)
Миллиграммпроцент(мг%)– внесистемная ед. массовой концентрации, использующаяся в медицине. Выражается отношение массы растворённого вещества(мг) в 100 см3 раствора [1 мг%= 1 мг/100 см3=10 мг/л=10 кг]
12. Растворимость. Механизмы растворения. Произведение растворимости.
Способность вещества растворяться в том или ином растворителе называется растворимостью.
Растворимость вещества (s) – это масса вещества, которая может раствориться при данных условиях в 100г растворителя с образованием насыщенного раствора.
S=m(s)/m (H2O) * 100(г)
Растворение можно рассматривать в виде следующих последовательных процессов:
А) Разрушение связей в исходном веществе с поглощением энергии (эндотермический процесс)
АВ=А+В
Б) Сольватация (гидратация) частиц А и В с образованием сольватов (гидратов) и выделением энергии ( экзотермический процесс)
А+Н2О=А*Н2О
В+Н2О=В*Н2О
Механизм растворения
При растворении происходит изменение структуры и свойств как растворенного вещества, так и растворителя. Между ними имеет место диполь - дипольное, ион - дипольное и другие взаимодействия. При этом возникают донорно-акцепторные, водородные и другие типы связей. Все виды взаимодействия между частицами Каблуков И. А. назвал сольватацией, а получающиеся продукты - сольватами, а в случае водных растворов - гидратацией и гидратами. Все эти процессы приводят к установлению равновесия в системе (∆G=0). Таким образом: истинные растворы - это гомогенные, равновесные, многокомпонентные системы, достигшие минимума ∆G за счет всех видов взаимодействия между всеми видами частиц.
Произведе́ние раствори́мости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости — величина постоянная.При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество.
ПР(MnAm)=[Mm+]n ·[An-]m
Из данного уравнения видно, что при увеличении концентрации катионов осадка уменьшается концентрация анионов (и наоборот), поскольку при возрастаний концентрации ионов Мm+ или An- увеличивается вероятность встречи между ними. При этом скорость осаждения увеличивается по сравнению со скоростью реакции растворения осадка, и поэтому концентрация других разновидностей ионов в растворе уменьшается.
Равновесные молярные концентрации ионов Mm+ и An- пропорциональны растворимости S (моль/л) вещества МnАm:
[Mm+] = n * S [An-] = m * S,
тогда ПР = (n * S)n ? (m * S)m (3.3)
По значениям ПР можно сравнивать растворимость различных веществ.
Численные значения произведения растворимостей приведены в справочниках .Пользуясь ими, можно вычислить растворимость малорастворимого электролита в системе: раствор - осадок.
13. Коллигативные свойства растворов. Идеальные растворы. Закон Рауля и следствия из него. Осмос и осмотическое давление. Закон Вант-Гоффа. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов. Роль осмоса в ох биологических системах.
Коллигативные свойства растворов.
Свойства растворов, которые зависят только от концентрации компонентов, но не зависят от их природы, называются коллигативными. К коллигативным свойствам растворов относят: 1) понижение давления насыщенного пара над раствором по сравнению с растворителем; 2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с растворителем; 3) осмотические явления.
