
- •Вопросы к экзамену
- •Предмет химии. Химия и окружающая среда. Связь химии с медициной.
- •1.1) Предмет химии. Химия и окружающая среда
- •1.2) Химия и медицина
- •2.1) Основные понятия термодинамики
- •2.2. Типы термодинамических систем
- •2 .3)Параметры системы
- •2.4) Термодинамический процесс
- •3.1. Первое начало термодинамики
- •3.2) Энтальпия. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции.
- •3.3) Закон Гесса.
- •3.4) Применение первого начала термодинамики к биосистемам.
- •4.1) Энергетические эффекты химических реакций. Факторы, влияющие на энергетический эффект химической реакции.
- •4.2) Термохимические уравнения.
- •4.3) Теплота и энтальпия химической реакции.
- •4.3) Закон Гесса и следствия из него.
- •5. Второе начало термодинамики. Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности. Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •5.1) Второе начало термодинамики
- •5.2) Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности.
- •5.3) Факторы, влияющие на изменение энтропии в ходе химической реакции.
- •6.1) Изобарный потенциал реакции (свободная энергия Гиббса)
- •6.2) Критерий самопроизвольности реакций.
- •6.3) Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме.
- •7.1. Скорость химической реакции (средняя и истинная).
- •7.2. Закон действующих масс (к.Гульдберг и п.Вааге)
- •7.3. Молекулярность и порядок химических реакций.
- •Порядок реакции
- •7.4. Экспериментальное определение порядка реакции по одному из веществ и общего.
- •7.5. Факторы, влияющие на скорость химической реакции.
- •8. Энергия активации. Экспериментальное определение энергии активации. Катализ (гомогенный, гетерогенный). Автокатализ. Ферментативный катализ.
- •8.1) Энергия активации Уравнение Аррениуса
- •8.2) Экспериментальное определение энергии активации
- •8.3) Катализ (гомогенный, гетерогенный).
- •Особенности катализатора
- •8.4) Автокатализ
- •8.5) Ферментативный катализ
- •8.6) Уравнение Михаэлиса-Ментен.
- •9. Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия. Смещение равновесия. Принцип Ле-Шателье.
- •10. Общая характеристика растворов. Компонент. Фаза. Гомогенные и гетерогенные системы.
- •11. Способы выражения концентрации растворов.
- •12. Растворимость. Механизмы растворения. Произведение растворимости.
- •Механизм растворения
- •2. Идеальные растворы.
- •3. Закон Рауля и следствия из него.
- •Рауль установил:
- •4. Осмос и осмотическое давление.
- •Закон Вант-Гоффа.
- •Закон Рауля применим для растворов неэлектролитов. Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов.
- •Роль осмоса в биологических системах. Осмотическое давление крови человека – 740 – 780 кПа
- •14. Процесс электролитической диссоциации как взаимодействие веществ.
- •15. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •16. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •17. Протолитические равновесия. Кислоты, основания, амфолиты по Бренстеду.
- •18. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •19. Автопротолиз. Ионное произведение воды. РН.
- •1.Автопротолиз
- •2.Ионное произведение воды
- •20. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчет рН.
- •20.1) Гидролиз по катиону и аниону. Необратимый гидролиз
- •21. Буферные растворы, природные буферные системы. Расчет рН буферных систем, буферная ёмкость.
- •Расчет рН буферных систем
- •22. Кислоты и основания по Льюису.
- •23. Гетерогенные равновесия. Произведение растворимости.
- •24. Химическая связь: типы связи, механизмы образования, характеристики.
- •Типы связи
- •Механизмы образования химической связи
- •25. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1. Комплексные соединения (кс). Строение кс.
- •2. Номенклатура кс. Классификация кс. Характер связи в кс.
- •1.Номенклатура кс
- •2.Классификация кс
- •3.Характер связи в кс
- •26. Диссоциация комплексных ионов. Константа нестойкости (устойчивости). Комплексообразование в организме.
- •26.1) Диссоциация комплексных ионов
- •26.2) Константа нестойкости (устойчивости).
- •Чем меньше Кнест, нет более прочно кс
- •26.3) Комплексообразование в организме.
- •27. Изомерия кс. Комплексообразование в организме. Термодинамические принципы хелатотерапии. Механизм цитотоксического действия соединений платины.
- •Комплексообразование в организме.
- •28. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
- •29. Овр и их биологическая роль. Редокс-равновесия и редокс-процессы. Разновидности редокс-реакций. Электродные потенциалы, уравнение Нернста. Эдс гальванического элемента.
- •Классификация овр
- •Прогнозирование направления редокс-процессов по величинам редокс-потенциалов
- •Константа окислительно-восстановительного процесса
- •33. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •34. Методы очистки коллоидных растворов. Диализ, электродиализ, ультрафильтрация.
- •35. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •36. Устойчивость дисперсных систем. Седиментационная, агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •37. Коагуляция. Порог коагуляции и его определение, правило Шульце-Гарди. Взаимная коагуляция. Значение коагуляции в медицине. Коллоидная защита и пептизация.
- •Значение в медицине
- •Коллоидная защита и пептизация
- •38. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Уравнение Гиббса.
- •38.1) Поверхностные явления и адсорбция.
- •38.2) Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Изотерма Ленгмюра
- •38.3) Изотерма Генри
- •Уравнение Гиббса ( , если сравнивается с водой)
- •40. Поверхностное натяжение и методы его определения.
- •41. Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция.
- •42. Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов. Правило выравнивания полярностей. Избирательная адсорбция.
- •43. Применение адсорбционных процессов в медицине.
- •44. Хроматография.
- •45. Свойства растворов вмс. Особенности растворения вмс как следствие их структуры. Форма макромолекул. Механизм набухания и растворения вмс. Зависимости величины набухания от различных факторов.
- •45.1) Свойства растворов вмс
- •45.2) Особенности растворения вмс как следствие их структуры.
- •45.3) Форма макромолекул
- •45.4) Механизм набухания и растворения вмс
- •П роцесс набухания количественно характеризуется степенью набухания, α:
- •45.5) Зависимости величины набухания от различных факторов.
- •48. Химия биогенных элементов s- блока.
- •49. Химия биогенных элементов d- блока.
- •1Б группа
- •II б группа
- •VII б группа
- •VIII б группа
- •50. Химия биогенных элементов р- блока.
- •Свойства р-элементов
- •Iiiа – группа
- •Iva группа
- •Viia – группа
4.2) Термохимические уравнения.
В термодинамике принята запись теплот химической реакции: С(тв)+О2(г)=СО2(г);
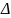 Нр=-405,8кДж
Нр=-405,8кДж
В термохимии: С(тв)+О2(г)=СО2(г)+405,8 кДж
В термохимии пользуются понятием «теплота (энтальпия) образования вещества». Под теплотой образования понимают тепловой эффект реакции образования одного моль вещества из простых веществ.
4.3) Теплота и энтальпия химической реакции.
Энтальпия – энергия расширенной системы, или внутреннее теплосодержание системы.
Для экзотермических реакций Q>0, ΔH<0
Для эндотермических реакций Q<0, ΔH>0
Принятие «стандартная теплота образования вещества» - тепловой эффект реакции образования одного моль вещества из простых веществ в стандартных условиях (ΔН0298) (при 298 К и 1 атм)
Теплота сгорания вещества(▵Hс)- тепловой эффект реакции сгорания его 1 моль с образованием устойчивых продуктов окисления:CO2, N2, H2O и т.д.
4.3) Закон Гесса и следствия из него.
Закон Гесса: тепловой эффект химических реакций, протекающих при постоянном давлении или постоянном объёме, не зависит от числа промежуточных стадий, а определяется лишь наскальным и конечным состоянии системы.
Первое следствие закона Гесса: теплота реакции равна сумме теплот сгорания начальных участников реакции за вычетом суммы теплот сгорания конечных участников реакции с учётом стехиометрических коэффициентов
ΔНр= ԐVнΔНсгор.н - ԐVкΔНсгор.к
Пример: аА+bB=dD
Нр=aΔHсгор(А)+вΔНсгор(В)-dΔHсгор(D)
Второе следствие закона Гесса: Теплота реакции равна сумме тёплое образования конечных веществ за вычетом суммы теплот образования начальных веществ с учётам стехиометрических коэффициентов
ΔHp°= ԐVкΔН°обр.к - ԐVнΔН°обр.н
Пример: aA+bB=cC+dD
ΔHp°= [C•ΔHобр°(С)+dΔHобр°(D)]-[aΔHобр°(A)+bΔHобр°(B)]
5. Второе начало термодинамики. Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности. Факторы, влияющие на изменение энтропии в ходе химической реакции.
5.1) Второе начало термодинамики
II закон термодинамики позволяет предсказать направление протекания процесса. Он имеет несколько формулировок:
• Постулат Клаузиуса
Единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому.
• Постулат Томсона
Теплота наиболее холодного из участвующих в процессе тел не может служить источником работы. (Теплота не может полностью перейти в работу).
• Вечный двигатель второго рода невозможен, т.е. невозможно построить
такую машину, которая производила бы работу за счет тепла окружающей
среды, не более нагретой, чем сама машина.
5.2) Понятие энтропии. Энтропия вещества, как функция термодинамической вероятности.
Энтропия – функция состояния термодинамической системы, используемая во втором законе т/д для выражения через нее возможности или невозможности самопроизвольного протекания процесса (введена Клаузиусом)
Неравновесный процесс, протекающий в направлении достижения равновесия без воздействия внешних условий, называется самопроизвольным (положительным). Обратный по направлению процесс, который не может протекать без внешних воздействий и удаляющий систему от равновесия называется не самопроизвольным (отрицательным).
Изменение энтропии определяется отношением количества теплоты, сообщенного системе или отведенного от нее, к температуре системы, где знак равенства относится к равновесному процессу, неравенства – к неравновесному.
dS≥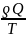
Т.о.
в равновесном процессе: S
=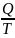 .(математическая формула)
.(математическая формула)

По изменению энтропии в изолированной системе можно предсказать т/д возможность протекания самопроизвольного неравновесного процесса.
Если энтропия увеличивается (S > 0), то самопроизвольный неравновесный процесс возможен, если S < 0 – невозможен.
Т.о. все самопроизвольные процессы в изолированных системах идут в сторону увеличения энтропии до достижения равновесия, где она будет иметь постоянное и максимальное значение.
В современной термодинамике второе начало термодинамики изолированных систем формулируется единым и самым общим образом как закон возрастания особой функции состояния системы, которую Клаузиус назвал энтропией (S).
Физический смысл энтропии состоит в том, что в случае, когда материальная система находится в полном термодинамическом равновесии, элементарные частицы, из которых состоит эта система, находятся в неуправляемом состоянии и совершают различные случайные хаотические движения.
Энтропия - физическая величина, количественно характеризующая особенности молекулярного строения системы, от которых зависят энергетические преобразования в ней.
