
- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
Получение гидроксидов
Растворимые основания (щелочи) в лаборатории можно получить при взаимодействии активных металлов и их оксидов с водой:
CaO + H2O = Ca(OH)2.
Щелочи гидроксид натрия и гидроксид кальция получают электролизом водных растворов хлорида натрия и хлорида калия.
Нерастворимые в воде основания получают по реакции солей с щелочами в водных растворах:
FeCl3+ 3NaOHaq= Fe(OH)3↓ + 3NaCl. Химические свойства гидроксидов
Растворимые и нерастворимые основания имеют общее свойства: они реагируют с кислотами с образованием солей и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O; Cu(OH)2+ 2HCl = CuCl2+ H2O.
Растворы щелочей изменяют цвет некоторых веществ – лакмуса, фенолфталеина и метилового оранжевого, называемых индикаторами (табл. 1).Таблица 1. Изменение цвета индикаторов под воздействием растворов кислот и оснований.
-
Индикатор
Цвет индикатора в среде
кислой
щелочной
нейтральной
Лакмус
Красный
Синий
Фиолетовый
Фенолфталеин
Бесцветный
Малиновый
Бесцветный
Метиловый оранжевый
Розовый
Желтый
Оранжевый
Кроме общего свойства, щелочи и нерастворимые в воде основания обладают также специфическими. Например, при нагревании голубого осадка гидроксида меди (II) образуется вещество черного цвета – это оксид меди (II):
Cu(OH)2= CuO + H2O.
Щелочи, в отличие от нерастворимых оснований, при нагревании обычно не разлагаются. Их растворы действуют на индикаторы, разъедают органические вещества, реагируют с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
Fe2(SO4)3+ 6KOH = 2Fe(OH)3↓ + 3K2SO4; 2KOH + CO2= K2CO3+ H2O.
Соли - это сложные вещества, которые диссоциируют, образуя катионы металла (или NH4+) и анионы кислотного остатка. Кислые соли при диссоциации дают дополнительно ионы H+, а основные соли - ионы гидроксила OH-. Среди солей выделяют двойные, смешанные и комплексные.
Получение
Взаимодействием металлов и металло-неметаллов с неметаллами: 2Na + Cl2 = 2NaCl,
2Al + 3Cl2 = 2AlCl3.
Взаимодействием неметаллов с другими солями: 2KI + Br2 = 2KBr + I2Ї, 2KBrO3 + I2 = 2KIO3 + Br2.
Вытеснением более активным металлом более поссивного из его соли: CuSO4 + Fe = FeSO4 + Cu.
Взаимодействием основных, амфотерных и кислотных оксидов: Li2O + ZnO = Li2ZnO2,
CaO + SiO2 = CaSiO3, Al2O3 + 3SO3 = Al2(SO4)3.
Взаимодействием основных, амфотерных и кислотных оксидов с основными, амфотерными и кислотными гидроксидами:
2LiOH + ZnO = Li2ZnO2 + 2H2O, Ca(OH)2 + CO2 = CaCO3 + H2O, Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O.
Взаимодействием основных, амфотерных гидрооксидов с кислотами: Al(OH)3 + KOH = K[Al(OH)4],
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O, Zn(OH)2 + 2HBr = ZnBr2 + 2H2O.
Путем обменных реакций основных, амфотерных гидрооксидов, кислот и солей с солями: Ba(OH)2 + Na2SO4 = BaSO4 + 2NaOH,
Ca(OH)2 + Ca(HCO3)2 = 2CaCO3 + 2H2O, KOH + AlCl3 = Al(OH)Cl2 + KCl,
H2SO4 + Ba(NO3)2 = BaSO4+ 2HNO3, HCl + Mg(OH)Cl = MgCl2 + H2O, Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2, FeCl3 + 3 KSCN = Fe(SCN)3 + 3KCl.
Термическим разложением солей: 2KClO3 = 2KCl + 3O2¬,
2NaNO3 = 2NaNO2 + O2¬.
![]() Свойства
Свойства
Диссоциируют в растворах или расплавах:
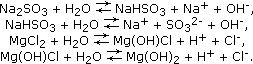 Способны
подвергаться гидролизу (кроме солей,
образованных одновременно
сильными
одноосновными кислотами и щелочными
металлами):
Способны
подвергаться гидролизу (кроме солей,
образованных одновременно
сильными
одноосновными кислотами и щелочными
металлами):
Могут взаимодействовать с основными и амфотерными гидроксидами, кислотами и солями, вступая в реакции обмена (смотри выше: пункт 7).
Способны вступать в многочисленные окислительно-восстановительные реакции, реакции диспропорционирования:
3KClO = KClO3 + 2KCl,
2FeCl3 + H2S = S + 2FeCl2 + 2HCl.
Как пример реакций получения комплексных солей рассмотрим образование и использование красной и желтой кровяной соли:
FeCl2 + 6KCN = 2KCl + K4[Fe(CN)6] , FeCl3 + 6KCN = 3KCl + K3[Fe(CN)6] ,
3 FeCl2 + 2 K3[Fe(CN)6] = 6KCl + Fe3[Fe(CN)6]2,
4 FeCl3 + 3 K4[Fe(CN)6] = 12KCl + Fe4[Fe(CN)6]3.
K4[Fe(CN)6] - гексоцианоферрат (II) калия или желтая кровяная соль, K3[Fe(CN)6] - гексоцианоферрат (III) калия или красная кровяная соль, Fe3[Fe(CN)6]2 - гексоцианоферрат (III) железа (II) или турнбулева синь, Fe4[Fe(CN)6]3 - гексоцианоферрат (II) железа (III) или берлинская лазурь.
Примером двойной соли могут служить алюмокалиевые квасцы KAl(SO4)2 - здесь два разных катиона и один анион:
Примером смешанной соли является хлорная известь Ca(OCl)Cl. При ее диссоциации образуется один катион Ca2+ и два аниона Cl- и OCl-.
