
- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
48. Ферментативный катализ, его особенности и значение в биологических процессах.
Ферментативный катализ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, называемых ферментами (энзимами).
Важнейшие особенности ферментативного катализа - эффективность, специфичность и чувствительность к регуляторным воздействиям.
49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
Буферные системы – растворы, способные сохранять приблизительно постоянное значение рН, при добавлении к ним небольших количеств сильных кислот и оснований.
Буферные растворы – смеси, состоящие из слабой кислоты и ее соли или слабого основания и его соли.

Расчет ph
Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+).
В живых организмах буферные системы поддерживают постоянство рН в крови и тканях. В процессе обмена в живом организме образуются большие количества кислых продуктов. В организме человека особенно большую роль играют белковый, бикарбонатный и фосфатный буферы.
50. Электропроводность растворов электролитов
Электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода). Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора

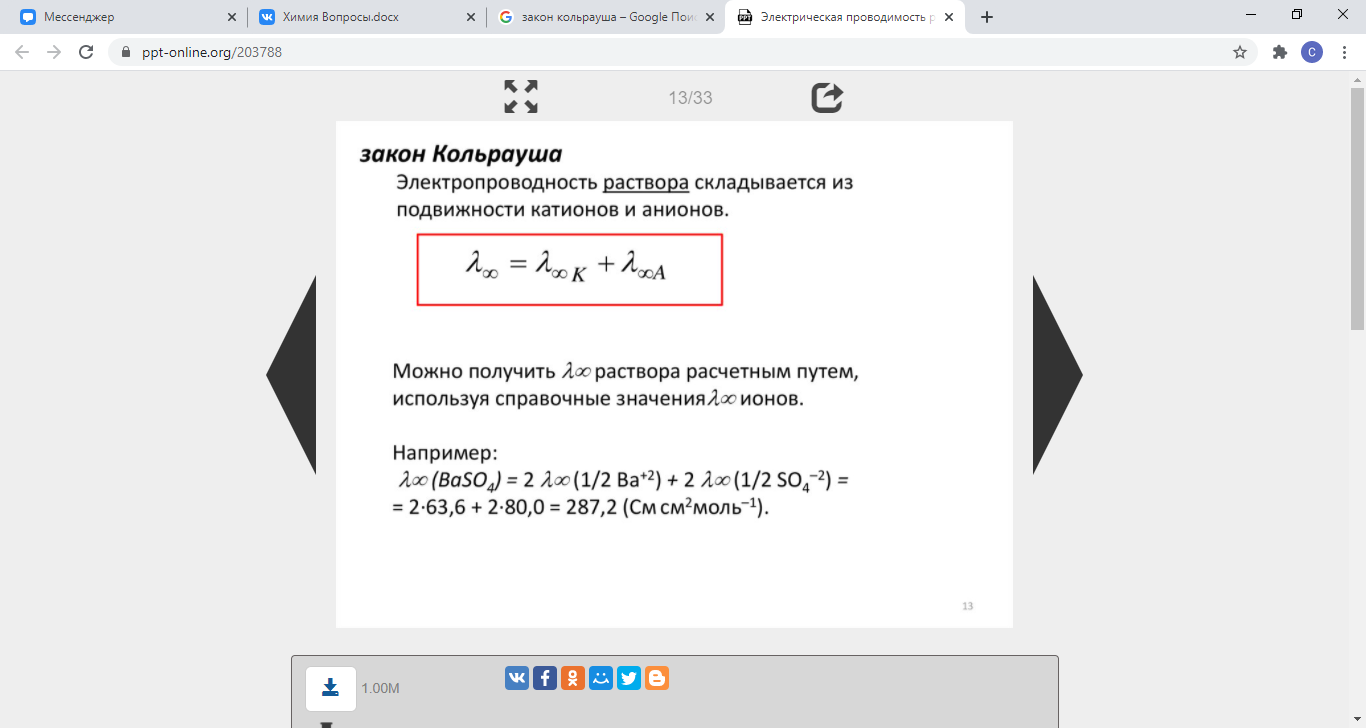
51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
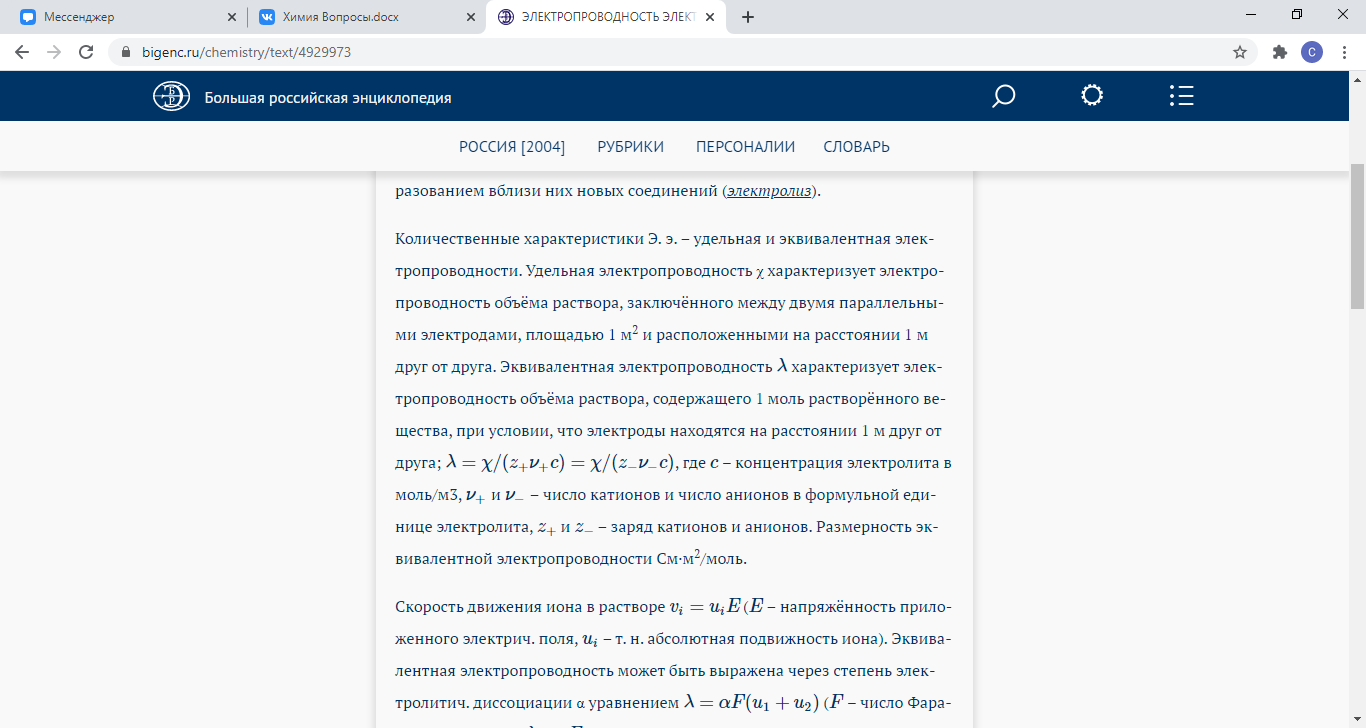
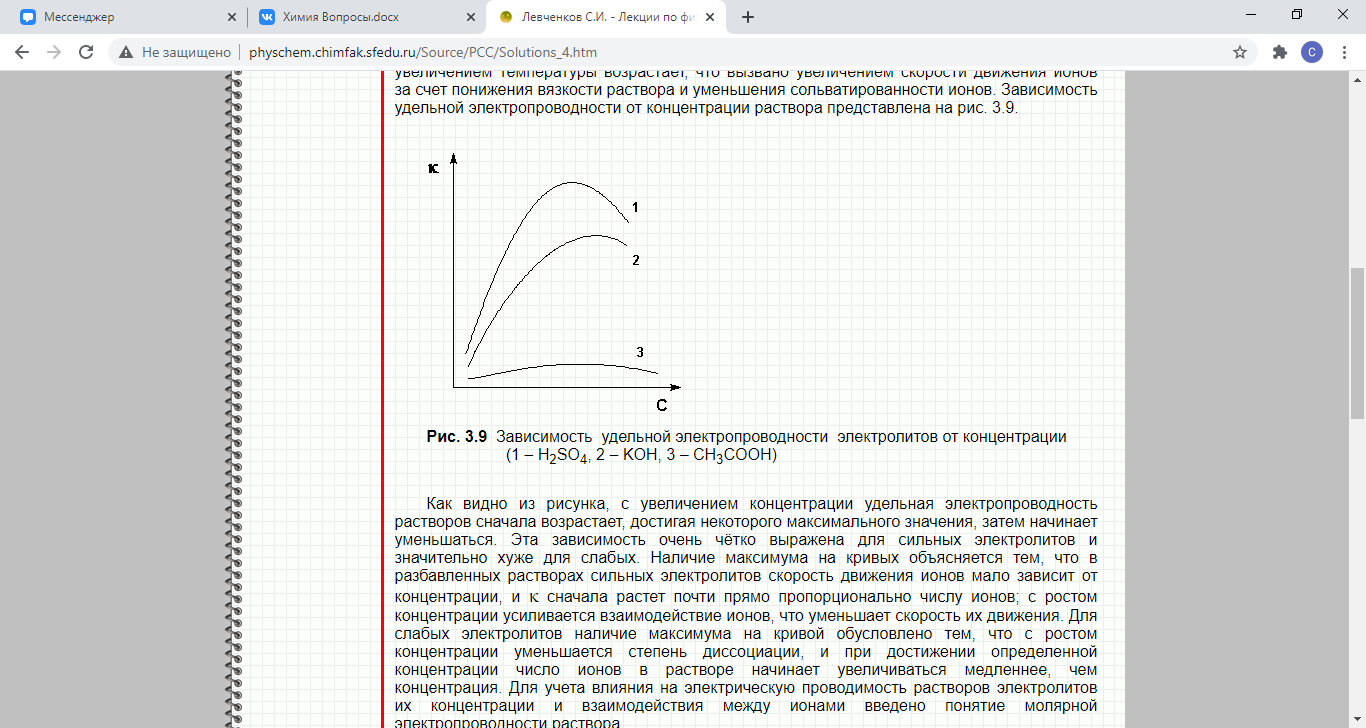
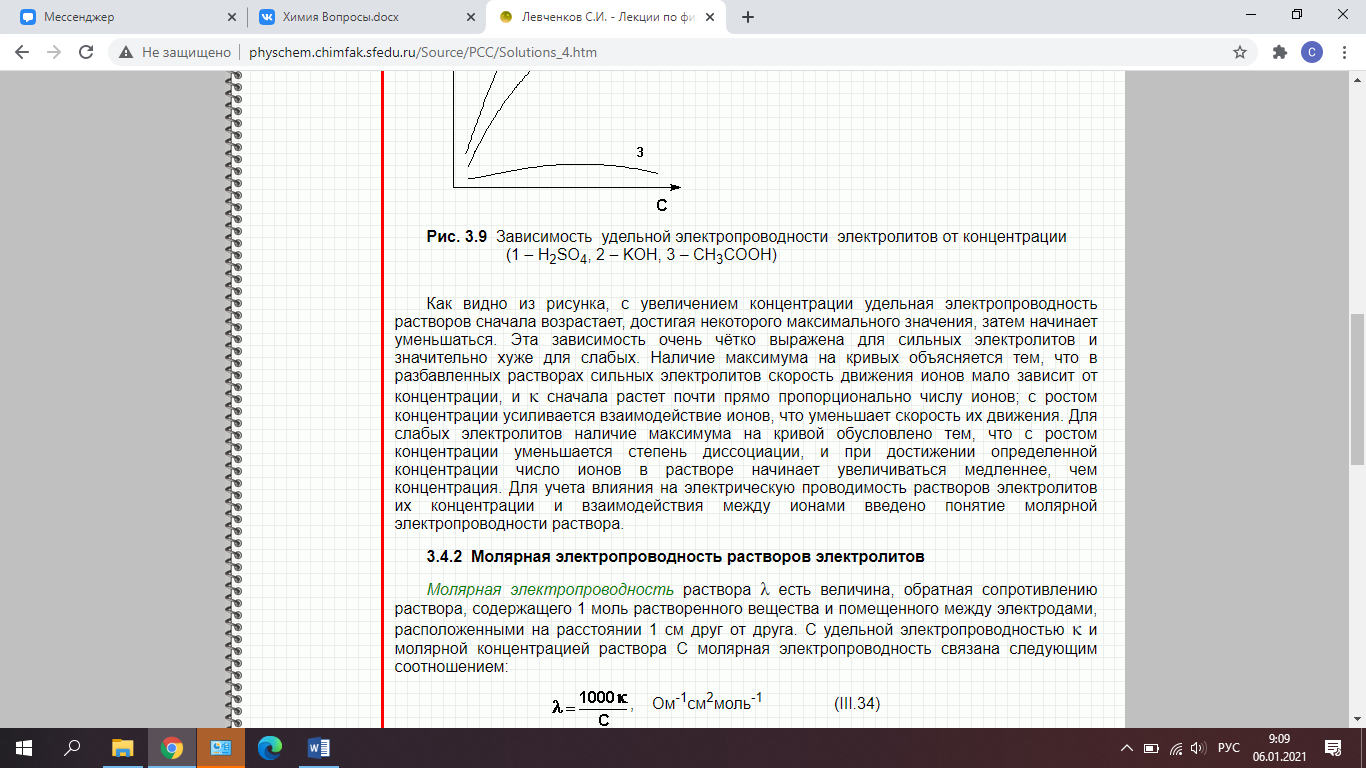
Величина преимущественного передвижения иона в направлении одного из электродов при прохождении тока через раствор отнесённая к градиенту потенциала 1 В/см, есть абсолютная скорость движения иона.

52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
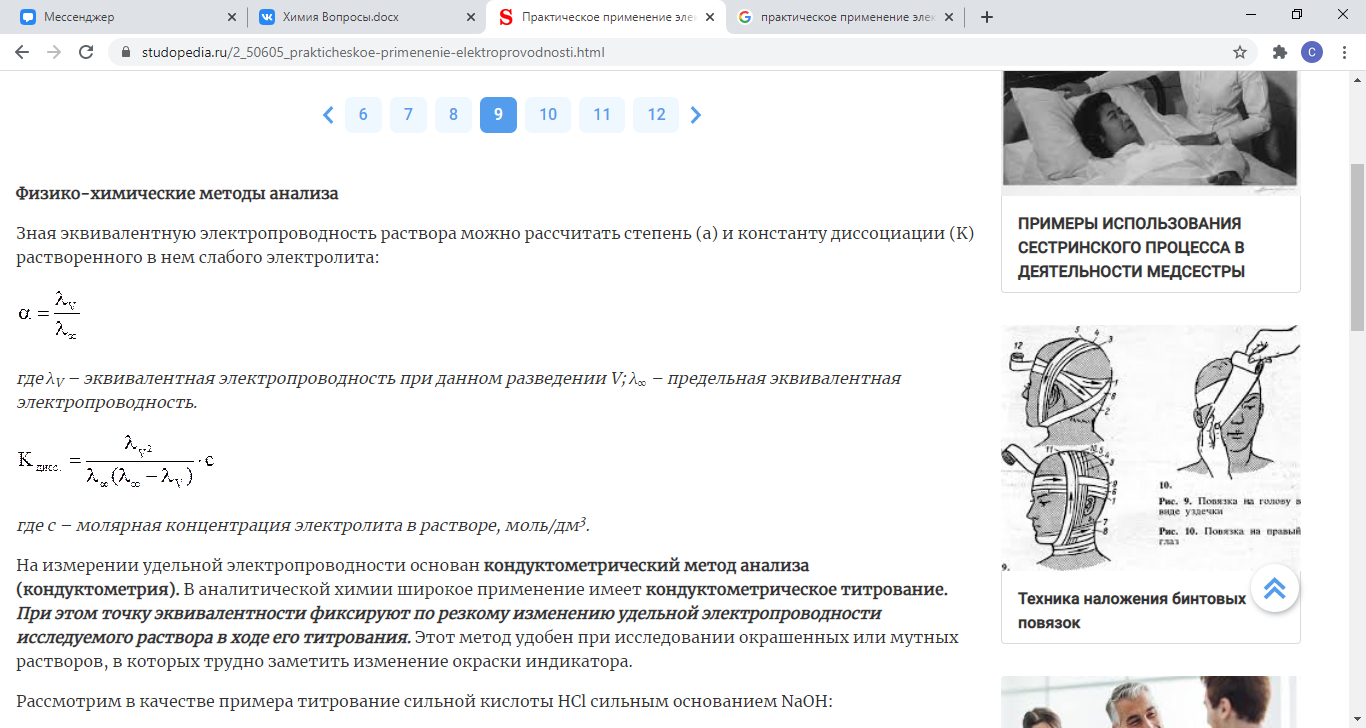
Зная эквивалентную электропроводность раствора можно рассчитать степень (a) и константу диссоциации (K) растворенного в нем слабого электролита:
 где
λV – эквивалентная электропроводность
при данном разведении V; λ∞ – предельная
эквивалентная электропроводность.
где
λV – эквивалентная электропроводность
при данном разведении V; λ∞ – предельная
эквивалентная электропроводность.
где с – молярная концентрация электролита в растворе, моль/дм3.
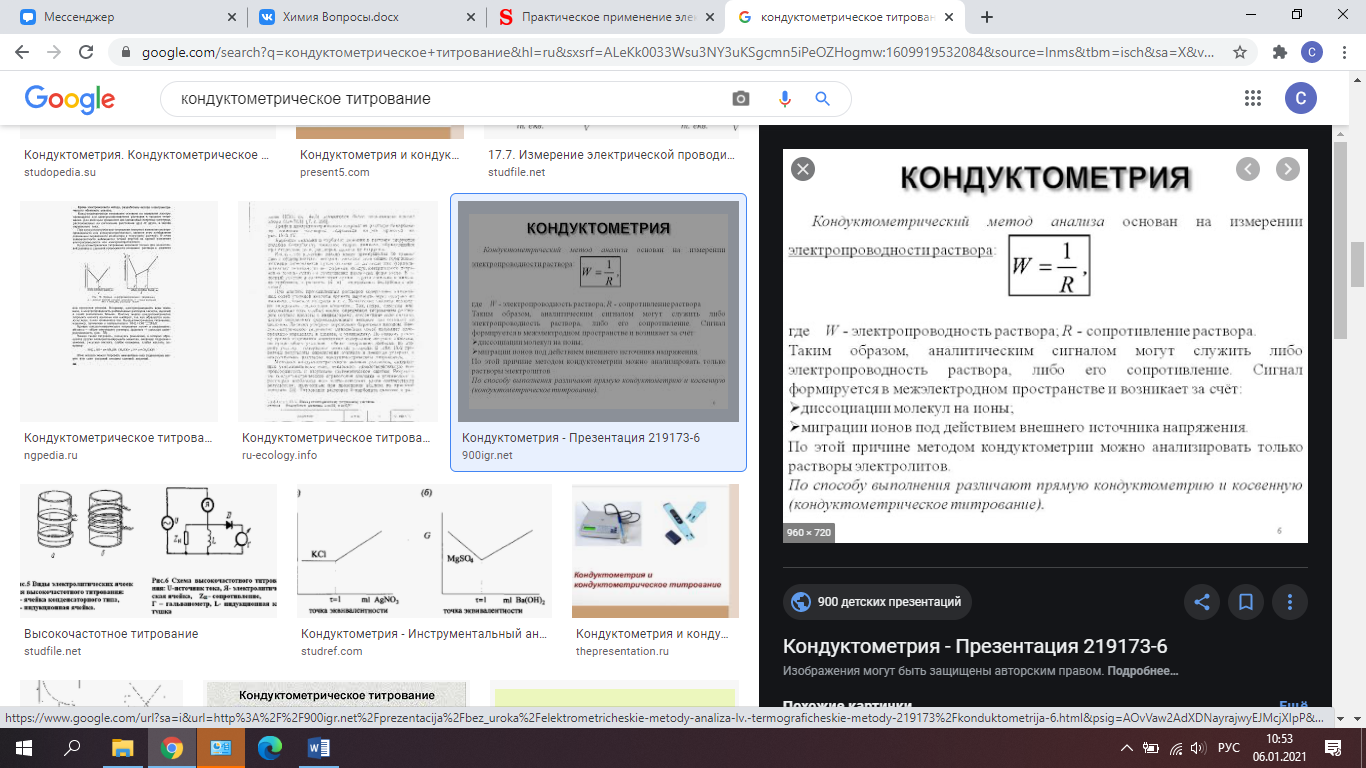
На измерении удельной электропроводности основан кондуктометрический метод анализа (кондуктометрия). В аналитической химии широкое применение имеет кондуктометрическое титрование. При этом точку эквивалентности фиксируют по резкому изменению удельной электропроводности исследуемого раствора в ходе его титрования. Этот метод удобен при исследовании окрашенных или мутных растворов, в которых трудно заметить изменение окраски индикатора.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных системах.
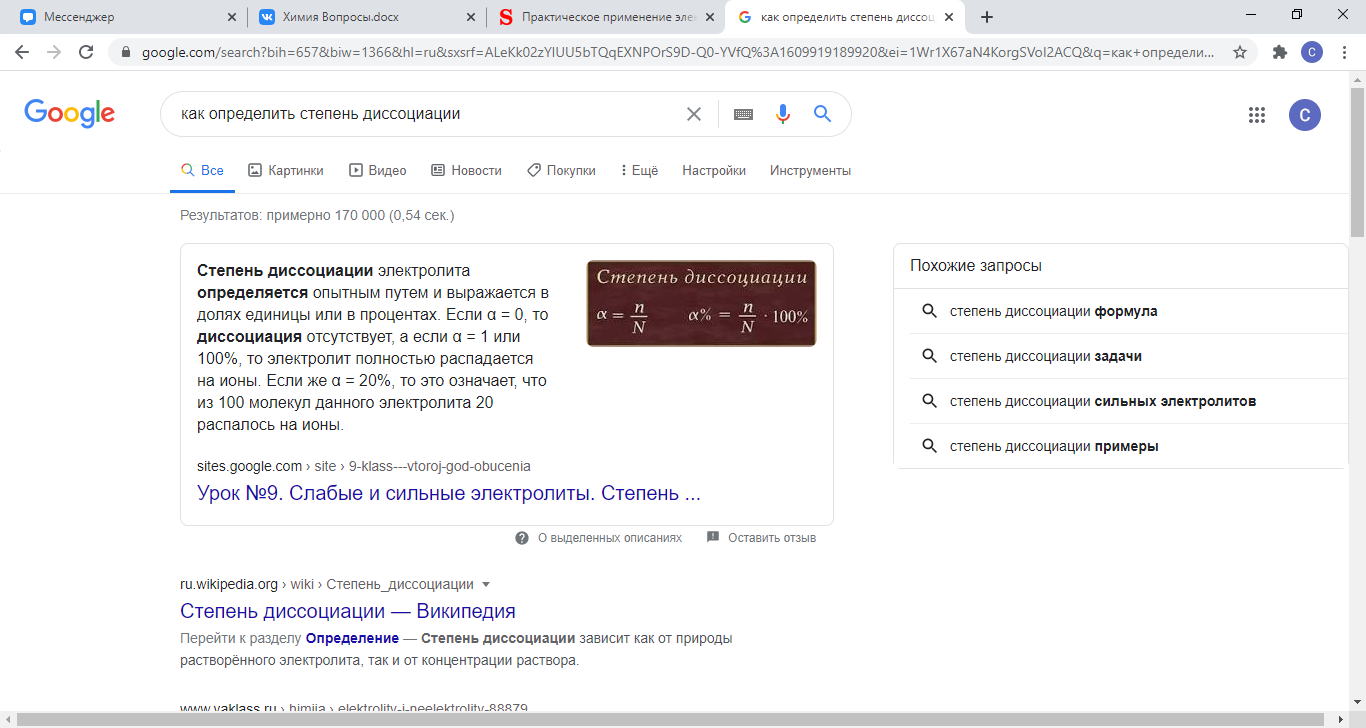
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать обратимым образом на маленькие объекты. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации.
В случае слабых электролитов константа диссоциации определяется по формуле: KD = (αCM · αCM)/CM(1 - α) = α2CM/(1 - α).

Метод титрования, при котором точку эквивалентности фиксируют по резкому изменению электропроводности исследуемого раствора, называют кондуктометрическим титрованием.
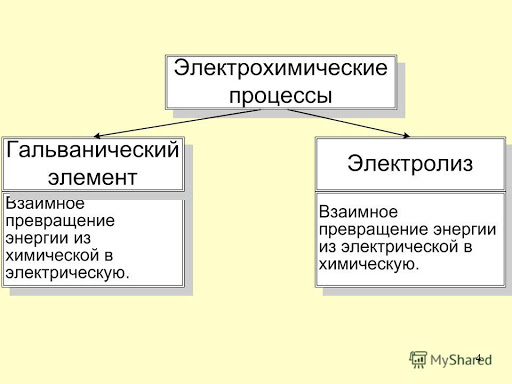
53. Электрохимические процессы. Двойной электрический слой и его строение.гальванические элементы. Электродные потенциалы и ЭДС гальванического элемента. Стандартный электродный потенциал. Уравнение Нернста.
Электрохимические процессы – процессы взаимного превращения электрической формы энергии в химическую.
Двойной электрический слой — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз.
Двойной электрический слой представляет собой слой ионов, образующийся на поверхности частицы в результате адсорбции ионов из раствора или диссоциации поверхностных соединений. Таким образом, двойной электрический слой состоит из потенциалопределяющих ионов и слоя противоионов, расположенных в дисперсионной среде.

Электро́дные проце́ссы (электродные реакции) — электрохимические превращения, связанные с переносом электронов через границу раздела фаз электрод—электролит.

В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей)

Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
