
- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
Квантовые числа: главное, побочное, магнитное, спиновое
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами.
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1).
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
Значение n |
0 |
1 |
2 |
3 |
4 |
Обозначение слоя |
s |
p |
d |
f |
g |
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принципы заполнения электронных орбиталей атома: принцип Паули, правило Хунда, принцип наименьшей энергии, правило Клечковского. Электронные емкости орбиталей, подуровней и уровней атома. Способы записи электронных формул. Валентные уровни атома.
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2.
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение
энергетических уровней происходит
таким образом, чтобы суммарный спин был
максимальным. Например,
три р-электрона на орбиталях р-оболочки
располагаются следующим образом:![]()
Таким образом, каждый электрон занимает одну р-орбиталь
Первое правило Клечковского. При заполнении электронных оболочек в атоме в первую очередь заполняются те подуровни, для которых сумма главного и побочного квантовых чисел (п + ?) минимальна.
В четвертом периоде идет заполнение 45-подуровня п + I = 4 + + 0 = 4, а потом лишь 3d, для которого п + ? = 3 + 2 = 5. По этому правилу заполнение ^/-подуровней запаздывает на один период, а заполнение /-подуровней — на два периода (4/-подуровень заполняется лишь в шестом периоде, а 5/-подуровень — лишь в седьмом).
Второе правило Клечковского. Если для двух подуровней одного или разных уровней суммы (п + ?) равны, то сначала заполняется подуровень с меньшим значением п.

Принцип Паули служит для определения электронной ёмкости атомной орбитали.
Конкретная атомная орбиталь представляет собой квантовую ячейку с конкретным набором чисел n, l и ml.. Атомная орбиталь может содержать максимум 2 электрона с противоположными (антипараллельными) спинами: для одного из электронов ms=+1/2, для другого электрона ms=-1/2. Электроны с антипараллельными спинами, принадлежащие одной и той же атомной орбитали, принято называть спаренными; если атомная орбиталь содержит один электрон, он называется неспаренным; атомная орбиталь, не содержащая электронов, называется вакантной1.
Электронная ёмкость энергетического подуровня определяется числом атомных орбиталей в подуровне и, исходя из ёмкости каждой АО, численно равна 2(2l+1), а именно:
Энергетический подуровень s p d f
Число АО в подуровне (2l+1) 1 3 5 7
Электронная ёмкость подуровня 2(2l+1) 2 6 10 14
Электронная ёмкость энергетического уровня определяется ёмкостью составляющих его энергетических подуровней и численно равна 2n2, где n – значение главного квантового числа для электронов рассматриваемого энергетического уровня.
Способы записи электронных формул:
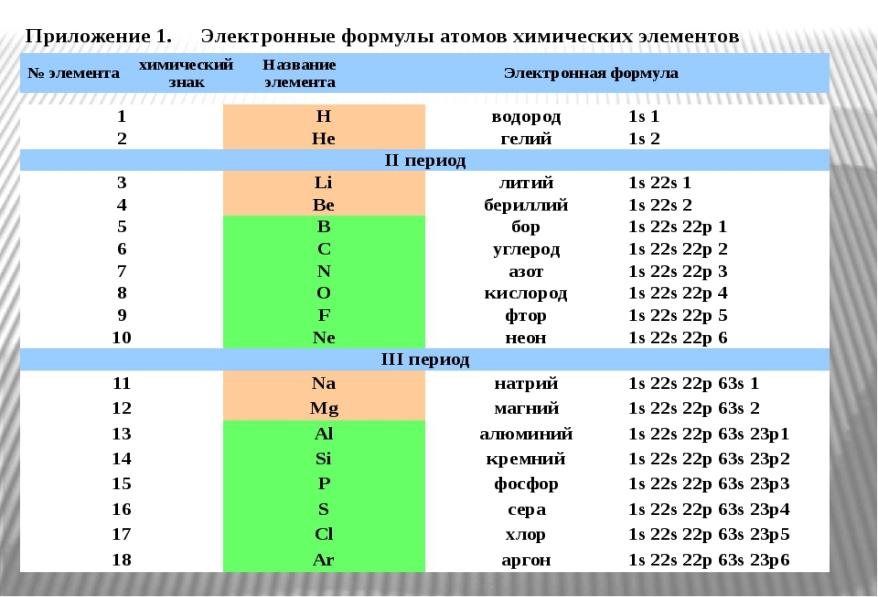
Наиболее простой способ – запись по электронным оболочкам. При этом указываются заряд ядра и количество электронов на каждый электронной оболочке по мере увеличения её номера.
Как было показано ранее, максимальное число электронов по n электронной оболочке равно 2n2. Тогда на первой оболочке может разместиться максимум два электрона, а на второй не более 8. Однако, у атома азота всего семь электронов (общее число электронов в атоме равно заряду ядра), поэтому на второй оболочке разместятся остальные 7 – 2 = 5 электронов. В положительно заряженном ионе азота заряд ядра превышает суммарный заряд электронов на +1, поэтому число электронов в данном ионе на один меньше, чем в атоме. При этом удаляют электрон с внешней электронной оболочки.
Электронные оболочки и подоболочки. Этот метод записи электронных конфигураций используют наиболее часто. Номер электронной оболочки (главное квантовое число) указывают цифрой, а тип подоболочки (орбитальное квантовое число) – буквой s-, p-, d- или f-. Количество электронов указывается цифрой справа вверху у символа подоболочки. Для атома и иона азота данная запись имеет следующий вид:
7N 1s22s22p3 7N+ 1s22s22p2.
В соответствии с максимальной возможной заселенностью s-подоболочек, равной 2, первые четыре электрона полностью заполняют первую и вторую подоболочки. Оставшиеся электроны размещаются на р-подоболочке.
Электронные оболочки, подоболочки и заселенность орбиталей.
в данном способе учитывают максимальное количество атомных орбиталей (АО) электронной подоболочки и производят размещение электронов среди них в соответствии с правилом Фридриха Хунда (Гунда): электроны в атоме размещаются таким образом, чтобы занять возможно большее число атомных орбиталей, чтобы абсолютное значение суммарного спина было максимальным.
![]()
Существует другая форма записи графических электронных формул в виде ячеек.
Каждая такая ячейка обозначается: клетка – орбиталь, стрелка – электрон, направление стрелки – направление спина, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении.
Орбитали р-подуровня заполняются так: сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами. Поскольку на 2р-подуровне три орбитали с одинаковой энергией, то каждый из двух 2р-электронов занимает по одной орбитали (например, рхи ру). Одна орбиталь остается свободной (рz). Таким образом, у атома углерода два неспаренных электрона.
Валентные уровни атома:
Валентность – это способность атома образовывать химические связи.
Количество ковалентных связей, которые может образовывать атом, называется валентностью элемента. Валентные возможности атомов обусловлены наличием валентных электронов на внешнем энергетическом уровне.
В зависимости от возможности переходить в возбуждённое состояние элементы делятся на две группы: с переменной и постоянной валентностью. Постоянную валентность (соответствует номеру группы) имеют щелочные, щелочноземельные металлы, фтор и алюминий. Переменная валентность присуща всем остальным элементам. Инертные газы не вступают в реакции, поэтому считается, что валентность у них отсутствует.
Принцип запрета Паули: Два электрона в атоме не могут находиться в одном состоянии.
