- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
Коллоидные системы представляют собой ультрамикрогетерогенни системы преимущественно типа «твердое тело измельченные в растворителе». Частицы дисперсной фазы имеют размеры от 10 - до 10-9 м. Значительная поверхность распределения создает в коллоидных системах большой запас поверхностной энергии Гиббса, из-за чего эти системы термодинамически неустойчив. В коллоидных системах легко протекают самовольные процессы, приводящие к снижению запаса поверхностной энергии: адсорбция, коагуляция, образование макроструктур. Благодаря гетерогенности коллоидные растворы способны рассеивать свет. Если наблюдать за коллоидными растворами при прохождении через них света, то они кажутся прозрачными, но при боковом освещении видим конус получил название конуса Тиндаля. Размеры частиц дисперсной фазы позволяют им проходить сквозь бумажные фильтры, но они задерживаются мембранами (пергаментом, целлофаном и т.п.). Коллоидные является кинетически относительно устойчивыми, со временем стареют. Под действием силы тяжести в коллоидах наблюдается направленное перемещение фаз более плотной вниз, а менее плотной - вверх.
Коллоидные системы по степени дисперсности занимают промежуточное положение между истинными растворами (молекулярно- или ионно-дисперсными системами) и грубодисперсными системами. Поэтому коллоидные растворы могут быть получены либо путем ассоциации (конденсации) молекул и ионов истинных растворов, либо дальнейшим раздроблением частиц дисперсной фазы грубодисперсных систем.
Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации, который будет рассмотрен позднее). Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговы распылением металлов, дроблением вещества при помощи ультразвука.
Методы конденсации
Вещество, находящееся в молекулярно-дисперсном состоянии, можно перевести в коллоидное состояние при замене одного растворителя другим – т.н. методом замены растворителя. В качестве примера можно привести получение золя канифоли, которая не растворяется в воде, но хорошо растворима в этаноле. При постепенном добавлении спиртового раствора канифоли к воде происходит резкое понижение растворимости канифоли, в результате чего образуется коллоидный раствор канифоли в воде. Аналогичным образом может быть получен гидрозоль серы.
Мицеллярная теория строения коллоидной частицы.
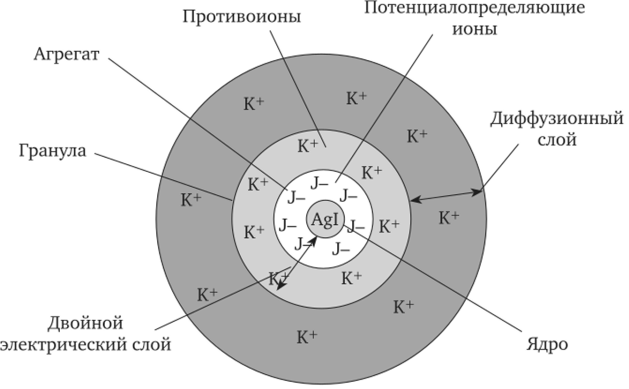
Коллоидная мицелла имеет более сложное строение, чем обычные молекулы. В ней различают две основные части: внутреннюю (нейтральную) — ядро, состоящее из молекул, и внешнюю часть — ионогенную, состоящую из двух слоев (адсорбционного и диффузного).
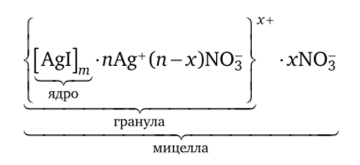
Например, получим золь иодида серебра в избытке нитрата серебра:
![]()
Мицелла иодида серебра состоит из следующих частей:
1) ядро — микрокристаллы иодида серебра;
2) в избытке — нитрат серебра, поэтому в растворе избыток положительных ионов серебра, которые входят в состав молекул Agl и поэтому адсорбируются на ядре;
3) часть отрицательных нитрат-ионов притягивается к адсорбированным ионам серебра, образуя адсорбционный слой противоионов;
4) в результате этих процессов образовалась коллоидная частица — гранула, которая имеет положительный заряд и может перемещаться как единое целое;
5) оставшиеся нитрат-анионы достраивают диффузный слой противоионов — образуется мицелла
Записывают строение мицеллы следующим образом:
На поверхности ядра адсорбируются ионы, одноименные с ионами, входящими в состав ядра, и находящиеся в избытке — они являются стабилизаторами, дальнейший рост ядра прекращается. Такие ионы получили название потенциалопределяющих ионов. Например, если золь иодида серебра получают в избытке иодида калия, то потенциало- пределяющими ионами будут иодид-анионы, а противоионами — катионы калия.
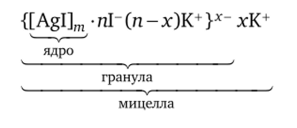
Коллоидная частица в данной мицелле будет заряжена отрицательно, а противоионы калия — положительно