
- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
Основные положения метода валентных связей:
химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар (обобществления двух электронов);
энергия обмена электронами между атомами (в результате перекрывания орбиталей) вносит основной вклад в энергию химической связи;
в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами;
характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО.
Условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
Ковалентная связь может быть образована атомами одного и того же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная, например, Н2О, NF3 и др.
Направленность ковалентной связи.
Перекрывание электронных облаков происходит по определенным направлениям, так как атомные орбитали пространственно ориентированы, что и обуславливает направленность ковалентной связи.
В зависимости от способа перекрывания и симметрии образующегося облака различают- (сигма) и - (пи) связи.
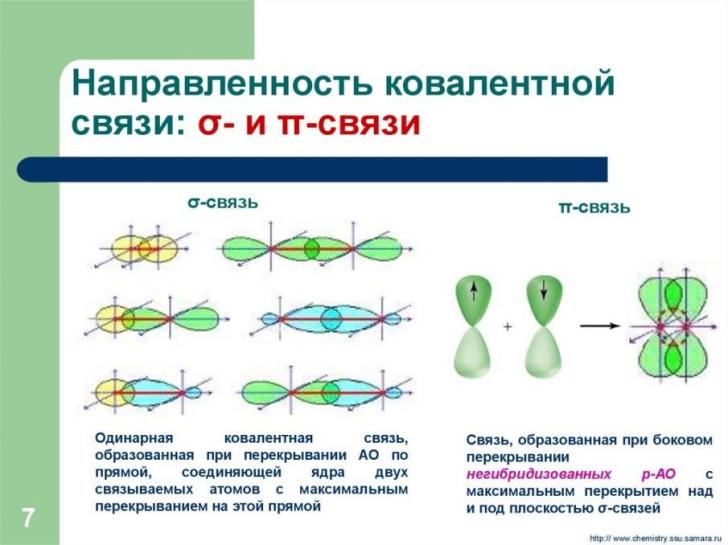 Связь,
образованная перекрыванием АО по линии,
соединяющей ядра
взаимодействующих
атомов, называется σ – связью. Сигма-связь
может возникать при перекрывании s
–
Связь,
образованная перекрыванием АО по линии,
соединяющей ядра
взаимодействующих
атомов, называется σ – связью. Сигма-связь
может возникать при перекрывании s
–
орбиталей, s –, p – орбиталей, р – орбиталей, d – орбиталей, а также d – и s – орбиталей, и f –
орбиталей с друг другом и другими орбиталями. Сигма – связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей, p – d-орбиталей, d – d-орбиталей , а также f – p-, f – d- и f – f- орбиталей.
Геометрия молекулы формируется за счет фиксированного взаимного расположения атомов и значений валентных углов.
Валентный угол — это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Можно также сказать, что это угол между двумя линиями- связями, имеющими общий атом.
Линия связи — это линия, соединяющая ядра двух химически связанных атомов.

В молекуле аммиака NH3 три связи N–H образованы «чистыми» (т.е. негибридизованными) 2р-орбиталями азота. Молекула должна иметь пирамидальную форму: в вершине пирамиды – атом азота, угол между связями – 90°. Однако экспериментально измеренный угол составляет ~107,8°, что значительно лучше согласуется с тетраэдрической конфигурацией, характерной для sp3 гибридизации. Это можно объяснить, если предположить, что в гибридизации принимает участие орбиталь неподеленной
(несвязывающей) пары электронов:
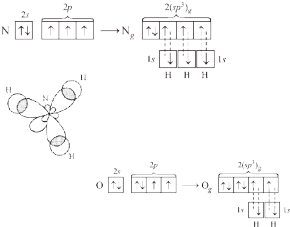
Перекрывание орбиталей в молекуле NH3
Перекрывание орбиталей в молекуле NH3
С этих же позиций участием орбиталей двух неподеленных пар электронов в sp3 гибридизации можно объяснить строение молекулы воды, в которой угол между связями О–Н равен~104,5°:
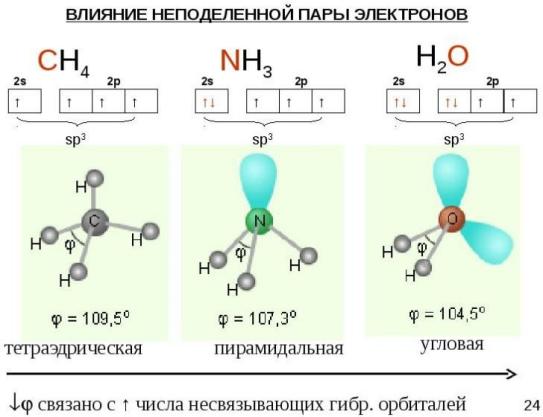 Вследствие
более сильного отталкивающего действия
неподеленных (несвязывающих) электронных
пар валентные углы в молекулах NН3 и Н2О
оказываются несколько меньше
тетраэдрического.
Вследствие
более сильного отталкивающего действия
неподеленных (несвязывающих) электронных
пар валентные углы в молекулах NН3 и Н2О
оказываются несколько меньше
тетраэдрического.
Вопрос 10. Скорость химической реакции. Средняя и мгновенная скорость. Факторы, влияющие на скорость химической реакции. Закон действующих масс. Константа скорости реакции. Зависимость скорости от температуры. Правило Вант-
Гоффа. Энергия активации, энергетический барьер, природа активированных комплексов. Катализ и ферменты.
1. Скорость химической реакции - основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
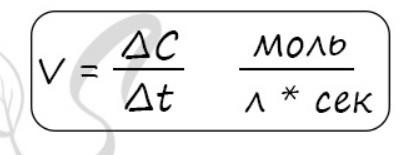
2.

3. Факторы, способные влиять на скорость химической реакции.
На то, насколько быстро будет происходить химическое взаимодействие, могут повлиять следующие факторы:
концентрация веществ; природа реагентов;
температура;
присутствие катализатора;
давление (для реакций в газовой среде).
4.


 5.
5.
6.
Не каждое столкновение молекул заканчивается образованием продуктов реакции. Для того, чтобы ослабить старые химические связи до такого состояния, чтобы энергия, выделяемая при образовании новых связей, могла компенсировать затраты на разрыв старых связей, необходима избыточная
энергия, её называют энергий активации. Только при столкновении молекул, имеющих запас этой избыточной по сравнению с остальными молекулами, энергии могут образоваться новые соединения. Энергию активации еще называют энергетическим (потенциальным) барьером, что хорошо иллюстрирует энергетическая диаграммы хода химической реакции:

8.

Ферменты (энзимы) — специфические белки, играющие роль катализаторов, то есть веществ, изменяющих скорость химических процессов, протекающих в организмах. Фермент
необычайно резко изменяет (обычно в сторону увеличения) скорость химических
превращений в процессе обмена веществ, способствуя не только расщеплению, распаду, но и воссозданию, синтезу более сложных веществ в организме из продуктов распада, причем один и тот же фермент может осуществлять и распад, и синтез одних и тех же веществ (обратимость химических превращений).
