
- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
Электродный потенциал– энергия, которая выделяется или поглощается в ходе электродных процессов (φ, В ).
ОВ потенциалом раствора называется электродный потенциал (∆φ), возникающий на инертном электроде (например, на платиновой пластинке), опущенным в данный раствор.
Электродным потенциалом ∆φ называется разность потенциалов между металлическим электродом и раствором. В общем случае достаточно сложно бывает разобраться, в результате каких физико-химических процессов на металлическом электроде, опущенном в раствор, возник потенциал.
Значения электродных потенциалов зависят от: температуры, концентрации электролита, давления ( для газовых систем ). Зависимость выражена в уравнении Нернста( Вальтер Нернст 1864 – 1941, нем.)
φ = φ0 + RT ∕ nF ∙ ln [Men+],
φ – электродный потенциал при условиях, отличающихся от стандартных; φ0- стандартный электродный потенциал R – универсальная газовая постоянная T – абсолютная температура n – число электронов, которые принимают участие в процессе F – число Фарадея ( F = 96500Кл / моль ) ln [Men+]– натуральный логарифм концентрации катионов металла в электролите
Для вычисления|исчисления| потенциалов при условиях, отличающихся от стандартных только концентрацией электролита, используют приведенное|сводит| уравнение Нернста:
φ = φ0 + 0,059 ∕ n ∙ lg [Men+]
Ряд напряжений характеризует окислительно-восстановительную способность системы «металл – ион металла». Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы.
![]()
![]()
![]()
2. Электродный потенциал восстановления ионов водорода из воды по реакции 2H2O + 2ē = H2 + 2OH‾ равен φ = -0,41В. Активные металлы начала ряда, имеющие потенциалы значительно отрицательнее, чем -0,41В, вытесняют водород из воды. Магний вытесняет водород только из горячей воды. Металлы, расположенные между Mg и Cd, обычно не вытесняют H2 из воды, так как их поверхность покрыта защитными оксидными пленками.
3. Каждый металл способен вытеснять из растворов солей металлы, которые стоят в ряду напряжений правее его.
4. Металлы, стоящие в ряду напряжений левее водорода, способны вытеснять его из растворов кислот (HCl, разб. H2SO4).
5. Все металлы, стоящие в ряду напряжений до водорода, распространены в природе исключительно в виде соединений, а за водородом – и в самородном виде.
21. Электролиз расплавов и растворов. Применение электролиза.
Электролиз – это окислительно — восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током.
1) Катод К(-), к нему перемещаются катионы, катод отдаёт электроны катионам, катионы разряжаются, идёт процесс восстановления.
2) Анод А(+), к нему перемещаются анионы, анионы отдают электроны аноду и разряжаются, идёт процесс окисления.
3) Электролиз растворов отличается от электролиза расплавов тем, что процессы протекают сложнее из-за непосредственного участия воды.
Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.

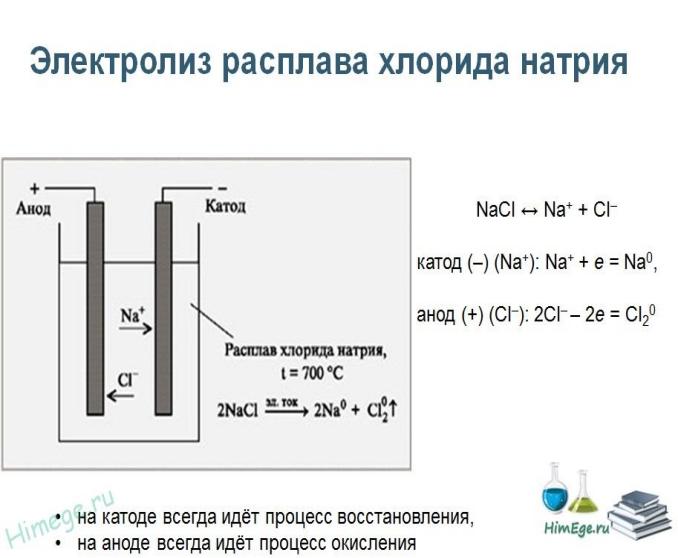
Электролиз растворов (солей, щелочей, кислот)
При проведении электролиза растворов с использованием инертного (не расходуемого) анода (например, графита или платины), на электродах могут протекать конкурирующие процессы:
на аноде — окисление анионов и гидроксид-ионов, на катоде — восстановление катионов и ионов водорода.
При выборе наиболее вероятного процесса на аноде и катоде исходят из положения, что протекает та реакция, которая требует наименьшей затраты энергии. На катоде преимущественно происходит восстановление тех катионов, которые обладают наибольшей окислительной активностью. На аноде в первую очередь будут окисляться анионы, обладающие наибольшей восстановительной активностью.
22. Свойства элементов и их соединений.
У химических элементов с увеличением главного квантового числа внешнего энергетического уровня периодически возникают одинаковые конфигурации энергетических подуровней с одинаковым числом электронов, поэтому они образуют соединения с аналогичными свойствами. Проявлений периодичности в свойствах химических соединений огромное множество. С общей точки зрения свойства химического элемента объединяют все без исключения его характеристики — и в состоянии свободных атомов или ионов, и в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений.
Обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов. Среди этих периодических свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются: энергия ионизации атомов; энергия сродства атомов к электрону; электроотрицательность; атомные (и ионные) радиусы.
Периодичность может быть выражена более или менее ярко в зависимости от того, насколько данное свойство зависит от электронной структуры.
Непериодические свойства. Их известно немного. В первую очередь следует помнить, что атомная масса химического элемента, послужившая основой для систематизации химических элементов, сама стала функцией от заряда ядра. К числу непериодических свойств химических элементов можно отнести следующие:
• атомная масса;
• радиоактивные свойства (зависят от свойств атомных ядер);
• частоты характеристических рентгеновских спектров (зависят от заряда ядра);
• ядерные свойства изотопов.
Открытие периодического закона ознаменовало новую эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть новые свойства у известных элементов.
23. Коллигативные свойства растворов.
Свойства растворов, которые зависят только от концентрации компонентов, но не зависят от их природы, называются коллигативными.
К коллигативным свойствам растворов относят: 1) понижение давления насыщенного пара над раствором по сравнению с растворителем; 2) повышение температуры кипения и понижение температуры замерзания (кристаллизации) растворов по сравнению с растворителем; 3) осмотические явления.
24. Предмет, задачи, методы аналитической химии, применение.
Аналитическая химия – наука о принципах и методах определения химического состава вещества и его структуры.
Предметом аналитической химии как науки является теория и практика химического анализа.
Аналитическая химия включает качественный и количественный анализы. Задача качественного анализа – обнаружение отдельных компонентов (элементов, ионов, соединений) анализируемого образца и идентификация соединений. Задача количественного анализа – определение количеств (концентрации или массы компонентов). Некоторые современные методы анализа (например, эмиссионная спектроскопия) позволяют сразу получать информацию и о качественном составе образца, и о количественном содержании отдельных компонентов.
В целом,задачами аналитической химии являются:
· Развитие теории химических и физико-химических методов анализа, научное обоснование, разработка методов и приёмов исследования, в том числе и автоматических
· Разработка методов разделения веществ и методов концентрирования микропримесей
· Совершенствование методов анализа природных веществ, технических материалов
· Контроль в процессе проведения исследовательских работ в области химии, промышленности и техники
· Химико-аналитический контроль в ходе химико-технологических процессов, поддерживая оптимальный уровень
· Создание методов автоматического контроля технологических процессов.
Проблемы, решаемые аналитической химией:
1. Разработка новых методов обнаружения и количественного определения элементов, которые начали использовать сравнительно недавно (ниобий, тантал, Ti, Mo) → спец. сплавы
2. Разработка методов обнаружения микроколичеств элементов (до 10-15 %)
Германий - полупроводники.
Ракетная техника: запрещённые примеси
Cd, Pb и др.≤ 10-5 %
Гафний и цирконий ≤ 0,01% - атомная энергетика
В полупроводниках примеси ≤ 10-11 %!!
3. Разработка методов анализа органических веществ → новые производства пластмасс, полимеров и т.д.
4. Химический контроль воздуха, стоков, почвы
↓ технологические выбросы
Методы аналитической химии
В аналитической химии различают:
· методы разделения и концентрирования
· методы определения
· гибридные методы.
Основной задачей разделения является отделение мешающих компонентов или выделение определяемого компонента в виде, пригодном для качественного или количественного определения. Часто при этом происходит концентрирование компонента.
В некоторых случаях определение какого-либо компонента проводят непосредственно в пробе без предварительного разделения. .
Часто методы разделения и определения бываютсвязаны между собой очень тесно, образуя единое целое.
Пример: хроматография, где анализируемая смесь разделяется на компоненты, и содержание компонентов определяется количественно по площади пика.
Такие методы анализа называют комбинированными, или гибридными.
1. В зависимости от массы анализируемого вещества.
Методы в которых используют ≤ 10-3 г применяют в анализе биологических проб, препаратов с высокой радиоактивностью, сильной токсичностью.
Техника выполнения усложняется: специальные манипуляторы, под микроскопом.
2. В зависимости от свойства вещества – метод сохраняет название измеряемого свойства
Примеры: измерение массы m осадка → гравиметрия; измерение интенсивности окраски раствора → фотометрия, спектрофотометрия; электродвижущей силы ЭДС→ потенциометрия
→ гравиметрия \ наблюдают и измеряют физические
титриметрия / свойства вещества (интенсивность
спектральных линий и т.д.)
4. По определенным классам веществ:
· анализ металлов
· анализ H2O
· газовый анализ
· силикатный анализ
· элементный анализ органического соединения
5. По целевой направленности анализа:
· судебный
· производственный
· арбитражный и т.д
6. По специальным разделам аналитической химии:
· фазовый анализ
· вещественный (рациональный)
В современной аналитической химии широко используют автоматические приборы , компьютеры, математические методы.
Большое значение имеют стандартизация и унификация методов анализа и закрепление в законодательном порядке применения наиболее точных и надёжных методик, включая их в официальные документы, регламентирующие требования к качеству продукции или материалов.
25. Качественный анализ: аналитические реакции и условия их выполнения; групповые и индивидуальные реагенты; дробный и систематический анализ.
Качественный химический анализ - это определение химических элементов, ионов, атомов, атомных групп, молекул и функциональных групп (например: карбоксильной – СООН и т.д.) в анализируемом веществе.
Качественный анализ является базой для изучения фармакопейного анализа, проводимого в рамках фармацевтического анализа.
Аналитическая реакция – такое химическое превращение анализируемого вещества при действии аналитического реагента с образованием продукта с характерными аналитическими признаками.
В лабораторных условиях обычно применяют анализ „мокрым” путем, который основан на реакциях в растворах. Естественно, что при этом исследуемое вещество должно быть сначала переведено в раствор. Если оно не растворяется в дистиллированной воде, то используют уксусную, соляную, азотную и другие кислоты. Химически взаимодействуя с кислотами, анализируемое вещество (соль, гидроксид или оксид) превращается в легко растворимое соединение: СаСО3 + 2НСН3СОО = Са (СНзСОО)2 + Н2О + СО2 Аl(ОН)3 + 3НСl = АIСl3 + 3Н2О, СuО + 2НNО3 = Сu(NО3)2 + Н2О В полученном растворе обнаруживают те или иные ионы. Не все химические реакции пригодны для качественного анализа. Аналитическими являются только те реакции, которые сопровождаются каким-нибудь внешним эффектом, позволяющим установить, что химический процесс происходит: выпадением или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ. Кислотно-основные реакции СН3СОО- + Н3О+ ↔ СН3СООН(г.) + Н2О Выделение свободной уксусной кислоты (обозначение г. — газ) при добавлении сильной кислоты (например, соляной или серной) используется для обнаружения ацетат-ионов. Партнером ацетат-иона в этой реакции является ион водорода, существующий в воде и гидратированной форме, формулу которой записывают обычно как Н3О+ (правильнее было бы записывать (H2O)4H+ или H9O4+). Аналогичным образом (по выделению свободного аммиака при действии сильных щелочей, например гидроксида натрия) можно обнаружить и ион аммония: NH++ОН↔NH3(г.) Реакции комплексообразования AgCl + 2NH3↔ [Ag(NHg)2]2+ + 2Сl- Растворение малорастворимого хлорида серебра (см. ниже, «реакции осаждения») при действии аммиака происходит вследствие образования диаминного комплекса серебра. Cu(H2O)42+ + 4NH3 ↔ [Cu(NH3)4J2+ + 4H2O В гидратированном ионе Cu2+ происходит обмен молекул воды на молекулы аммиака с образованием интенсивно окрашенного синего аммиаката меди. Используются также реакции комплексообразования с органическими реагентами 8-оксихинолином, ализарином S и др. Реакции осаждения Ag+ + Сl- ↔ AgCl (тв.) Ионы Ag+ (или Сl-) осаждаются в виде малорастворимого хлорида серебра (о его растворении см. выше). Вa2+ + SO42- ↔BaSO4(тв.) Ионы Ba2+ (или SO42-) осаждаются в виде малорастворимого сульфата бария. Реакции полимеризации Многие вещества в водных растворах способны образовывать димеры или полимеры линейного или циклического строения. Простейшим примером может служить димеризация хромат-иона с образованием бихромат-иона, сопровождающаяся изменением желтой окраски на оранжевую: CrO42- + ↔ HCrO4- 2HCrO4- ↔ Cr2O72- + H2O (Cr2O72- = [O3Cr-O-CrO3]2-) Еще одной важной в аналитическом отношении реакцией является взаимодействие ионов двух различных типов с образованием смешанного полимерного соединения, так называемого гетерополисоединения. Примером может служить взаимодействие молибдат- и фосфат-ионов: 12MoO42--+ H2PO4- + 22H+ → [PO4(MoO3)12]3- +12H2O (12-молибдофосфат-ион) Эта реакция применяется для обнаружения фосфат-иона по образованию желтого осадка гетерополисоединения. Окислительно-восстановительные реакции Эти реакции связаны с переносом электронов и могут протекать в различных формах. 1. Простой обмен электронами: Ce4+ + Fe2+ ↔ Ce3+ + Fe3+ 2. Гетерогенные реакции между ионами в растворе и твердыми веществами: Cu2+ + Fe (тв.) ↔ Cu(тв.) + Fe2+ 3. Реакции диспропорционирования: 2Cu+ ↔ Cu2+ + Cu(тв.) 4. Реакции компропорционирования (синпропорционирования): IO3- + 5I- + 6H+ ↔ 3I2 + 3H2O Реакции с выделением газов Для обнаружения ионов часто используют реакции с выделением газов (например, см. приведенные выше кислотно-основные реакции). Выделяющийся газ затем обычно вступает в другую реакцию, которая, собственно, и используется для обнаружения. Например, для обнаружения карбонат-ионов используют выделе- ние диоксида углерода при действии кислот. Выделяющийся газ можно затем обнаружить при помощи реакции образования малорастворимого карбоната бария: H++ HCO3-→H2O+ СO2(г.) СO2(г.) + Ba2+ + 2OH- → BaCO3(тв.) + H2O В аналитическом отношении важное значение имеет также реакция диоксида кремния и плавиковой кислоты (HF), сопровождающаяся образованием летучих соединений кремния с фтором: SiO2(тв.) + 4HF ↔ SiF4(г.) + 2H2O SiO2(тв.) + 6HF ↔ H2SiF6(г.) + 2H2O В зависимости от количества плавиковой кислоты образуется либо тетрафторид кремния, либо летучая кремнефтороводородная кислота. Чтобы равновесия указанных реакций сместить вправо, необходимо связать выделяющуюся воду путем добавления концентрированной серной кислоты. Смещение этих равновесий в обратном направлении можно использовать для обнаружения выделившихся газов по выпадению осадка диоксида кремния. С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на четыре группы: 1)образование характерных осадков, 2)растворение осадков, 3)появление (изменение) окраски, 4)выделение газов.
Групповыми называют реагенты, взаимодействующие с определенной группой ионов с одинаковым или близким аналитическим эффектом, и позволяющие отделить одну группу ионов от другой (групповые реагенты разделения).
Дробный анализ – обнаружение иона в анализируемой пробе с помощью специфического реагента в присутствии всех компонентов пробы.
Систематический анализ предусматривает разделение смеси анализируемых ионов по аналитическим группам с последующим обнаружением каждого иона. Существуют различные аналитические классификации катионов и анионов по группам; в данном пособии приведены наиболее часто используемые при проведении фармацевтического анализа.
26. Качественный анализ ионов: классификация катионов и анионов; обнаружение катионов и анионов (качественные реакции катионов 1,2,3, группы и анионов); анализ сухого вещества.
В основе классификации катионов лежит их различие во взаимодействии с кислотами и основаниями.
Первая
аналитическая группа катионов  содержит
ионы NH4+, Na+ и K+. Группа не имеет
специфического реагента, большинство
солей на основе этих ионов хорошо
растворимы в воде.
содержит
ионы NH4+, Na+ и K+. Группа не имеет
специфического реагента, большинство
солей на основе этих ионов хорошо
растворимы в воде.
Вторая аналитическая группа катионоввключает ионы Ag+, Pb2+ и Hg22+. Групповым реагентом является соляная кислота HCl, в присутствии которой происходит осаждение малорастворимых хлоридов вышеуказанных металлов.
В состав третьей аналитической группы катионоввходят ионы Ba2+ и Ca2+, которые образуют белые кристаллические осадки сульфатов кальция и бария при действии на раствор серной кислоты (групповой реагент).
Четвертая аналитическая группа катионовобъединяет ионы, основания которых проявляют амфотерные свойства - Al3+, Cr3+, Zn2+. Групповой реагент – избыток NaOH, который осаждает катионы всех остальных групп (кроме первой) и переводит катионы четвертой группы в форму гидроксокомплексов.
Пятая аналитическая группа катионовсодержит ионы Fe2+, Fe3+, Mn2+. Гидроксид аммония NH4OH (групповой реагент) переводит их в осадок соответствующих гидроксидов, которые нерастворимы в избытке реагента.
К ионам шестой аналитической группыотносятся Cu2+, Co2+, Ni2+, которые образуют растворимые комплексные аммиакаты в присутствии избытка NH4OH (групповой реагент).
Наибольшее распространение получили сульфидная, кислотно основная и аммиачно фосфатная классификация.
Сульфидная классификация, Предложена Н. А. Меншуткиным и основана на различной растворимости сульфидов, карбонатов и хлоридов. По этой классификации все катионы делятся на пять аналитических групп. Растворимость соединений Сульфиды, карбонаты, хлориды растворимы в воде I Na+, K+, NH 4+ Mg 2+
II Ba 2+, Sr 2+, Ca 2+ (NH 4)2 СО 3 р. Н = 9, 2
III Co 2+, Ni 2+, Fe 2+, Fe 3+, Mn 2+, Cr 3+, Al 3+, Zn 2+ Cu 2+, Hg 2+, Cd 2+, Bi 3+, Sb 3+, Sb(V) Sn 2+, Sn(IV) Ag+, Pb 2+, Hg 22+ (NH 4)2 S р. Н = 9, 2 Сульфиды растворимы в разбавленных кислотах NH 2 S р. Н = 0, 5 Сульфиды нерастворимы в разбавленных кислотах IV V HCl Карбонаты нерастворимы в воде Хлориды нерастворимы в воде и разбавленных кислотах
Аммиачно-фосфатная классификация Основана на различной растворимости фосфатов в воде, сильных и слабых кислотах, щелочах и аммиаке. По этой классификации катионы делят на пять аналитических групп. Аммиачно-фосфатная классификация Групп а I Na+, K+, NH 4+ II Ba 2+, Sr 2+, Ca 2+, Mg 2+, Bi 3+, Fe 2+, Fe 3+, Cr 3+, Al 3+ III Cu 2+, Co 2+, Ni 2+, Zn 2+, Hg 2+, Cd 2+ Sn 2+, Sn(IV), Sb 3+, Sb(V) IV V Ag+, Pb 2+, Hg 22+ Групповой реактив (NH 4)2 HPO 4 + NH 4 OH Растворимость соединений Хлориды, нитраты и фосфаты растворимы в воде Фосфаты нерастворимы в воде и избытке аммиака (NH 4)2 HPO 4 + Фосфаты растворимы в NH 4 OH (избыток) избытке аммиака HNO 3 (t) HCl Метасурьмяная и метаоловянная кислоты нерастворимы в воде Хлориды нерастворимы в воде и разбавленных кислотах.
Кислотно-основная классификация основана на различной растворимости гидроксидов, хлоридов, сульфатов. Групповыми реактивами этого метода являются растворы кислот и оснований. По кислотно-основной классификации катионы делят на шесть аналитических групп. Кислотно-основная классификация Группа Групповой реактив Растворимость соединений Хлориды, сульфаты и гидроксиды растворимы в воде Хлориды нерастворимы в воде и разбавленных кислотах Сульфаты нерастворимы в воде и кислотах Гидроксиды растворимы в избытке щелочи (амфотерны) I Na+, K+, NH 4+ II Ag+, Pb 2+, Hg 22+ Ba 2+, Sr 2+, Ca 2+ HCl III IV V VI Cr 3+, Al 3+, Zn 2+, Sn 2+, Sn(IV) H 2 SO 4 + C 2 H 5 OH Na. OH (избыток) Fe 2+, Fe 3+, Na. OH (NH 4 OH) Mn 2+, Mg 2+, Bi 3+, Sb(V) Cu 2+, Co 2+, NH 4 OH (избыток) Ni 2+, Hg 2+, Cd 2+ Гидроксиды нерастворимы в избытке щелочи и аммиаке Гидроксиды растворимы в избытке аммиака.
КЛАССИФИКАЦИЯ АНИОНОВ. В основе аналитической классификации анионов лежит их различное отношение к солям бария и серебра.
Первая аналитическая группа анионовобразована анионами SO42 , PO43 и CO32 . Эти ионы образуют белые кристаллические осадки в присутствии нитрата бария, который является групповым реагентом.
Вторая аналитическая группа анионоввключает ионы Cl , Br и I . Групповой реагент – нитрат серебра, который осаждает вышеуказанные ионы.
Третья аналитическая группа анионовсодержит такие ионы, как NO3 , NO2 и CH3COO . Большинство солей на основе этих ионов хорошо растворимо в воде. Групповой реагент отсутствует.
27. Количественный анализ: задачи, классификация и характеристики количественного анализа, применение.
Задачей количественного анализа является определение количественного содержания отдельных составных частей в исследуемом веществе или в смеси. Результаты количественного определения выражают обычно в процентах. Количественный анализ используется в биологии, физиологии, медицине, биохимии, химии пищевых продуктов и т. д.
Методы количественного анализа подразделяются на химические, физико-химические и физические. К классическим химическим методам количественного анализа относятся гравиметрический и объёмный анализ.
Наряду с классическими химическими методами широко распространены физические и физико-химические (инструментальные) методы, основанные на измерении оптических, электрических, адсорбционных, каталитических и других характеристик анализируемых веществ, зависящих от их количества (концентрации). Обычно эти методы делят на следующие группы: электрохимические (кондуктометрия, полярография, потенциометрия и др.); спектральные, или оптические (эмиссионный и абсорбционный спектральный анализ, фотометрия, люминесцентный анализ и др.); рентгеновские; хроматографические; радиометрические; масс-спектрометрические. Перечисленные методы, уступая химическим в точности, существенно превосходят их по чувствительности, избирательности и скорости выполнения.
В данном курсе будут рассмотрены только классические химические методы количественного анализа.
Гравиметрический анализ основан на точном измерении массы определяемого компонента в чистом виде или в виде его соединения. Объёмный анализ включает титриметрический объёмный анализ — методы измерения объёма раствора реагента с точно известной концентрацией, израсходованного на реакцию с анализируемым веществом, и газовый объёмный анализ — методы измерения объёма анализируемых газообразных продуктов.
Количественный анализ заключается в установлении численного значения содержания аналита в исследуемом образце по аналитическому сигналу.
Задачи количественного анализа:
· получение информации о содержании химических элементов, ионов, радикалов, функциональных групп, индивидуальных веществ или фаз в анализируемом объекте;
· разработка и выбор оптимальных методов получения этой информации.
При количественном анализе измеряют интенсивность аналитического сигнала, то есть не только регистрируют факт образования осадка, но и определяют его массу, не только обнаруживают изменение окраски раствора, но и находят значение оптической плотности и т. д.
Интенсивность аналитического сигнала – численное значение свойства, связанного с содержанием аналита. Результаты измерений используют для вычисления массы или концентрации аналита в исходном образце, а при количественном анализе состава – выражают его в массовых долях отдельных компонентов (в процентах).
С помощью методов количественного анализа получают информацию о составе живых организмов, изучают влияние отдельных элементов и веществ на их рост, развитие и продуктивность.
В задачу количественного анализа входит определение количества (содержания) элементов (ионов), радикалов, функциональных групп, соединений или фаз в анализируемом объекте.
28. Гравиметрический анализ: сущность, применение; основные приемы и операции гравиметрического анализа; вычисления в гравиметрическом анализе; посуда и оборудование, техника взвешивания.
Классическое название метода — весовой анализ. Гравиметрический анализ широко используют при количественных определениях. С его помощью определяют, например, содержание фосфора в фосфоритах, апатитах, фосфорных удобрениях, почвах, кормах и т. п.
1. Общая характеристика метода
Гравиметрией называют метод количественного анализа, заключающийся в точном измерении массы определяемого компонента пробы, выделенного в виде соединения известного состава или в форме элемента.
Гравиметрический анализ основан на законе сохранения массы веществ при химических превращениях. Это наиболее точный из химических методов анализа, его характеристики: предел обнаружения — 0,10%; правильность - 0,2 отн.%; информативность — 17 бит. В гравиметрии используют реакции обмена, замещения, разложения и комплексообразования, а также электрохимические процессы. Наиболее распространен метод осаждения.
1. Метод осаждения – это метод, при котором навеску анализируемого вещества растворяют и прибавляют 1,5-кратный избыток реагента- осадителя, соблюдая необходимые условия осаждения. Полученный осадок называют осаждаемой формой. Осадок отделяют от раствора (чаще всего фильтрованием), промывают, затем высушивают или прокаливают, получая гравиметрическую (весовую) форму. Массу определяемого компонента mа рассчитывают по формуле:
ma =mBF •100/а (%)
где mа — масса высушенного или прокаленного осадка, г; F — гравиметрический фактор, определяемый по химической формуле гравиметрической формы; а — навеска анализируемого вещества, г.
Гравиметрические факторы, называемые также аналитическими множителями или факторами пересчета, вычисляют как отношение молекулярной массы определяемого компонента к молекулярной массе гравиметрической формы с учетом стехиометрических коэффициентов.
2. Методы выделения - основаны на выделении определяемого компонента из анализируемого вещества и точном взвешивании его. Например, при определении содержания золы в твердом топливе сжигают определенное количество (навеску) этого топлива, взвешивают золу и вычисляют процентное содержание ее во взятом образце.
3.Метод отгонки состоит в том, что определяемый компонент «количественно» выделяют в виде летучего соединения (газа, пара) действием кислоты, основания или высокой температуры на анализируемое вещество. Например, определяя, содержание двуокиси углерода в карбонатной породе, обрабатывают образец ее соляной кислотой. Выделившийся газ пропускают через поглотительные трубки со специальными реактивами. По увеличению массы поглотительной трубки определяют количество выделившегося CO2.
4.Термогравиметрия. Выполнение большинства операций гравиметрического анализа (фильтрование, высушивание и прокаливание осадка, доведение его до постоянной массы) отнимает очень много времени. Однако с помощью термовесов, сконструированных Дювалем, удается значительно ускорить определение. В этом приборе можно нагревать твердые вещества до температуры приблизительно 10000C и наблюдать, как изменяется их масса. При этом прибор автоматически вычерчивает на бумаге кривую изменения массы вещества. Получающаяся ступенчатая кривая характеризует изменение массы осадка в процессе повышения температуры и даже позволяет судить о химических превращениях веществ.
Например, такая кривая показывает, что кристаллогидрат оксалата кальция CaC2O4•H2O устойчив лишь при температуре не выше 1000C. При повышении температуры до 2260C он разрушается с образованием безводной соли CaC2O4. Последняя при 4200C разлагается с получением карбоната кальция СаСО3. Далее при 6600C начинается распад карбоната на окись кальция и двуокись углерода. Этот процесс заканчивается при температуре 8400C.
2.Основные операции весового анализа
В ходе гравиметрического определения различают следующие операции: 1) отбор средней пробы вещества и подготовку ее к анализу; 2) взятие навески; 3) растворение; 4) осаждение определяемого элемента (с пробой на полноту осаждения); 5) фильтрование; 6) промывание осадка (с пробой на полноту промывания); 7) высушивание и прокаливание осадка; 8) взвешивание; 9) вычисление результатов анализа.
Отбор средней пробы. Аналитическое определение лишь тогда приводит к содержательным выводам, когда отобранная для анализа проба является представительной по отношению к исследуемому материалу.
В производстве бывает необходимо определить средний химический состав большой партии неоднородного материала (удобрения, ядохимиката, почвы, руды и т. п.). При этом подготовка вещества к анализу сводится к правильному отбору так называемой средней пробы. Правила отбора средних проб различных материалов предусмотрены государственными стандартами или техническими условиями. Выполнение этой операции всегда подчинено единому принципу: средняя проба должна быть составлена из большого числа мелких порций, взятых в разных местах анализируемого материала. Благодаря этому состав отобранной пробы приближается к среднему химическому составу большого количества исследуемого материала.
Первичная средняя проба, отобранная тем или иным способом, еще непригодна для анализа. Обычно она слишком велика (от одного до нескольких килограммов) и неоднородна. Подготовка пробы состоит в измельчении, перемешивании и сокращении до небольшой массы (около 300 г). Для сокращения пробы пользуются так называемым квартованием . Измельченный материал перемешивают в куче, рассыпают ровным слоем в виде квадрата (или круга), делят на четыре сектора, содержимое двух противоположных секторов отбрасывают, а двух остальных — соединяют вместе. Операцию квартования повторяют многократно. Из полученного таким образом однородного материала берут навески для анализа.
Перекристаллизация. В условиях исследовательской лаборатории часто требуется найти содержание какого-нибудь элемента в химически чистом соединении (например, содержание бария в хлориде барии ВаС12•2Н20). Здесь подготовка вещества к анализу состоит и очистке его от примесей и обычно осуществляется путем перекристаллизации для удаления примесей только из кристаллических веществ, например из солей.
Взятие навески
Навеской называют количество вещества, необходимое для выполнения анализа.
Как правило, чем больше навеска, тем выше и относительная точность определения. Однако работа с большой навеской имеет свои отрицательные стороны: получающийся при этом большой осадок трудно отфильтровать, промыть или прокалить, анализ занимает много времени. Наоборот, при слишком малой навеске ошибки взвешиваний и других операций, неизбежные при анализе, значительно снижают точность определения.
Таким образом, выбор величины навески анализируемого вещества определяется количеством осадка, наиболее удобным в работе. Например, на бумажном фильтре диаметром 7 см можно легко отфильтровать 0,5 г кристаллического сульфата бария ВаSО4. Но с таким же количеством аморфных, студенистых осадков гидрооксидов Fe(OH)3, Al(OH)3 работать чрезвычайно трудно.
Аналитической практикой установлено, что наиболее удобны в работе кристаллические осадки с массой около 0,5 г и объемистые аморфные осадки с массой 0,1—0,3 г. Учитывая эти нормы осадков и зная приблизительное содержание определяемого элемента в веществе, вычисляют необходимую величину навески.
Фильтрование
Фильтрованием отделяют полученный осадок от раствора, содержащего посторонние примеси. Тщательность выполнения этой операции сказывается на точности определений.
В гравиметрическом анализе применяют не обычную фильтровальную бумагу, а так называемые беззольные фильтры. В процессе изготовления их промывают кислотами (HCl), удаляя большую часть минеральных веществ. Масса золы, образующейся при сжигании одного беззольного фильтра, бывает мала, поэтому ею пренебрегают.
Промышленность выпускает беззольные фильтры нескольких сортов, различающиеся по диаметру и плотности.
Черная (или красная) лента – наименее плотные, т.е. быстрофильтрующие и крупнопористые и используют для отделения аморфных осадков гидроксидов железа, алюминия и др.
Белая лента — фильтры средней плотности, применяемые для отделения большинства кристаллических осадков
Синяя лента — фильтры мелкопористые, наиболее плотные и медленно фильтрующие; применяют их для отделения мелкокристаллических осадков сульфата бария BaSО4 , эти фильтры называют также «баритовыми».
Иногда для фильтрования используют фарфоровую воронку Бюхнера, на дно которой помещают бумажный фильтр. Через нее фильтруют также при помощи вакуум-насоса.
Используются тонкостенные химические колбы (рис. 18.1, а) и стаканы (рис. 18.1, б) с целью быстрого нагревания или охлаждения растворов.
Рис. 18.1, Колба коническая (а) и стакан (б)
Рис. 182. Воронка
В гравиметрическом анализе используются стаканы емкостью 100, 200 и 400 мл для осаждения из растворов. Химические колбы и стаканы нельзя непосредственно нагревать на открытом пламени горелки. Их нагревают, ставя на металлическую асбестированную сетку.
2. Часовые стекла( см. рис. 7.7) применяют для взятия навески или накрывают стаканы и колбы.
3. Воронки(рис. 18.2) применяют для фильтрования и промывания осадков.
4. Промывалка(см. рис. 7.5) применяется для смывания осадка со стенок стакана, часового стекла, фильтра, бюкса.
5. Стеклянные палочки(см. рис. 7.4) применяют для перемешивания жидкости, для перенесения жидкости при фильтровании (см. рис. 18.9).
6. Бюксы(рис. 18.3)представляют собой маленькие стаканчики с пришлифованной стеклянной крышкой.

Рис. 18.3. Бюксы
Рис. 18.4. Фарфоровые тигли
Применяются для определения влажности веществ, а также для взвешивания твердых и жидких веществ.
7. Фарфоровые тигли(рис. 18.4) употребляют для прокаливания осадков. Наиболее удобны низкие тигли с широким дном. Для очистки тиглей от плотно приставших к ним осадков рекомендуется налить в него концентрированный раствор азотной или соляной кислоты и осторожно нагреть под тягой. Если тигель не отмывается, то используют смесь из трех частей соляной кислоты и одной части азотной (царская водка). Тигель нельзя применять для точных аналитических работ, если его не удается очистить от осадков. Новый тигель перед применением всегда прокаливают в муфельной печи несколько часов до постоянной массы. Надписи на тиглях делают на дне с внешней стороны с помощью насыщенного раствора хлорида железа (III) и затем прокаливают несколько минут для закрепления надписей. В фарфоровых тиглях нельзя сплавлять вещества с карбонатом натрия и щелочами, проводить работу с плавиковой кислотой. В этом случае их заменяют платиновыми.
8. Тигельные щипцы(рис. 18.5). Тигли переносят специальными щипцами, имеющими плоские, загнутые кверху концы. Перед употреблением щипцов концы их прокаливают на газовой горелке. Тигель захватывают щипцами за края, а не обхватывают его.

Рис. 185. Тигельные щипцы

Рис. 18.6. Эксикатор
9. Эксикаторы(рис. 18.6). Эксикаторы служат для хранения веществ, которые могут поглощать влагу из воздуха. Тигли или бюксы с высушенными или прокаленными веществами охлаждают в эксикаторах до комнатной температуры. Эксикатор представляет собой толстостенный стеклянный сосуд с пришлифованной плотно закрывающейся крышкой. Между верхней и нижней частью эксикатора расположен фарфоровый вкладыш с отверстиями, на котором размещают бюксы и тигли. На дно эксикатора помещают вещества, хорошо поглощающие влагу: прокаленный хлорид кальция, оксид фосфора (V) или концентрированную серную кислоту.
10. Электрические сушильные шкафыприменяются для сушки химической посуды, осадков или образцов анализируемого вещества. Температура в них регулируется автоматически в пределах 20-250 °С.
11. Электрические муфельные печислужат для прокаливания осадков в тиглях. В этих печах может быть достигнута температура от 800 до 1200 °С.
12. Ступки фарфоровые(рис. 18.7) и агатовые (рис. 18.8) употребляют для измельчения проб.

Рис.18.7. Фарфоровая ступка с пестиком Рис.183. Агатовая ступка с пестиком
Ступку заполняют веществом не больше чем на 1/3 объема. Осторожными ударами пестика разбивают крупные куски вещества, довода их до размеров горошины, затем медленно растирают круговыми движениями. По мере измельчения скорость движения пестика увеличивают, но таким образом, чтобы частицы вещества не выбрасывались из ступки.
29. Жесткость воды, её влияние на живые организмы. Методы её устранения.
Жесткость воды – совокупность свойств, обусловленных содержанием в воде катионов Сa2+ и катионов Mg2+.
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, хотя есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечнососудистых заболеваний.
Методы устранения
Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану.
Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ.
Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.
Катионирование. Метод основан на использовании ионообменной гранулированной загрузки — (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.
Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки(дистилляцией)
30.Титриметрический анализ: сущность, применение; классификация методов титриметрического анализа; вычисления в титриметрическом анализе; растворы в титриметрическом анализе.



Приготовление первичного стандартного раствора. Точную навеску, взятую на аналитических весах, растворяют в мерной колбе. В результате получают раствор, в котором точно известно количество вещества и объем раствора. Полученные растворы называют растворами с приготовленным титром. Титр раствора равен навеске вещества (г, мг), деленной на объем (мл). Чтобы перейти к молярной концентрации эквивалента, достаточно титр раствора умножить на 1000 и разделить на молекулярную массу.
Приготовление вторичного стандартного (стандартизированного) раствора. В этом случае нет необходимости брать точную навеску вещества. Вещество взвешивают на технохимических весах, растворяют в определенном объеме, и получают раствор вещества приблизительно нужной концентрации. Точную его концентрацию устанавливают титрованием с помощью раствора первичного стандарта. Полученные растворы называют растворами с установленным титром.
Стандартные растворы можно также приготовить с помощью фиксаналов (стандарт-титров). Фиксаналы предствляет собой запаянные стеклянные ампулы, содержащие количество вещества, необходимое для приготовления 1 л раствора. Промышленность выпускает фиксаналы с различными веществами, как в виде растворов (серная и хлорводородная кислоты, гидроксиды натрия и калия), так и сухие (перманганат калия, карбонат или оксалат натрия и др.). Для приготовления стандартного раствора из фиксанала, содержимое ампулы переносят в мерную колбу вместимостью 1 л. Для этого в каждой коробке с фиксаналами имеется стеклянный боек и стеклянная палочка. В горлышко колбы вставляют воронку и вкладывают стеклянный боек, о который разбивают дно ампулы. Затем стеклянной палочкой пробивают отверстие в верхней части ампулы и дают содержимому полностью вытечь или высыпаться в колбу, которую затем заполняют дистиллированной водой до метки.
31.Метод кислотно-основного титрования: сущность, применение; индикаторы метода кислотно-основного титрования; кривые титрования.
Сущность кислотно-основного титрования
Суть кислотно-основного титрования сводится к передаче протона либо от титранта к аналиту, либо, наоборот, от аналита к титранту. В процессе анализа необходимо точно определить, когда количество добавленного компонента будет ЭКВИВАЛЕНТНО количеству измеряемого компонента.
Описанные в этой главе работы по определению щелочности воды, органических кислот в образцах, азота в органических веществах, кислотности плодов и овощей, массовой доли компонентов в удобрениях — лишь малая доля широко используемых методик анализа различных сельскохозяйственных объектов (почвы, растения, удобрения, молоко и др.), основанных на кислотно-основном титровании. Этот метод анализа в сочетании с физико-химическими методами фиксирования точки эквивалентности (потенциометрия, амперометрия, кондуктометрия) позволяет с высокой точностью проводить анализ мутных сред, смесей кислот, солей в самых различных материалах.
Кислотно-основные индикаторы (pH-индикаторы) — органические соединения, способные изменять цвет в растворе при изменении кислотности (pH). Индикаторы широко используют в титровании в аналитической химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность исследования.
Кривая титрования
графическое изображение зависимости изменения концентрации С (Х), определяемого в-ва Х или некоторого связанного с ним свойства системы (раствора) от объема V(Т) прибавленного титранта (Т).
По оси абсцисс откладывают объем прибавляемого титранта, по оси ординат соответствующее значение рН. Потенциометрическое тирование - изменение концентрации иона непременно сопровождается изменением потенциала на индикаторном электроде, погруженном в титруемый р-р.
32.Метод комплексонометрического титрования: сущность, применение; реакции комплексонообразования и требования к ним.
Сущность комплексонометрического титрования
Комплексонометрическое титрование – это титриметрический метод анализа, основанный на взаимодействии определяемых ионов металла с комплексонами. ... Образования устойчивых комплексов с катионами металлов в известном молярном соотношении.



33.Предмет и задачи физической и коллоидной химии. Значение физической и коллоидной химии для биологических и сельскохозяйственных наук.
34.Агрегатные состояния вещества.
Четыре агрегатных состояния вещества
Традиционно выделяют три агрегатных состояния: твёрдое, жидкое и газообразное. К агрегатным состояниям принято причислять также плазму, в которую переходят газы при повышении температуры и фиксированном давлении. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию.
Газообразное состояние. Законы идеальных газов, уравнение состояния идеального газа. Кинетическая теория газов. Идеальные газы.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Кинетическая теория газов Кинетическая теория газов, раздел теоретической физики, исследующий статистическими методами свойства газов на основе представлений о молекулярном строении газа и определенном законе взаимодействия между его молекулами. Обычно под К. ... — собственно газы, газовые смеси и плазма.


36.Химическая термодинамика и термохимия
37.Системы и внешняя среда. Функция состояния.
38.первый закон термодинамики, его приложение к химическим процессам. Энтальпия.


Энтальпия — экстенсивная величина: для составной системы она равна сумме энтальпий её независимых частей. Как и внутренняя энергия, энтальпия определяется с точностью до произвольного постоянного слагаемого.
39.Тепловой эффект химической реакции. Закон Гесса и следствия из него.
Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.


