
- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
Формулировка периодического закона Менделеева: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.
В каждой ячейке, соответствующей элементу, представлены: химический символ, название, порядковый номер, соответствующий числу протонов в атоме, относительная атомная масса. Число электронов в атоме соответствует числу протонов. Количество нейтронов в атоме можно найти по разности между относительной атомной массой и количеством протонов, т. е. порядкового номера.
N(n0) = Ar - Z
Например, для изотопа хлора 35Cl количество нейтронов равно: 35-17=18
Составными частями периодической системы являются группы и периоды.
Периодическая система содержит восемь групп элементов. Каждая группа состоит их двух подгрупп: главной и побочной. Главные обозначены буквой а, а побочные – буквой б. Главная подгруппа содержит больше элементов, чем побочная. В главной подгруппе содержатся s- и p-элементы, в побочной – d-элементы.
Группа – столбец периодической системы, в котором объединены химические элементы, обладающие химическим сходством вследствие сходных электронных конфигураций валентного слоя.
Строка, называемая периодом, - это последовательность элементов, расположенных в порядке увеличения зарядов их ядер, которая начинается с щелочного металла (или водорода) и заканчивается благородным газом.
Номер периода равен количеству электронных уровней в атоме.
Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп.
Кислотность высших оксидов элементов главных подгрупп увеличивается по периоду слева направо.
В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы IV-VII групп, причем только легких.
Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
Потенциал ионизации атома - минимальная разность потенциалов U, к-рую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома.
Первый потенциал ионзизации атома - та работа, которую надо затратить для удаления первого электрона из атома.
Соответственно различаю второй, третий и т.д. потенциалы ионизации.
Энергия ионизации
Чаще употребимое понятие - энергия ионизации E. Это минимальная энергия, которую надо затратить для удаления электрона из атома.
Потенциал ионизации U тесно связан с энергией ионизации соотношением:
E=Ue,
где е-элементарный электрический заряд.
Энергия ионизации атома, выраженная в эВ (электроновольтах), численно совпадает с потенциалом ионизации атома, выраженным в В (вольтах).
Сродством к электрону Е называется энергия, которая выделяется при присоединении электрона к атому, молекуле или радикалу. Она выражается в тех же единицах, что и энергия ионизации. Чем больше сродство к электрону, т.е. чем больше энергии выделилось при присоединении электрона, тем прочнее удерживается электрон взявшей его частицей, тем сильнее выражены у элемента окислительные свойства.
Металлы — элементы, атомы которых способны отдавать электроны.
Неметаллы — элементы, атомы которых могут принимать электроны.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется электроотрицательностью (ЭО).
Электроотрицательность — это способность атома притягивать к себе валентные электроны от других атомов.
По шкале Полинга наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, а наименее электроотрицательным — франций.
Элементы с высокой и низкой электроотрицательностью считаются активными. С высокой — активные неметаллы, с низкой — активные металлы.
Ван-дер-ваальсовые расстояния -это сумма ван-дер-ваальсовых радиусов пары атомов. Величина этих радиусов равна половине межъядерного расстояния между не связанными одноименными атомами, принадлежащими разным молекулам. Ван-дер-ваальсовы радиусы характеризуют возможные минимальные взаимодействия атомов, которые принадлежат разным молекулам. Если расстояние, на которое сближаются атомы, меньше, чем сумма их ван-дер-ваальсовых радиусов, то появляется межатомное отталкивание. Ван-дер-ваальсовы радиусы позволяют:
определять форму молекул;
характеризовать конформации молекул;
определять наиболее стабильные конфигурации органических молекул;
устанавливать расположение молекул в молекулярных кристаллах;
предсказывать структуру кристаллов;
определять размеры атомов благородных газов.
Изменение некоторых характеристик элементов в периодах слева направо: · заряд ядер атомов увеличивается; · радиус атомов уменьшается; · электроотрицательность элементов увеличивается; · количество валентных электронов увеличивается от 1 до 8 (равно номеру группы); · высшая степень окисления увеличивается (равна номеру группы); · число электронных слоев атомов не изменяется; · металлические свойства уменьшается; · неметаллические свойства элементов увеличивается.
Изменение некоторых характеристик элементов в группе сверху вниз: · заряд ядер атомов увеличивается; · радиус атомов увеличивается; · число энергетических уровней (электронных слоев) атомов увеличивается (равно номеру периода); · число электронов на внешнем слое атомов одинаково (равно номеру группы); · прочность связи электронов внешнего слоя с ядром уменьшается; · электроотрицательность уменьшается; · металличность элементов увеличивается; · неметалличность элементов уменьшается.
Элементы, которые находятся в одной подгруппе, являются элементами-аналогами, т.к. они имеют некоторые общие свойства (одинаковую высшую валентность, одинаковые формы оксидов и гидроксидов и др.). Эти общие свойства объясняются строением внешнего электронного слоя.
Кислотно-основные свойства химических соединений, их изменение в группе и периоде. Кислотно — основные свойства гидроксидов зависят от того, какая из двух связей в цепочке Э −О − Н является менее прочной. Если менее прочна связь Э−О, то гидроксид проявляет основные свойства, если О−Н − кислотные. Чем менее прочны эти связи, тем больше сила соответствующего основания или кислоты. Прочность связей Э−О и О−Н в гидроксиде зависит от распределения электронной плотности в цепочке Э−О− H. На последнюю наиболее сильно влияют степень окисления элемента и ионный радиус. Увеличение степени окисления элемента и уменьшение его ионного радиуса, вызывают смещение электронной плотности к атому элемента в цепочке Э ← О ←Н. Это приводит к ослаблению связи О−Н и усилению связи Э−О. Поэтому основные свойства гидроксида ослабевают, а кислотные − усиливаются.
8. Типы химической связи: Ковалентная, ионная, водородная, металлическая. Характеристика связей: электрические дипольные моменты, эффективные заряды атомов, степень ионности, направленность, насыщенность, энергия и длина связи.
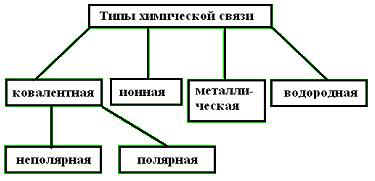
Связь между атомами неметаллов, возникающая при взаимодействии электронов с образованием общих электронных пар, называется ковалентной.
Ковалентная неполярная связь — химическая связь между атомами неметаллов с равными или близкими значениями электроотрицательности. При этом общая электронная пара одинаково принадлежит обоим атомам, смещения электронной плотности не наблюдается.
Ковалентная неполярная связь имеет место в простых веществах-неметаллах: О2,N2,Cl2,P4,O3.
Связь, образованная элементами-неметаллами с разной электроотрицательностью, называется ковалентной полярной. При этом происходит смещение электронной плотности в сторону более электроотрицательного элемента. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO3–,CH3COO–).
Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем.
Ионная связь образована за счет сил электростатистического притяжения между разноименно заряженными ионами — катионами и анионами. Например, в образовавшейся молекуле — хлориде натрия Na+Cl− — связь осуществляется за счет электростатического притяжения разноименно заряженных ионов.
Существует еще один тип связи — металлическая, характерная для простых веществ — металлов. Она характеризуется притяжением частично ионизованных атомов металлов и валентных электронов, образующих единое электронное облако.
Примером сильного межмолекулярного взаимодействия является водородная связь, образующаяся между атомом водорода одной молекулы и атомом с высокой электроотрицательностью (F, O, N). Примером водородной связи является взаимодействие молекул воды O2O…OH2, молекул аммиака и воды H3N…OH2, метанола и воды CH3OH…OH2 , а также различных частей молекул белков, полисахаридов, нуклеиновых кислот.
Длина и энергия ковалентной связи.
Характерные свойства ковалентной связи — ее длина и энергия. Длина связи — это расстояние между ядрами атомов. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является энергия связи, которая определяется количеством энергии, необходимой для разрыва связи. Обычно она измеряется в кДж/моль. Так, согласно опытным данным, длины связи молекул H2,Cl2 и N2 соответственно составляют 0.074,0.198 и 0.109 нм, а энергии связи соответственно равны 436,242 и 946 кДж/моль.
Химическая связь характеризуется длиной, энергией, направленностью и насыщаемостью (каждый атом способен образовать ограниченное число связей). Кратность связи равна числу общих электронных пар. Форма молекул определяется типом электронных облаков, участвующих в образовании связи, а также фактом наличия или отсутствия неподеленных электронных пар. Так, например, молекула CO2 является линейной (нет неподеленных электронных пар), а H2O и SO2 – уголковыми (есть неподеленные пары). В случае если взаимодействующие атомы имеют сильно различающиеся значения электроотрицательностей, общая электронная пара практически полностью смещается в сторону атомов с наибольшей электроотрицательностью. Ионную связь, таким образом, можно рассматривать как предельный случай полярной ковалентной связи, когда электрон практически полностью перешел от одного атома к другому. В действительности полного смещения не происходит никогда, то есть абсолютно ионных веществ нет. Например, в NaCl реальные заряды на атомах составляют +0,92 и –0,92, а не +1 и –1.
Ионная связь реализуется в соединениях типичных металлов с неметаллами и кислотными остатками, а именно в оксидах металлов (CaO, Al2O3), щелочах (NaOH, Ca(OH)2) и солях (NaCl, K2S, K2SO4, NH4Cl, CH3NH3+, Cl–).
механизмы образования химической связи
Обменный. Обменный механизм образования химической связи обусловлен обобществлением неспаренных электронов атомов. Подробно он был рассмотрен выше на примере образования молекулы хлора.
Донорно-акцепторный. Донор — элемент, предоставляющий пару электронов (например, азот или бор). Акцептор — элемент, предоставляющий свободную орбиталь для пары электронов другого атома.
