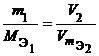- •2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
- •4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
- •Квантовые числа: главное, побочное, магнитное, спиновое
- •Формулировка периодического закона д.И. Менделеева. Структура периодической системы химических элементов. Понятие периода и группы. Значение периодического закона.
- •Свойства атомов элементов: потенциал ионизации, сродство к электрону, электроотрицательность, радиусы Ван-дер-Ваальса. Периодический характер изменений свойств элементов в периоде и группе.
- •Вопрос 9. Метод валентных связей. Сигма- и Пи-связи. Гибридизация атомных орбиталей и геометрия молекул. Неподеленные электронные пары гибридных орбиталей (на примере nh3 и н2о).
- •Вопрос 11. Химическое равновесие. Константа равновесия. Смещение химического равновесия при изменении давления, температуры, концентрации. Принцип Ле-Шателье.
- •Вопрос 12. Растворы. Причины образования растворов. Физические силы (Ван-дер- Ваальса): ориентационные, индукционные, дисперсные. Химические силы: водородная связь, ион-дипольное взаимодействие.
- •Вопрос 13. Способы выражения концентраций растворов. Значение растворов в химии.
- •Вопрос 14. Электролиты. Типы сильных электролитов. Типы слабых электролитов. Константа и степень диссоциации слабых электролитов. Произведение растворимости.
- •Вопрос 15. Вода как слабый электролит. Ионное произведение воды. Водородный показатель среды рН.
- •Вопрос 16. Гидролиз солей. Типы гидролиза, константа и степень гидролиза.
- •Вопрос 17. Оксиды, гидроксиды и соли как важнейшие классы неорганических соединений. Их получение и свойства.
- •Получение гидроксидов
- •Вопрос 18. Степень окисления и правила ее нахождения. Окислители и восстановители. Типы овр.
- •Определение степени окисления проводят, исходя из следующего:
- •Вопрос 19. Комплексные соединения. Определение, строение, номенклатура. Диссоциация комплексных солей. Константа нестойкости. Теория координационной химической связи. Значение комплексных соединений.
- •20. Основные законы и понятия электрохимии: электродный потенциал, уравнение Нернста. Ряд напряжений металлов и его свойства.
- •21. Электролиз расплавов и растворов. Применение электролиза.
- •40. Второй закон термодинамики. Энтропия в классической и статистической термодинамике.
- •41. Энергия Гиббса. Энергия Гельмгольца. Свободная энергия и направление химических реакций.
- •42. Скорость химических реакций. Средняя и мгновенная скорость химической реакции. Константа скорости химической реакции. Влияние концентрации на скорость химической реакции. Закон действующих масс.
- •43. Порядок и молекулярность реакции. Элементарные процессы. Определение порядка реакции. Период полураспада.
- •44. Влияние температуры на скорость реакции. Уравнение Аррениуса. Энергия активации. Определение энергии активации.
- •45. Катализ и его значение в биологических процессах. Классификация каталитических процессов.
- •46. Гомогенный катализ. Теория гомогенного катализа
- •47. Гетерогенный катализ. Роль адсорбции в гетерогенном катализе. Представление об активных центрах.
- •48. Ферментативный катализ, его особенности и значение в биологических процессах.
- •49. Буферные системы, их состав и механизм действия. Расчет рН буферных систем. Буферная ёмкость. Биологическое значение буферных систем. Буферные системы в организма
- •50. Электропроводность растворов электролитов
- •51. Удельная и эквивалентная электропроводность. Зависимость удельной электропроводности от разбавления. Скорости движения ионов. Закон Кольрауша. Подвижность ионов
- •52. Практическое применение электропроводности. Определение степени и константы диссоциации слабых электролитов. Кондуктометрическое титрование.
- •54. Водородный электрод. Электроды I и II рода.
- •55. Измерение эдс. Концентрационные цепи.
- •56. Окислительно-восстановительные электроды и цепи.
- •57. Потенциометрический метод измерения рН. Потенциометрическое титрование.
- •58. Поверхностные явления, Адсорбция. Изотерма адсорбции. Физическая и химическая адсорбция.
- •59. Адсорбция на границе твердое вещество-газ. Теория адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •60. Адсорбция на границе жидкость-газ. Уравнение Гиббса. Поверхностноактивные и поверхностнонеактивные вещества.
- •Классификация дисперсных систем.
- •Общая характеристика коллоидных систем. Методы получения лиофобных коллоидов
- •Мицеллярная теория строения коллоидной частицы.
- •Устойчивость коллоидных систем. Коагуляция. Действие электролитов. Правило Шульца-Гарди.
- •Молекулярно-кинетические, оптические и электрокинетические свойства коллоидных систем.
- •Общая характеристика растворов вмс.
- •Устойчивость растворов вмс.
- •Изоэлектрическое состояние. Нарушение устойчивости. Расслоение.
- •Коацервация. Лиотропные ряды. Высаливание.
- •Процессы структурообразования в растворах вмс.
- •Набухание и растворения вмс. Степень набухания и скорость набухания. Факторы набухания.
- •Хрупкие и эластичные гели. Застудневание. Свойства студней. Синерезис. Полуколлоиды.
Вопросы к зачету 1 семестр
Основные понятия химии: стехиометрические коэффициенты и индексы. Моль. Молярная масса. Химический эквивалент. Фактор эквивалентности и его расчеты, молярная масса эквивалента. Закон эквивалентов.
Стехиометрические коэффициенты — это числа, стоящие перед формулами веществ в уравнениях реакций. Они определяют соотношения количеств исходных веществ и продуктов реакции.
Стехиометрические индексы — это числа, стоящие в химических формулах справа внизу при символах химических элементов. Они характеризуют количественное содержание химических элементов в соединениях.
Моль — это количество вещества,
масса которого, выраженная в граммах,
численно равняется его молекулярной
массе.
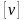
Моль
любого вещества содержит
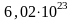 структурных
частиц
структурных
частиц
Постоянная
Авогадро:
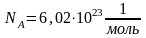
Молярная
масса
-
масса
вещества, взятого в количестве 1 моль,
измеряется в г/моль.
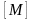
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1
МЭ = М×fЭ. |
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
э(реагента1) = … = э(реагентаn) = э(продукта1) = … = э(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
|
2. Основные законы химии: закон сохранения массы и энергии, закон кратных отношений, закон постоянства состава, закон Авогадро и следствия из него, закон простых объемных отношений.
Закон сохранения массы: масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Закон сохранения энергии: Энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой.
Е = тс2
Закон кратных отношений формулируется так: Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон постоянства состава: Всякое чистое вещество независимо от места нахождения и способа получения имеет один и тот же постоянный состав.
Закон Авогадро: В равных объемах газа при одинаковых условиях содержится равное количество молекул.
Следствие 1 из закона Авогадро. Один моль любого газа при одинаковых условиях занимает одинаковый объем.
В частности при нормальных условиях объем одного моля идеального газа
равен
22,4 л. Этот объем называют молярным
объемом 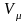 :
:
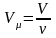
Следствие 2 из закона Авогадро. Отношение масс одинаковых объемов двух газов есть величина постоянная для данных газов. Эта величина называется относительной плотностью (D).
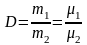
Закон простых объемных отношений: объемы вступающих в реакцию газов при неизменной температуре и давлении относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
4. Основные принципы квантовой теории строения вещества: корпускулярно-волновой дуализм, принцип неопределенности, волновая функция, уравнение Шредингера, атомная орбиталь.
Корпускулярно-волновой дуализм (или квантово-волновой дуализм) — свойство природы, состоящее в том, что материальные микроскопические объекты могут при одних условиях проявлять свойства классических волн, а при других — свойства классических частиц.
Дуализм – двойственность свойств.
Принцип неопределенности: Невозможно одновременно с точностью определить координаты и скорость квантовой частицы.
Движение электрона в атоме описывается волновой функцией. Эта функция приобретает разные значения в разных точках атомного пространства. Поскольку движение электрона - это волновой процесс, то определение волновой функции сводится к нахождению амплитуды волны. Она количественно находится из уравнения Шредингера. При этом волновая функция, являющаяся решением уравнения Шредингера, называется орбиталью.

Атомная орбиталь — это область пространства, в которой вероятность нахождения электрона максимальна.
По форме различают s-, p-, d- и f-орбитали. s-орбитали имеют форму шара, иными словами, электрон, находящийся на такой орбитали (его называют s-электроном), большую часть времени проводит внутри сферы. s-орбиталь, находящуюся на первом энергетическом уровне, обозначают 1s, на втором — 2s и т. д
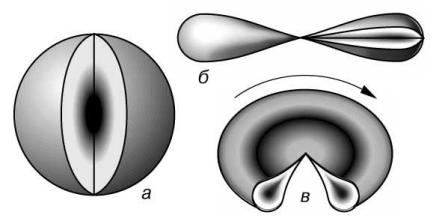
р-орбитали имеют форму объемной восьмерки (см. рис. б и в). Следует подчеркнуть, что любая орбиталь является объемной. Они могут быть направлены по одной из трех координатных осей (обозначаются px,py, pz), поэтому на каждом энергетическом уровне (кроме первого, где есть только s-орбиталь) существуют три р-орбитали, обладающие одинаковой энергией. Формы d- и f-орбиталей намного сложнее. Существует 5 форм d-орбиталей и 7 форм f-орбиталей. На каждой из орбиталей, как вы помните, могут размещаться не более двух электронов, следовательно, s-подуровень максимально вмещает 2 электрона, p — 6, d — 10, f — 14.

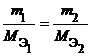 или
или 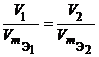 или
или