
Molekulyarnaya_biotekhnologia_Glik_B__Pasternak_Dzh
.pdf
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК
81
твердой фазе (растущая цепь ДНК фиксируется на твердом носителе), что позволяет проводить все реакции в одной емкости, легко отмывать после каждого этапа ненужные реагенты и добавлять новые в количестве, обеспечивающем возможно полное протекание реакции.
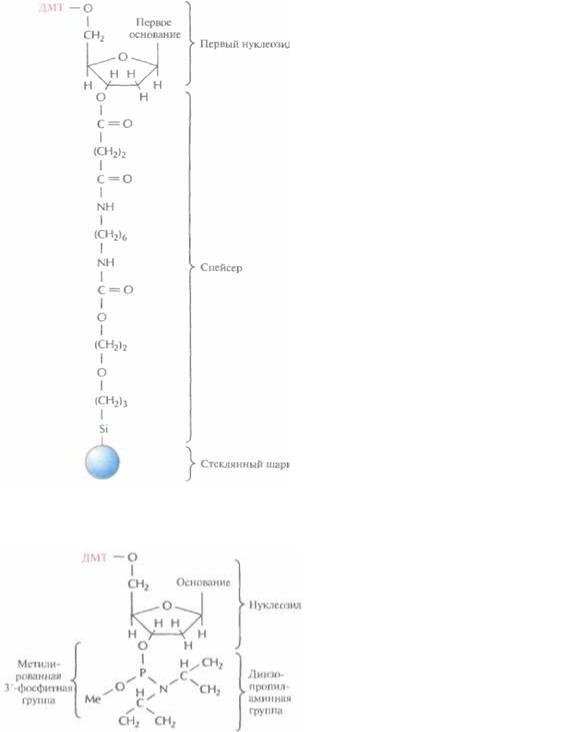
Этапы многоступенчатого синтеза представлены на рис. 5.1. Первый нуклеозид (азотистое основание + сахар) фиксируют на инертном твердом носителе, обычно это пористые стеклянные шарики с порами одинакового размера. 3'-гидроксильная группа первого нуклеозида, который будет 3'-концевым нуклеотидом синтезируемой цепи, прикрепляется к спейсерной молекуле, ковалентно связанной с носителем. Чтобы предотвратить неспецифическое взаимодействие 5'-гидроксильной группы первого нуклеотида до добавления в реакционную смесь второго нуклеотида, ее защищают с помощью диметокситритильной (ДМТ) группы (рис. 5.2). Такую группу содержит каждый присоединяемый к растущей цепи нуклеотид, а кроме того, он несет диизопропиламинную группу, присоединенную к 3'-фосфитной группе, которая в
Рис. 5.1. Химический синтез олигонуклеотида. После n циклов образуется одноцепочечный фрагмент ДНК из n + 1 нуклеотида.
82 |
ГЛАВА 5 |
Рис. 5.2. Комплекс, с которого начинается химический синтез цепи ДНК. К 5'- гидроксильной группе дезоксирибозы первого нуклеозида присоединена ди-метокситритильная (ДМТ) группа, а к 3'-гидроксиль-
ной группе — спейсерная молекула. Последняя в свою очередь связана с твердым носителем (пористым стеклянным шариком).
свою очередь защищена метальным остатком (рис. 5.3). Такая молекулярная конфигурация и называется фосфорамидитом.
Рис. S.3. Структурная формула фосфорамидита. Такие производные всех четырех оснований - А, Т, G и С — используются для химическою синтеза ДНК ДМТ — диметокситритил, Me — метальная группа.
Цикл начинается после присоединения первого нуклеозида к стекляному шарику. Далее колонку обильно промывают каким-либо безводным реагентом (например, ацетонитрилом), чтобы удалить воду и другие нуклеофильные вещества, и продувают через нее аргон для вытеснения ацетонитрила. Затем с помощью трихлоруксусной кислоты (ТХУ) отщепляют 5'- ДМТ (детритилирование) от присоединенного нуклеотида, с тем чтобы высвободить (экспонировать) реакционноспособную 5'-гидроксильную группу (рис. 5.4). Колонку вновь промывают ацетонитрилом для удаления ТХУ и продувают через нее аргон для удаления ацетонитрила. Процесс запрограммирован таким образом, чтобы на втором этапе в колонку одновременно вводились следующий нуклеозид (в виде фосфорамидита) и тетразол (активация и присоединение). Тетразол активирует фосфорамидит, так что 3'-фосфитная группа образует ковалентную связь с 5'-гидроксильной группой первого нуклеозида (рис. 5.5). Невключившийся фосфорамидит и тетразол удаляют продуванием аргона.
Поскольку по окончании первого этапа не все фиксированные на носителе нуклеозиды оказываются связанными с фосфорамидитом, необходимо предотвратить их взаимодействие с нуклеозидом, добавленным на втором этапе. Для этого непрореагировавшую 5'- гидроксильную группу ацетилируют с помощью уксусного ангидрида и диметиламинопиридина (кэппирование) (рис. 5.6). Если этого не сделать, то уже после нескольких циклов синтезируемые олигонуклеотиды будут различаться как по длине, так и по нуклеотидной последовательности.
Фосфиттриэфирная связь, образовавшаяся на втором этапе между нуклеотидами, нестабильна и может разорваться в присутствии кис-

Химический синтез, определение нуклеотидной последовательности и амплификация ДНК |
83 |
Рис. 5.4. Детритилирование
— отщепление 5'- диметокситритильной (ДМТ) группы с помощью трихлоруксусной кислоты (ТХУ).
Рис. 5.5. Активация и присоединение, 3'-фосфитная группа активированного фосфорамидита образует ковалентную связь с 5'-гидроксильной группой фиксированного на стеклянном шарике детритилированного нуклеозида. ДМТ — диметокситритильная группа, Me - метильная группа.

84 |
ГЛАВА 5 |
Рис. 5.6. Кэппирование. Свободные 5'-гидроксильные группы непрореагировавших в первом цикле детритилированных нуклеозидов ацетилируют, чтобы предотвратить их участие в следуюшем цикле.
лоты или щелочи. Поэтому фосфиттриэфир окисляют с помощью йодной смеси до более стабильного пятивалентного фосфаттриэфира (рис. 5.7). Затем промывают колонку и повторяют весь цикл (детритилирование, активация и присоединение, кэппирование, окисление; рис. 5.1). Все описанные операции проводят до тех пор, пока к растущей цепи в соответствии с программой не присоединится последний нуклеозид. Синтезированные олигонуклеотиды связаны со стеклянными шариками; каждый фосфаттриэфир несет метильную группу; каждый гуанин, цитозин и аденин содержит защищенную аминогруппу, а на 5'-конце последнего нуклеотида находится ДМТ - группа.
Метильные группы удаляют с помощью химической обработки непосредственно в реакционной колонке. Затем отсоединяют олигонуклеотиды от спейсерной молекулы вместе с 3'-гидроксильным концом и элюируют их из колонки; далее последовательно удаляют бензоильные, изобутирильные и ДМТ-группы. 5'-конец цепи фосфорилируют ферментативным (полинуклеотидкиназа Т4+АТР) или химиче-
Рис, 5.7. Окисление. Фосфиттриэфир
окисляется до пятивалентного фосфаттриэфира, что приводит к стабилизации фосфодиэфирной связи и делает ее более устойчивой к действию кислот и шелочей. ДМТ - диметокситритильная группа, Me
— метильная группа.

Химический синтез, определение нуклеотидной последовательности и амплификация ДНК |
85 |
ским методом. Эту реакцию можно проводить и тогда, когда олигонуклеотид еще связан с носителем, но после детритилирования.
Чтобы выход продукта был достаточно высок, эффективность присоединения нуклеотидов на каждом этапе должна быть не ниже 98%, Эффективность контролируют спектрофотометрическими методами, определяя количество удаляемых тритильных групп. Если, например, при синтезе 20-членного олигонуклеотида эффективность каждого цикла равна 99%, то 82% (т, е. 0,9920 · 100) олигонуклеотидов будут иметь именно такую длину. Если же синтезируется 60-членный олигонуклеотид, то при той же эффективности только 55% олигонуклеотидов будут содержать по 60 нуклеотидов. А если средняя эффективность цикла не превышает 98%, то доля олигонуклеотидов заданной длины будет гораздо ниже (табл. 5.1). Фирмы — изготовители коммерческих ДНК-синтезаторов обычно гарантируют среднее значение эффективности присоединения 98%. Но для этого необходимо использовать реагенты и химикаты очень высокой степени чистоты, что не всегда удается выполнить. Как правило, реальная эффективность присоединения составляет 95%, хотя иногда удается достичь и 99%-ной эффективности. Чтобы получить олигонуклеотиды заданной длины, первичные продукты большинства химических синтезов необходимо очистить с помощью либо высокоэффективной жидкостной хроматографии под высоким давлением с обращенной фазой, либо электрофореза в полиакриламидном геле. Поскольку все «неудачные» последовательности короче, чем тот олигонуклеотид, который хотят получить, сделать это нетрудно.
Таблица. 5.1. Средний выход олигонуклеотидов заданной длины (л) при разных значениях средней эффективности цикла
Эффективность, % |
Средний выход, % |
Применение синтезированных олигонуклеотидов
Олигонуклеотиды, синтезированные химическими методами, находят широкое применение в молекулярной биотехнологии. Их используют в качестве зондов при ДНКгибридизации, линкеров, соединяющих разные молекулы ДНК в экспериментах по клонированию, праймеров при секвенировании ДНК или осуществлении сайтспецифического мутагенеза клонированных генов-мишеней,
1.Нуклеотидную последовательность специфических олигонуклеотидных зондов (длиной 20—40 звеньев) находят из данных об аминокислотной последовательности соответствующих белков.
2.Для получения линкеров синтезируют олигомеры, которые представляют собой палиндромные одноцепочечные нуклеотидные последовательности, спаривающиеся (гибридизующиеся) между собой. Линкеры содержат сайты узнавания для рестрицирующих эндонуклеаз, что позволяет осуществлять с их помощью клонирование фрагментов ДНК (рис. 5.8, А и Б). Короткий дуплекс длиной 6—12 пар нуклеотидов лигируют по тупым концам с ДНК-мишенью (обычно кДНК). Разрезают новую молекулу нужной рестрицирующей эндонуклеазой и получают фрагменты с выступающими одноцепочечными концами (липкими концами), с помощью которых встраивают ДНК-мишень в соответствующий вектор. Прежде чем проводить встраивание, рестрицированную смесь фракционируют для отделения ДНК с липкими концами от лишних линкерных молекул. Вектор тоже обрабатывают рестриктазой, отжигают его с фрагментами ДНК с липкими концами и сшивают с помощью ДНК-лигазы фага Т4. ДНК-мишень не должна содержать сайтов рестрикции, присутствующих в линкерной последовательности, в противном случае она также будет расщепляться ферментом.
3.Один из вариантов линкерных последовательностей, так называемые «адаптеры»,
час-

86 |
ГЛАВА 5 |
Рис. 5.8. Типичные линкеры и адаптер. А, EcoRIлинкер, состоящий из 6 пар нуклеотидов. Б. EcoRIлинкер из 8 пар нуклеотидов. В. BamHI-SmaI - адаптер с BamHI-липкими концами и сайтом узнавания для SmaI.
то содержат сайты для двух и более рестрицирующих эндонуклеаз (рис. 5,8, В). С их помощью можно встраивать кДНК в вектор лигированием по тупым концам, а затем вырезать, используя другую рестриктазу, Адаптор, изображенный на рис. 5.8, В, встраивают в BamНI-сайт вектора перед включением ДНК-мишени в SmaI-сайт по тупым концам. После клонирования кДНК вырезают из вектора с помощью рсстриктазы BamHI. В этом случае вектор не должен содержать SmаI-сайтов, и ни вектор, ни кДНК не должны нести ВаmHIсайтов,
4, Одноцепочечные олигонуклеотиды из -17—24 звеньев используют в качестве праймеров при секвенировании ДНК и проведении ПЦР.
5.Одноцепочечные олигонуклеотиды используют в качестве праймеров для сайтспецифического мутагенеза in vitro.
6.Необходимость в химическом синтезе нуклеотидной последовательности, кодирующей какой-то конкретный белок, может возникнуть тогда, когда клонирование соответствующего гена затруднено. При этом нуклеотидную последовательность гена находят из данных об аминокислотной последовательности белка. К химическому синтезу прибегают и тогда, когда кодоны, из которых состоит данный ген, плохо считываются организмом-хозяином, и уровень трансляции оказывается очень низким. В таком случае можно синтезировать ген с таким набором кодонов (оптимизация кодонов), при котором аминокислотная последовательность кодируемого белка остается прежней, а кодоны считываются хозяйским организмом более эффективно.
Синтез генов
Если химически синтезированную двухцепочечную ДНК предполагается использовать в качестве гена или его фрагмента, то каждую из ее цепей синтезируют отдельно. Получить короткие гены (60—80 п. н.) технически несложно: для этого синтезируют комплементарные цепи и затем отжигают их. В случае крупных генов (>300 п. н.) приходится применять специальные стратегии, поскольку эффективность каждого цикла химического синтеза никогда не достигает 100%, Например, если ген состоит из 999 пар нуклеотидов, а эффективность каждого цикла равна 99%, то доля полноразмерных одноцепочечных ДНК по окончании процесса составит не более 0,004%. Чтобы решить эту проблему, синтетические (двухцепочечные) гены собирают из модулей — (одноцепочечных) фрагментов длиной от 20 до 100 нуклеотидов.
Один из способов конструирования синтетического гена заключается в получении набора олигонуклеотидов длиной 20—60 нуклеотидов каждый с перекрывающимися концами. Нуклеотидные последовательности цепей задают так, чтобы после отжига концевые сегменты гена имели тупые концы. Каждый внутренний сегмент имеет выступающие 3'- и 5'-концы, комплементарные таковым соседнего сегмента (рис. 5.9). После сборки гена остается сшить од-

Химический синтез, определение нуклеотидной последовательности и амплификация ДНК |
87 |
Рис. 5.9. Сборка синтетического гена из коротких олигонуклеотидов. Синтезируют отдельные олигонуклеотиды длиной от 20 до 60 звеньев каждый с такими нуклеотидными последовательностями, чтобы при отжиге из них образовалась двуцепочечная молекула. Оставшиеся одноцепочечные разрывы сшивают с помощью ДНК-лигазы Т4.
ноцепочечные разрывы с помощью ДНК-лигазы Т4. Синтетические гены могут быть сконструированы так, чтобы помимо белок-кодирующих последовательностей они содержали концевые участки, обеспечивающие их встраивание в клонирующий вектор (сайты для рестрицируюших эндонуклеаз), а также, если это необходимо, сигнальные последовательности для правильной инициации и терминации транскрипции и трансляции.
Для получения полноразмерных генов другим способом тоже вначале синтезируют специфический набор перекрывающихся олигонуклеотидов длиной от 40 до 100 звеньев. При их отжиге происходит спаривание 6—10 3'- и 5'-концевых взаимно комплементарных нуклеотидов, а между ними остаются большие бреши. Протяженность спаренных участков достаточно велика, чтобы стабилизировать всю структуру. Бреши заполняют ферментативным путем с помощью ДНК-полимеразы I Escherichia coli, использующей 3'-гидроксильные группы для инициации репликации и одноцепочечные участки в качестве матрицы. Оставшиеся одноцепочечные разрывы сшивают с помощью ДНК-лигазы Т4 (рис. 5.10).
Более протяженные гены (>1000 п. н.) обычно собирают из двухцепочечных фрагментов, каждый из которых в свою очередь состоит из 4-6 перекрывающихся олигонуклеотидов (от 20 до 60 п. н, каждый). Если после синтеза и отжига образуется достаточное количество фрагментов, то их просто соединяют друг с другом. В противном случае каждый фрагмент клонируют и амплифицируют. Двуцепочечные фрагменты последовательно соединяют друг с другом до образования полноразмерного гена. Чтобы гарантировать

88 |
ГЛАВА 5 |
Рис. 5.10. Сборка протяженного гена in vitro с участием ферментов. Вначале химическими методами синтезируют отдельные олигонуклеотиды с такими нуклеотидными последовательностями, чтобы при отжиге между ними образовывались спаренные участки длиной 6—10 пар нуклеотидов. Оставшиеся между ними бреши заполняют с помощью ДНК-полимеразы I Е. coli, а одноцепочечные разрывы сшивают ДНК-лигазой Т4.
правильность нуклеотидной последовательности химически синтезированного гена, секвенируют каждый двухцепочечный фрагмент, а затем и весь ген.
Методы секвенирования ДНК
Исчерпывающую информацию о молекуле ДНК можно получить, только определив ее нуклеотидную последовательность. Так, секвенировав ген, часто удается установить его функцию, сравнив его нуклеотидную последовательность с таковыми для генов, функция которых уже известна. Без данных о нуклеотидной последовательности невозможно проводить исследования по молекулярному клонированию. Секвенирование того или иного фрагмента ДНК можно провести либо химическим методом, разработанным А. Максамом и В. Гилбертом, либо ферментативным, предложенным Ф. Сангером, но в

Химический синтез, определение нуклеотидной последовательности и амплификация ДНК |
89 |
Секвенирование ДНК с помощью терминирующих дидезоксинуклеотидов
F. Sanger, S. Nicklen, A. R. Coulson
Proc. Nail. Acad. Set. USA 74: 5463-5467, 1977
Специфическая ферментативная амплификация ДНК in vitro: полимеразная цепная реакция
К. В. Mullis, F. A. Faloona, S, J. Scharf, R. K. Saiki, G. T. Horn, H. A. Erich Cold Spring Harbor Symp, Quant. Biol. 51: 263-273, 1986
Создание |
новых |
методов |
раньше |
|
секвенирование |
|
создана |
|
|
|
система |
|||||||||||||
— |
это |
|
|
необходимая |
нуклеиновых кислот сводилось к клонирования |
на основе |
фага |
|||||||||||||||||
предпосылка развития любой |
определению |
нуклеотидных M13. Возможность |
прямого |
|||||||||||||||||||||
отрасли |
|
науки. |
|
Они |
последовательностей |
РНК. |
Для секвенирования |
|
|
ДНК |
||||||||||||||
позволяют |
|
|
|
получать |
этого |
нужный |
фрагмент |
ДНК произвела |
|
|
настоящую |
|||||||||||||
недоступную |
|
|
прежде |
сначала |
транскрибировали |
в революцию |
в |
исследовании |
||||||||||||||||
информацию, что в свою |
РНК |
с |
помощью |
РНК-пол молекулярных |
|
|
основ |
|||||||||||||||||
очередь |
приводит |
к |
более |
имеразы, |
а |
затем |
определяли различных болезней человека и |
|||||||||||||||||
глубокому |
пониманию |
сути |
нуклеотидную |
|
|
|
|
в |
разработке |
методов |
их |
|||||||||||||
наблюдаемых |
|
явлений |
и |
последовательность |
последней. диагностики |
|
и |
лечения. |
||||||||||||||||
стимулирует |
|
дальнейшие |
Процедура была весьма сложной Огромное |
влияние на |
многие |
|||||||||||||||||||
исследования, |
порождающие |
и длительной |
и состояла |
в области |
исследований, |
в |
том |
|||||||||||||||||
новые открытия. Что касается |
следующем: |
|
радиоактивно числе |
и |
на |
молекулярную |
||||||||||||||||||
молекулярной биотехнологии, |
меченную |
РНК |
обрабатывали биотехнологию, |
|
|
оказала |
||||||||||||||||||
то ее основой стали такие |
различными |
рибонуклеазами, |
разработка метода ПЦР |
(Kary |
||||||||||||||||||||
мощные |
|
методы, |
|
как |
затем |
|
|
осуществляли Mullis; |
U.S. |
patent 4,683,202), |
||||||||||||||
секвенирование ДНК и ПЦР. |
хроматографическое разделение С |
возможностью |
получения |
|||||||||||||||||||||
Определение |
нуклеотидной |
образовавшихся |
|
продуктов, |
больших |
количеств |
ДНК |
|||||||||||||||||
последовательности |
|
ДНК |
повторно |
|
обрабатывали |
|
их амплификацией |
|
сегментов |
|||||||||||||||
методом |
ферментативного |
ферментами, |
|
проводили клонированной |
или |
геномной |
||||||||||||||||||
копирования |
с |
остановкой |
щелочной гидролиз продуктов ДНК была решена проблема |
|||||||||||||||||||||
удлинения |
|
|
|
|
цепи, |
второго |
|
|
расщепления, |
клонирования |
|
ДНК-копий |
||||||||||||
осуществляемого |
|
ДНКосуществляли |
|
|
|
|
редких |
|
молекул |
|
мРНК, |
|||||||||||||
полимеразой, — быстрый, хроматографическое |
|
|
|
скрининга |
|
|
геномных |
|||||||||||||||||
относительно |
|
|
простой, |
разделение |
|
|
продуктов библиотек, выявления генных |
|||||||||||||||||
недорогой и надежный метод. |
гидролиза, |
|
|
определяли мутаций, |
|
|
физического |
|||||||||||||||||
Помимо |
|
|
того |
|
|
что |
очередность |
олигонуклеотидов, картирования хромосом и т. д. |
||||||||||||||||
нуклеотидная |
|
|
|
|
|
основываясь |
на |
перекрывании |
Первым |
|
|
практическим |
||||||||||||
последовательность |
|
|
|
их |
концевых |
участков, |
|
и |
применением |
|
ПЦР |
было |
||||||||||||
фрагмента ДНК является его |
воссоздавали |
|
исходную |
создание |
тест-системы |
для |
||||||||||||||||||
исчерпывающей |
|
|
|
|
молекулу. |
|
С |
|
появлением |
диагностики |
|
|
|
|
|
|||||||||
характеристикой |
|
|
|
на |
дидезокси-метода эта процедура |
серповидноклеточной |
анемии |
|||||||||||||||||
молекулярном |
|
уровне, |
|
она |
практически |
|
|
перестала (Saîki et al., Science 230: 1350- |
||||||||||||||||
позволяет |
|
|
|
|
также |
использоваться. |
|
Теперь 1354, |
1985). |
|
ПЦР |
— |
это |
|||||||||||
идентифицировать |
|
|
его |
секвенируют не саму РНК, а |
уникальная методика, равных |
|||||||||||||||||||
кодирующую |
|
|
область, |
ДНК, |
синтезированную |
|
на |
которой |
нет |
|
среди |
других |
||||||||||||
подобрать |
|
потенциальные |
РНК как на матрице с помощью |
хорошо |
|
известных |
методов. |
|||||||||||||||||
праймеры для ПЦР, выявить |
обратной |
|
транскриптазы, |
и |
Начиная |
с |
1986 |
г. |
с |
ее |
||||||||||||||
мутационные |
изменения |
в |
применяют не метод Максама и |
помощью выполнено более 10 |
||||||||||||||||||||
гене. До появления в 1977 г. |
Гилберта, а метод Сангера, |
000 исследований, и несмотря |
||||||||||||||||||||||
дидезоксиметода Сангера для |
появившийся после того, как |
на их огромное разнообразие, |
||||||||||||||||||||||
секвенирования |
|
|
ДНК |
была |
|
|
|
|
|
|
|
перспективы |
|
использования |
||||||||||
использовали |
|
метод |
сайт- |
|
|
|
|
|
|
|
|
ПЦР представляются еще более |
||||||||||||
специфического |
|
|
|
|
|
|
|
|
|
|
|
|
впечатляющими. |
|
|
|
||||||||
химического |
расщепления |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
цепи (А. М, |
Maxani, |
W. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Gilbert, Proc. Natl. Acad. Sei. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
USA 74: 560-564, 1977). А еще |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
настоящее время наиболее широко используется так называемый дидезоксинуклеотидный метод.
Дидезоксинуклеотидный метод секвенирования ДНК
Дидезоксинуклеотид — это полученный искусственным путем нуклеотид, лишенный 2'- и 3'- гидроксильных групп при углеродных атомах сахарного кольца (рис. 5.11, А). У дезоксинуклеотида, входящего в норме в состав ДНК, отсутствует только 2'-гидроксильная группа (рис. 5.11,5). Удлинение цепи во время репликации ДНК происходит в результате присоединения очередного нуклеозидтрифосфата к 3'-гидроксильной груп-

90 |
ГЛАВА 5 |
Рис, 5.11. А. Дидезоксинуклеотид (отсутствуют 2'- и 3'-гидроксильные группы в кольце). Б. Дезоксинуклеотид (отсутствует только 2'- гидроксильная группа).
пе последнего нуклеотида растущей цепи (рис. 5.12). И если таким очередным присоединяемым звеном является Дидезоксинуклеотид, то синтез ДНК останавливается, поскольку следующий нуклеотид не может образовать фосфодиэфирную связь (рис. 5.13). Остановка синтеза ДНК — это ключевой этап дидезоксиметода, но чтобы осуществить секвенирование в полном объеме, необходимо выполнить целый ряд условий.
Первый шаг стандартной процедуры дидезоксисеквенирования состоит в гибридизации синтетического олигонуклеотида длиной 17—20 звеньев со специфическим участком одной из цепей клонирующего вектора, соседствующим со вставкой. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную группу для инициации синтеза. Раствор с праймером распределяют по четырем пробиркам, в каждой из которых находятся четыре дезоксинуклеотида, dATP, dCTP, dGTP и dTTP (один из них — изотопно меченный), и один из четырех дидезоксинуклеотидов (ddATP, ddCTP, ddGTP или ddTTP). Концентрацию каждого дидезоксинуклеотида подбирают таким образом, чтобы он оказался включенным по всем позициям в смеси растущих цепей, а не только в первой встретившейся ему позиции. (Напомним, что после присоединения дидезоксинуклеотида рост цепи сразу останавливается,
Рнс. 5,12. Синтез ДНК в обычных условиях. Очередной дезоксирибонуклеотид (дезоксирибонуклеозидтрифосфат; dNTP) спаривается с комплементарным нуклеотидом матричной цепи. Между 3'-гидроксильной группой последнего нуклеотида в растущей цепи и α-фосфатной группой присоединяемого нуклеотида образуется фосфодиэфирная связь.
поэтому каждая цепь оканчивается 3'-дидезоксинуклеотидом.) По окончании ферментативного синтеза при участии ДНК-полимеразы в каждой пробирке оказывается уникальный набор олигонуклеотидов, каждый из которых содержит праймерную последовательность (рис. 5.14).
Далее в пробирки добавляют формамид, чтобы обеспечить расхождение цепей, и проводят электрофорез в полиакриламидном геле на четырех дорожках (по числу пробирок). Это поз-
