
Molekulyarnaya_biotekhnologia_Glik_B__Pasternak_Dzh
.pdf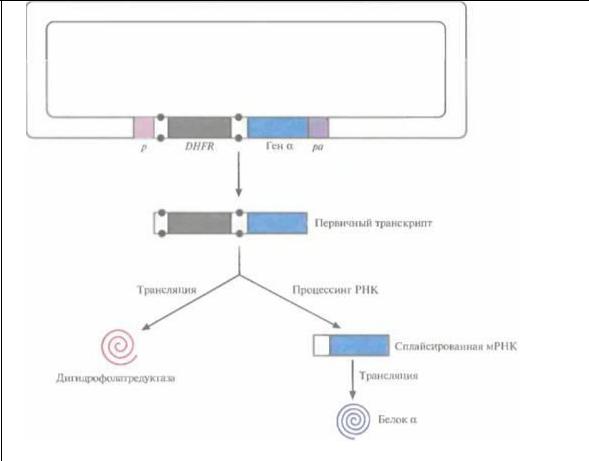
Получение рекомбинантных белков с помощью эукариотических систем 151
Высокий уровень экспрессии клонированного гена достигался при ее координации с экспрессией селективного маркерного гена, Для этого, например, ген DHFR встраивали поблизости от клонированного гена, так чтобы оба гена находились под контролем одного промотора и имели общий сигнал полиаденилирования, а ген DHFR был фланкирован сайтами сплайсинга интрона. DHFR и рекомбинантный белок, транслировались с первичного транскрипта и сплайсированной мРНК соответственно (рис. 7.14).
Экспрессия двух клонированных генов в одной клетке млекопитающих
Некоторые ценные в коммерческом отношении белки в активной форме состоят из разных полипептидных цепей. Например, тиреотропный гормон человека — это гетеродимер, а гемоглобин — тетрамер, состоящий из двух субъединиц, по две копии каждая (α2β2). Чтобы получить активный мультимерный белок, можно попытаться клонировать ген или кДНК каждой из субъединиц, синтезировать и очистить
Рис. 7.14. Координированная экспрессия генов дигидрофолатредуктазы (DHFR) и рекомбинантного белка. Ген DHFR встроен между донорным и акцепторным сайтами сплайсинга интрона (точки), перед геном-мишенью (ген α). И ген DHFR, и клонированный ген находятся под контролем одного эукариотического промотора (р) и имеют общий сигнал полиаденилирования (pa). DHFR транслируется с несплайсированного (первичного) транскрипта, а гетерологичный белок (белок α) — с транскрипта, подвергшегося процессингу (сплайсингу).

152 |
Глава 7 |
субъединицы, а затем смешать их в пробирке. Однако таким образом удается получить лишь немногие мультимерные белки, поскольку in vitro правильная укладка полипептидных цепей осуществляется редко. Сборка же димерных и тетрамерных белков in vivo протекает весьма эффективно. Поэтому были разработаны стратегии синтеза двух разных рекомбинантных белков в одной клетке.
Для этого хозяйские клетки одновременно трансфицировали двумя экспрессирующими векторами млекопитающих, каждый из которых нес ген или кДНК одной из субъединиц и разные гены селективных маркеров (рис. 7.15). Трансфицированные клетки подвергали двойному отбору, соответственно и выжившие клетки несли оба вектора. Системы с двумя векторами успешно использовались для синтеза аутентичных димерных и тетрамерных рекомбинантных белков. К сожалению, дважды Трансфицированные клетки часто утрачивают один из двух векторов. Кроме того, число копий каждого из векторов не всегда одинаково, так что одна субъединица может синтезиро-
Рис. 7.15. Двухвекторная система экспрессии. Клонированные гены (а и β) кодируют субъединицы димерного белка (αβ). После одновременной трансфекции клетки двумя плазмидам и в ней синтезируются обе субъединицы и собирается функциональный димерный белок. Оба вектора несут сайты инициации репликации, функционирующие в E. coli(oriE) и в клетках млекопитающих (oriE); маркерный ген (Ampr) для отбора трансформированных клеток Е. coli; эукариотический промотор (р) и сигнал полиаденилирования (ра), которые регулируют экспрессию селективного маркерного гена (СМ) и каждого из клонированных генов.

Получение рекомбинантных белков с помощью эукариотических систем |
153 |
ваться в большем количестве, чем другая, и выход конечного продукта может снижаться. Чтобы решить эти проблемы, были сконструированы векторы, содержащие оба клонированных гена. В некоторых случаях они были помещены под контроль независимых промоторов и сигналов пол над енилирования (рис. 7.16). А для того чтобы гарантировать синтез рекомбинантных белков в одинаковом количестве, были созданы так называемые двухцистронные векторы, в которых клонированные гены разделялись сегментом ДНК, содержащим внутренний сайт связывания рибосом. Такие сайты были обнаружены в геномах вирусов млекопитающих; они обеспечивают одновременную трансляцию различных белков с полицистронной мРНК. Транскрипция конструкции «ген—внутренний сайт связывания рибосом—ген» регулируется одним промотором и одним сигналом полиаденилирования. Синтезируется один транскрипт с двумя генами, трансляция начинается с 5'-конца мРНК и с внутреннего сайта, в результате синтезируются субъединицы димерного белка α и β (рис. 7.17).
Суммируя, можно сказать, что экспрессирующие векторы млекопитающих столь же универсальны и эффективны, как и векторы для других эукариотических систем экспрессии, если речь идет о получении аутентичных рекомбинантных белков для исследовательских и медицинских целей. Однако промышленный синтез рекомбинантных белков с использованием модифицированных клеток млекопитающих обходится слишком дорого. В этом случае предпочтительны менее дорогие системы экспрессии, за исключением тех ситуаций, когда
Рис. 7.16.
Экспрессирующий вектор с двумя независимо транскрибируемыми генами. Клонированные гены (а и β) кодируют субъединицы димерного белка (αβ). Каждый ген встроен в вектор как часть отдельной единицы транскрипции и находится под контролем эукариотического промотора (р) и сигнала полиаденилирования (ра).
Каждая |
субъединица |
|
транслируется |
со |
|
своей |
|
мРНК; |
объединяясь, |
|
|
субъединицы |
|
образуют |
функциональный димерный белок (αβ). Векторы содержат сайты инициации репликации, функционирующие в E. coli (oriE) и в клетках млекопитающих (orieuk); маркерный ген (Ampr) для отбора
трансформированных |
|
|
клеток |
E. |
соli; |
селективный |
маркерный |
|
ген (СМ), находящийся под контролем эукариотических промотора {р) и сигнала полиаденилирования (ра).

154 |
ГЛАВА 7 |
аутентичности рекомбинантного белка удается достичь только с помощью культуры клеток млекопитающих.
Рис. 7.17. Двухцистронный экспрессирующий вектор. Клонированные гены (α и β) кодируют субъединицы димерного белка (α ß). Они разделены сегментом ДНК, который после транскрипции, на уровне мРНК, играет роль внутреннего сайта связывания рибосом. Каждый ген находится под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра). Трансляция мРНК начинается с 5'-конца и с внутреннего сайта (угловые стрелки). Синтезированные субъединицы объединяются с образованием функционального димерного белка. Вектор содержит сайты инициации репликации, функционирующие в E. coli (oriE) и в клетках млекопитающих (orieuk)', селективный маркерный ген (Ampr) для отбора трансформированных клеток Е. соli; селективный маркерный ген (СМ), находящийся под контролем эукариотических промотора (р) и сигнала полиаденилирования (ра).
Прокариотические системы экспрессии успешно используются для синтеза многих белков. Однако некоторые белки для превращения в активную форму должны претерпеть специфические посттрансляционные модификации — гликозилирование, фосфорилирование или ацетилирование, а бактерии к этому не способны. Поэтому было решено попытаться экспрессировать клонированные гены в эукариотических клетках с помощью специально созданных эукариотических экспрессирующих векторов.
Для синтеза разнообразных белков, кодируемых клонированными генами, использовались дрожжи S. cerevisiae. Их генетика хорошо изучена, а кроме того, их можно выращивать в больших ферментерах. Чтобы упростить очистку белков, были сконструированы векторы, обеспечивающие их секрецию. С помощью 5. cerevisiae было получено множество самых разных аутентичных белков. Однако многие рекомбинантные белки в этой системе не подвергались посттрансляционной модификации, к тому же их выход зачастую был недостаточно высок. Поэтому были предприняты попытки разработать другие дрожжевые системы синтеза рекомбинантных белков.
В поисках других эукариотических систем экспрессии, с помощью которых можно было бы получать биологически активные белки, исследователи сосредоточили усилия на создании экспрессирующих векторов на основе бакуловирусов, в частности бакуловируса AcMNPV, инфицирующего клетки многих насекомых. Исходная стратегия предполагала трансфекцию клеток насекомого, зараженных AcMNPV, транспортным вектором, который содержал клонированный ген, фланкированный AcMNPV-специфичными последовательностями. В результате двойного кроссинговера между вектором и геном AcMNPV клонированный ген встраивался в последний и попадал под контроль сильного промотора, функционирующего на последних стадиях логического цикла. Клетки насекомого, инфицированные рекомбинантным бакуловирусом, синтезировали гетерологичный белок.
Получение рекомбинантных белков с помощью эукариотических систем |
155 |
Частоту появления рекомбинантных бакуловирусов удалось повысить с менее чем 1% до 99%. Для этого ДНК AcMNPV обрабатывали эндонуклеазой рестрикции, которая расщепляла ДНК в двух специфичных сайтах с высвобождением фрагмента, несущего часть гена, необходимого для осуществления литического цикла. Клетки насекомого трансфицировали этим фрагментом, а затем — транспортным вектором, В результате двойного кроссинговера в некоторых клетках восстанавливался кольцевой геном AcMNPV, который содержал клонированный ген и функциональный ген, необходимый для осуществления литического цикла. В результате почти все вирулентные бакуловирусы оказывались рекомбинантными.
Следующий шаг в усовершенствовании системы экспрессии на основе бакуловирусов состоял в создании бакмиды, челночного вектора Е. соli/клетки насекомого, позволяющего проводить все генноинженерные манипуляции в Е. coll. Клетки насекомого трансфицировали рекомбинантной бакмидой только с целью получения гетерологичного белка. Примерно 95% гетерологичных белков, синтезированных в системах экспрессии на основе бакуловирусов, имели соответствующие посттрансляционные модификации.
Внехромосомные экспрессирующие векторы млекопитающих обычно применяют для синтеза гетерологичных белков, использующихся в научных или медицинских целях. Они представляют собой челночные векторы с сайтами инициации репликации вируса животных и Е. соli-плазмиды, Регуляторные элементы транскрипции обычно происходят из генома вируса животных или из геномов млекопитающих. Для отбора трансфицированных клеток используют доминантные селективные маркерные гены. Некоторые системы отбора основаны на введении в среду возрастающего количества цитотоксичного соединения и позволяют получать клетки, содержащие большое число копий вектора, что увеличивает выход чужеродного белка.
Разработаны системы экспрессии млекопитающих, позволяющие получать белки, состоящие из двух разных субъединиц. Для этого хо-
зяйские клетки трансфицировали сразу двумя векторами, каждый из которых нес ген одной из субъединиц. Альтернативный подход состоял в использовании одного вектора, который нес эти два гена в виде отдельных единиц транскрипции или в виде одного транскриптона, содержащего оба этих гена.
ЛИТЕРАТУРА
Cockett M. I., С. R. Beddington, G. T. Yarranton.
1990. High level expression of tissue inhibitor or metalloproteinases in Chinese hamster ovary cells using glutamine synthetase gene amplification. Bio/Technology 8: 662-667.
Cole E. S., K. Lee, K. Lau/iere, C. Kelton, S. Chappel, B. Weintraub, I). Ferrara, F. Peterson, R. Bernasconi, T. Edmunds, S. Richards, L. Dickrell, I. M. Kleeman, J. II. McPhersun, B. M. Pratt. 19УЗ. Recombinanl human thyroid stimulating hormone: development of a biotechnology product for detection of metasla tic lesions of thyroid carcinoma. Bio/Technology 11: 1014-1024.
Cregg J. M., J. F. Tschopp, C. Stillman, R. Siegel, M. Akong, W. S. Craig, R. G.
Buckhnl/, К. R. Madden, P. A. Kellaris, G. R. Davis, B. L. Smiley, J. Cruzc, R. Torregrossa, G. Veiicclebi, G. P. Thill. 1987. High-level expression and efficient assembly of hepatitis В surface antigen in the methylotrophic yeast, Pichla pastoris. Bio/Technology 5: 479-485.
Davîes A. H. 1994, Current methods for manipulating baculovirus, Bio/Technology 12: 47—50.
Digan M. E., S. V. Lair, R. A. Brieriey, R. S. Siegel, M. E. Williams, S. B. Ellis, P. A. Kellaris, S. A. Provow, W. S. Craig, G. Velicelebi, M. M. Harpold, G. P. ThiU. 1989. Continuous production of a novel lysozyme via secretion from the yeast, Pichia pastoris. Bio/Technology 7: 160-164.
Dirks W., M. Wirth, H. Hauser. 1993. Dicistronic transcription units lor gent expression in mammalian cells. Gene 128: 247-24'λ
Gellissen G., Z. A. Janowicz, U. Weydemann, K. Melber, A. W. M. Strasser, C. P.
Hollenberg. 1992, High-level expression of foreign genes in
156 |
ГЛАВА 7 |
Hansenula polymorpha. Bioiechnol. Adv. 10: 179-189,
Giga-Hama Y., H. Tohda, H. Okada, M. K. Owada, H. Okayama, II. Kumagai. 1994. Highlevel expression of human lipocortin I in the fission yeast Schizosaccharomyces pombe using a novel expression vector. Bio/Technology 12: 400-404.
Gilbert S. C., H. van Urk, A. J. Greenfield, M. J. McAvoy, K. A. Denton, D. Coghlan, G. D. Jones, D. J. Mead. 1994. Increase in copy number of an integrated vector during continuous culture of Hansenula polymorpha expressing functional human hemoglobin. Yeast 10: 1569-1580.
The Global Use of Strategies to Open Occluded Arteries (GUSTO) lib Investigators. 1996. A comparison of recombinant hirudin with heparin for the treatment of acute coronary syndromes.
N. Engl. J. Med. 335: 775-782.
Hallewell R. Α., R. Mills, P. Tekamp-OLson, R. Blacher, S. Rosenberg, F. Otting, F. R. Masiarz,
C.J. Scandella. 1987. Amino terminal acetyla-tion of authentic human Cu, Zn Superoxide dis-mutase produced in yeast. Bio/Technology 5: 363-366.
Kidd L M., V. C. Emery. 1993. The use of baculoviruses as expression vectors. Appl. Biochem. Biotechnol. 42: 137-159.
Kitts P. A., R. D. Possee. 1993. A method for producing recombinant baculovirus expression vectors at high frequency. BioTechniques 14: 810-817.
Laroche Y., V. Strome, J. DeMeutter, J. Messens, M. Lauwereys. 1994. High-level secretion and very efficient isotopic labeling of tick anticoagulant peptide (TAP) expressed in the methylotrophic yeast, Picftia postons. Bio/Technology 12: 1119-1124.
Loison G., A. Findeli, S. Bernard, M. Nguyen-Juilleret, M. Marquet, N. Riehl-Bellon,
D.Carvallo, L. Guerra-Santos, S. W. Brown, M. Courtney, C. Roitsch, Y. Lemoine. 1988. Expression and secretion in S. cerevisiae of biologically active leech hirudin. Bio/Technology 6: 72-77.
Lucas B. K., L. M. Giere, R, A. DeMarco, A. Shen, V. Chisholm, C. W. Crowley. 1996. High-level production of recombinant proteins in CHO cells
using a dicistronic DHFR intron expression vector. Nucleic Acids Res. 24: 1774-1779.
Lucknow V. A., S. C. L«e, G. F. Barry, P. O. Olins. 1993, Efficient generation of infectious recombinant baculoviruses by site-specific transposon-mediated insertioin of foreign genes into a baculovirus genome propagated in Eschericia coli. J. VIrol. 67: 4566-4579.
Peng S., M. SommtrFelt, J. Logan, Z. Huang, T. Jilling, K. Kirk, E. Hunter, E. Sorscher. 1993. One-step affinity isolation of recombinant protein using the baculovirus/insect expression system. Protein Expr. Purif. 4: 95-100.
Robinson A. S., V. Hines, K. D. Wittrup. 1994. Protein disulfide isomerase overexpression increases secretion of foreign proteins in Saccharomyces cerevisiae. Bio/Technology 12: 381-384,
Romanes Μ. Α., C. A. Scorer, J. J. Clare. 1992, Foreign gene expression in yeast: a review. Yeast 8: 423-488.
Vozza L. A., L. Wittmer, D. R. Higgins, T. J. Purcell, M. Bergseid, L. A. Collins-Racie, E. R. LaVaUie, J. P. Hoeffler. 1996, Production of a recombi-rtant bovine enterokinase catalytic subunit in the methylotrophic yeast, Pichia pastoris. Bio/ Technology 14: 77-81.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Почему для получения белков, использующихся в медицине, лучше применять эукариотические, а не прокариотические системы?
2.Какие достоинства и недостатки имеют различные типы дрожжевых векторов, предназначенных для получения данного рекомбинантного продукта?
3.Опишите основные свойства интегративной векторной системы P. pastoris, обладающей высоким уровнем экспрессии,
4.Что такое бакуловирусы? Опишите исходную систему экспрессии на основе бакуловирусов и ее последующие модификации.
5.Что такое бакмида? Для чего ее используют?
Получение рекомбинантных белков с помощью эукариотических систем |
157 |
6.Что такое аффинная метка? Для чего ее используют?
7.Опишите основные свойства внехромосомного экспрессирующего вектора млекопитающих.
8.Опишите как минимум две селективные системы, использующиеся в случае экспрессирующих векторов млекопитающих.
9.Опишите разные подходы к созданию систем синтеза двух рекомбинантных белков в одной клетке млекопитающего.
10.Какими критериями руководствуются при выборе системы экспрессии генов гетерологичных белков (дрожжи, система экспрессии на основе бакуловирусов, клетки млекопитающих)?
ГЛАВА 8 Направленный мутагенез и генная инженерия белков
Технология рекомбинантных ДНК позволяет выделять гены любых белков, существующих в природе, экспрессировать их в специфическом хозяйском организме и получать чистые белковые продукты. Однако физические и химические свойства таких «природных» белков часто не удовлетворяют условиям, обеспечивающим возможность их промышленного применения. Иногда для получения белков, обладающих нужными свойствами, в качестве источника соответствующих генов используют организмы, растущие в необычных, зачастую экстремальных условиях. Например, для синтеза α -амилазы, не утрачивающей своей активности при высокой температуре, выделили ее ген из Bacillus stearothermophilus — бактерии, естественной средой обитания которой являются горячие источники с температурой воды 90 °С. Полученная таким образом α-амилаза оставалась активной при температурах, при которых осуществляют промышленное производство этилового спирта из крахмала. Для получения белков с заранее заданными свойствами можно использовать также мутантные формы генов. Однако число мутантных белков, образующихся в результате замены отдельных нуклеотидов в структурном гене с помощью обычного мутагенеза, чрезвычайно велико. Мутагенез с последующим отбором редко приводит к существенному улучшению свойств исходного белка, поскольку большинство аминокислотных замен сопровождается снижением активности фермента.
Для создания белков со специфическими свойствами можно использовать другой подход, основанный на внесении изменений в кодирующие их клонированные гены. Это позволяет получать белки с другими, чем у их аналогов, свойствами.
• Изменив константу Михаэлиса (KМ), которая характеризует прочность связывания субстрата с ферментом, и максимальную скорость (Vmax) превращения субстрата в продукт при определенных условиях, можно повысить общую каталитическую эффективность (Vmax./KM) реакции; Vmax равна полному количеству фермента (Е0 ), умноженную на каталическую константу (kcat).
•Повысив стабильность белка в широком диапазоне температур или pH, можно использовать его в условиях, при которых исходный белок инактивируется.
•Создав белки, способные функционировать в безводных растворителях, можно осуществлять каталитические реакции в нефизиологических условиях.
•Изменив белок таким образом, чтобы он мог работать без кофактора, можно использовать его в некоторых непрерывных промышленных процессах.
•Изменив активный центр фермента, можно повысить его специфичность и уменьшить число нежелательных побочных реакций,
•Повысив устойчивость белка к клеточным протеазам, можно упростить процедуру его очистки и повысить выход продукта.
•Изменив аллостерическую регуляцию фермента, можно уменьшить степень его ингибирования метаболитом по типу отрицательной обратной связи и увеличить выход продукта.
Направленный мутагенез и генная инженерия белков |
159 |
Направленный мутагенез: методика
Получить новый белок с заранее заданными свойствами — непростая задача, но вполне реально изменить свойства уже существующего белка. Изменения можно вносить в сам белок или в его ген. Однако химическая модификация белков редко бывает строго специфичной и ее необходимо осуществлять заново для каждого белкового препарата, поэтому лучше вносить изменения в его клонированный ген. К сожалению, не всегда бывает известно, какую именно аминокислоту или последовательность аминокислот нужно изменить, чтобы получить белок с нужными физическими, кинетическими или химическими свойствами. Может случиться, что изменения должны затрагивать два или более аминокислотных остатка, расположенных далеко друг от друга в полипептидной цепи, но сближающихся в результате укладки белковой молекулы. Есть надежда, что уже в недалеком будущем с помощью компьютеров удастся предсказывать свойства того или иного белка, исходя из данных о его аминокислотной последовательности. Это значительно упростит процедуру создания нужных белков. Введение новой генетической информации в клонированные гены сейчас не составляет особого труда, однако чтобы определить, обладает ли искомый белок нужными свойствами, необходимо проанализировать множество белковых продуктов.
Внесение специфических изменений в коди-руюшие последовательности ДНК, приводящих к определенным изменениям в аминокислотных последовательностях, называется направленным мутагенезом. Идентификация аминокислот, замена которых даст желаемый результат, облегчается, если детально известна пространственная структура белка (ее устанавливают с помощью рентгеноструктурного анализа или других аналитических методов). Однако для большинства белков такие данные отсутствуют, поэтому направленный мутагенез — это в значительной мере эмпирическая процедура, основанная на методе проб и ошибок. Каждый белок, кодируемый мутантным геном, нужно протестировать и убедиться в том, что мутация дала желаемый эффект.
Для направленного мутагенеза клонированных генов используют разные экспериментальные подходы, В одних случаях вносят изменения в специфические сайты клонированного гена, в других случайным образом изменяют короткий фрагмент клонированного гена и среди образующихся мутантных белков выбирают один, обладающий необходимой активностью.
Олигонуклеотид-направленный мутагенез с использованием ДНК фага
M13
Олигонуклеотид-направленный (сайт-специфический) мутагенез — это один из наиболее простых методов внесения точковых мутаций в клонированный ген (рис. 8.1). Для его осуществления необходимо знать: 1) точную нуклеотидную последовательность той области ДНК, которая соответствует мРНК-кодону, подлежащему изменению; 2) характер аминокислотных замен. Обычно встраивают ген-мишень в двухцепочечную форму вектора на основе бактериофага M13. Сначала выделяют одноцепочечную форму вектора (плюсцепь M13) и смешивают ее с синтетическим олигонуклеотидом, в точности комплементарным — за исключением одного нуклеотида -- нужному сегменту клонированного гена. Этот отличающийся (т. е. неспаривающийся) нуклеотид соответствует тому нуклеотиду кодона мРНК, который необходимо изменить. В случае, представленном на рис. 8.1, триплет АТТ, соответствующий изолейциновому кодону AUU, нужно заменить на триплет СТТ, соответствующий лейциновому кодону CUU. Олигонуклеотид будет гибридизоваться с комплементарным участком клонированного гена в том случае, если: 1) он добавлен в количестве, во много раз превышающем количество ДНК М13; 2) неспаривающийся нуклеотид находится примерно посередине олигонуклеотида; 3) отжиг проводят при низкой температуре и высокой ионной силе. 3'-конец спарившегося олигонуклеотида служит затравкой для инициации синтеза ДНК, а интактная цепь ДНК M13
— матрицей. Репликация осуществляется с помощью фрагмента Кленова ДНК-полимеразы I Escherichia coli при наличии в среде четырех дезоксирибонуклеозидтрифосфатов« а присоединение последнего нуклеотида синтезированной цепи к 5'-концу затравки обеспечивает ДНК-лигаза фага Т4. Однако in vitro синтез ДНК редко идет до конца, и частично двухцепочечные молекулы приходится отделять от нормальных центрифугированием в градиенте сахарозы.
Полностью двухцепочечными молекулами ДНКфага М13, содержащими, однако, некомплементарные нуклеотиды, трансформируют клетки Е. coll. В последних образуются фаговые

160 |
ГЛАВА 8 |
Рис. 8.1. Олигонуклеотиднаправленный мутагенез. Одноцепочечную ДНК фага М13 (плюс-цепь), несущую ген-мишень, отжигают с комплементарным синтетическим олигонуклеотидом, содержащим одно основание, не комплементарное соответствующему основанию исходной ДНК, Олигонуклеотид служит затравкой для синтеза ДНК, а М13вектор с встроенным геном — матрицей. Репликацию катализирует фрагмент Кленова ДНКполимеразы E E. coli. Синтезированную полноразмерную цепь замыкает в кольцо ДНКлигаза Т4. Образовавшимися двух цепочечными молекулами
трансформируют E. coli. Часть фаговых частиц содержит ДНК дикого типа, часть — мутантную ДНК.
частицы, что в конечном счете приводит к лизису клеток и образованию бляшек. Поскольку репликация идет по полуконсервативному механизму, половина популяции образующихся фаговых частиц должна содержать ДНК дикого типа, а половина — мутантную ДНК со специфической нуклеотидной заменой. Частицы, содержащие только мутантный ген, идентифицируют при помощи ДНК-гибридизации в жестких условиях, используя в качестве зонда исходный олигонуклеотид. Мутантный ген вырезают и встраивают в какой-либо экспрессирующий Е. соli-вектор. Мутантный белок синтезируют в E. coli и очищают.
На самом деле число фаговых частиц, несущих мутантную ДНК, оказывается гораздо меньше ожидаемых 50%: лишь 1—5% бляшек содержат фаг с мутантным геном. Чтобы повысить выход мутантного фага, метод олигонуклеотиднаправленного мутагенеза модифицировали. Один из подходов состоял во введении М13-вектора, несущего ген, в который необходимо внести мутацию, в штамм E. coli, дефектный по двум ферментам метаболизма ДНК (рис. 8,2). Один фермент — это мутантная форма dUTP-пирофосфатазы (dut). Клетки с неактивной dUTP-пирофосфатазой характеризуются повышенным содержанием dUTP, что приводит к
