
Molekulyarnaya_biotekhnologia_Glik_B__Pasternak_Dzh
.pdf
Микробиологическое производство лекарственных средств |
221 |
Рис. 10.14. Создание комбинаторной библиотеки кДНК Fvфрагментов антител с помощью нитевидного бактериофага М13. кДНК
VL- и VH-областей амплифицировали
методом ПЦР, а затем лигировали. используя ДНК короткого линкерного пептида. Полученные фрагменты ДНК, составляющие комбинаторную библиотеку кДНК одноцепочечных антител, встроили в геном фага М13 с присоединением их к фаговому гену 3, который кодирует поверхностный фаговый белок. В М13 с гена 3 синтезируется три белковых молекулы, поэтому каждый рекомбинантный фаг M 13, содержащий комбинаторную библиотеку кДНК одноцепочечных антител, будет нести три молекулы химерного белка, состоящего из продуктa гена 3 и одно цепочечного антитела.
Был проведен также еще один эксперимент: вместо того чтобы соединять VL- и Vн-цепи коротким пептидом, аминокислоты каркасной области модифицировали таким образом, чтобы между ними образовывался дисульфидный мостик. Эффективность такой стабилизированной дисульфидной связью FV-молекулы, связанной с токсином, разрушающим раковые клетки, сравнили с эффективностью одноцепочечной Fv-молекулы, связанной с тем же токсином (рис. 10.15). Обнаружилось, что стабилизированный дисульфидной связью и одноцепочечный Fv-иммунотоксины обладают одинаковой активностью и специфичностью, но первый в несколько раз стабильнее. Можно предположить, что в каких-то ситуациях стабилизированные Fv-молекулы могут оказаться предпочтительнее одноцепочечных Fv-молекул.
Рис. 10.15. Схематическое изображение одноцепочечного Fv-иммунотоксина (А) и Fvиммунотоксина, стабилизированного дисульфидной связью (Б).

222 |
ГЛАВА 10 |
Лекарственные средства против ВИЧ
Ученым пока не удалось получить вакцину, достаточно эффективную против вируса иммунодефицита человека (ВИЧ), который вызывает развитие синдрома приобретенного иммунодефицита (СПИД). Параллельно с созданием такой вакцины идет поиск других средств, позволяющих замедлить патологический процесс.
ВИЧ поражает один из видов лимфоцитов, а именно Т-хелперы (Тн-клетки). В норме в процессе развития иммунного ответа Тн-клетки связывают продукты деградации специфических антигенов и высвобождают факторы, стимулирующие другие клетки иммунной системы к участию в иммунном ответе. Тн-клетки играют в этом процессе ключевую роль, а при ВИЧ-инфекции они перестают функционировать. Как только вирус внедряется в Тн-клетку, он становится защищенным от иммунной системы организма и начинает оказывать свое разрушающее действие на Тн-клетки.
• В результате размножения вируса в инфицированной клетке происходит ее лизис.
• Пораженная клетка действует как фабрика по производству ВИЧ-гликопротеина (gpl20), который вызывает разрушение Тн-клеток и других Т-лимфоцитов.
• Пораженная клетка сливается с другими Тн-клетками, формируя синцитий, который не способен выполнять функции, свойственные индивидуальным Тн-клеткам.
Основным следствием ВИЧ инфекции явля ется неспособность иммунной системы организма обеспечивать его защиту от обычных бактериальных и вирусных инфекций, которые в конце концов приводят к гибели больного, несмотря на лечение антибиотиками и другими средствами.
На первом этапе ВИЧ-инфекции происходит взаимодействие между гликопротеином оболочки вируса мол. массой 120 кДа (gpl20) и рецептором на поверхности Тн-клеток — CD4 (рис. 10.l6, A). In vitro поражение TH-клеток блокируется антителами к СЕМ; процесс замедляется также при избытке свободного белка CD4. Однако ни один из этих способов не приводит к
Рис. 10.16. ВИЧ-инфекция и ее терапия, А. Связывание ВИЧ с Тн-клеткой опосредуется контактированием вирусного белка gp120 с Тн-
клеточным поверхностным |
белком CD4. Б. |
||
На поверхности ВИЧ-инфицированной |
клетки |
||
находится |
белок gp120, |
с которым |
может |
связываться свободный химерный комплекс С D4— токсин. Попав внутрь инфицированной клетки, токсиновая часть химерной молекулы убивает ее.
уничтожению вируса. Один из подходов, обеспечивающих как защиту Тн-клеток, так и инактивацию вируса, заключается в создании химерного белка, состоящего из фрагмента молекулы CD4 и Fc-фрагмента иммуноглобулина. Свойства этого белка, называемого СВ4- иммуноад-гезином, определяются составными частями его молекулы: СD4-компонент связывает gp120 и блокирует ВИЧ, а иммуноглобулиновый обеспечивает замедление разрушения молекулы в плазме и ее связывание с клетками, несущими
Микробиологическое производство лекарственных средств |
223 |
рецептор к антителу. После присоединения СD4-иммуноадгезина к свободной вирусной частице или к инфицированной клетке запускается реакция опосредованной антителами клеточной цитотоксичности, которая обеспечивает уничтожение вируса или пораженной им клетки.
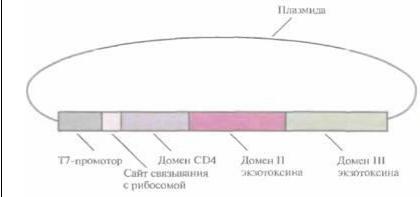
Другой подход, позволяющий контролировать развитие ВИЧ-инфекции, заключается в создании системы мечения ВИЧ-пораженных клеток для их специфического уничтожения. Например, если сшить два фрагмента ДНК, один из которых кодирует рецептор CD4, а другой — внутриклеточный токсин Pseitdomonas (экзотоксин А), то мы получим ген, кодирующий химерный белок с комбинированными свойствами (рис. 10.17). Экзотоксин A Pseudomonas -это белок с мол. массой 66 кДа, состоящий из трех доменов: домен I отвечает за связывание с клеткой, II — за проникновение белка в клетку, III — за присоединение ADP-рибозы к эукарио-тическому фактору элонгации (EF-2), что приводит к его инактивации. Химерный белок CD4—экзотоксин A Pseudomonas вместо домена I содержит большую часть последовательности CD4 (рис. 10.17), в результате чего обладает и цитотоксической активностью экзотоксина Pseudomonas, и gp120-связывающей активностью CD4. На поверхности всех ВИЧ-поражен-ных клеток находится гликопротеин gp120, поэтому СD4-домен химерного белка соединяется исключительно с этими клетками. Присоединившись к инфицированной клетке, химерный белок проникает внутрь нее при участии домена II экзотоксина A Pseudomonas. Затем экзотоксиновая часть химерного белка инактивирует фактор элонгации EF-2, участвующий в синтезе белка. Это препятствует дальнейшему синтезу белка, что в конце концов приводит к гибели клетки. Таким образом, CD4-домен «помечает» ВИЧ-пораженные клетки, а экзотоксин выступает в роли «наемного убийцы».
Синтезируясь в Е. coli, химерный белок образует нерастворимые цитоплазматические включения. Их растворяют в гуанидингидрохлориде и выделяют с помощью быстрого разведения и анион-обменной хроматографии. Полученный таким образом белок с успехом выдержал проверку в контрольной культуре клеток. Однако в организме человека на Рsеиdотопаs-компонент химерного белка может возникнуть иммунная реакция, и не исключено, что его придется вводить вместе с каким-либо иммуносупрессантом, например циклоспорином. Нужно иметь в виду, что описанный выше способ борьбы с ВИЧинфекцией находится на начальной стадии разработки, хотя в будущем и может оказаться весьма эффективным.
Подобные иммунопрепараты обладают достаточно высокой эффективностью, что позволяет применять их в низких дозах и свести к минимуму побочное действие на иммунную систему. Кроме того, они могут оказаться полезными для лечения различных новообразований, а иногда и заменять химиотерапию. На пораженные клетки можно «нацелить" и другие цитотоксичные белки, например дифтерийный токсин или растительный токсин рицин. Впрочем, даже при
Рис. 10.17. Генетически сконструированный
химерным комплекс СD4—
экзотоксин A Pseudomonas.
Использован промотор бактериофага Т7 E. coli.
224 |
ГЛАВА 10 |
оптимальном развитии событий пройдет еще несколько лет, прежде чем терапевтическое применение рекомбинантных экзотоксинов станет рутинным.
ЗАКЛЮЧЕНИЕ
Спомощью клонирования специфических генов и последующей их экспрессии в бактериях получен целый ряд белков, которые можно будет использовать в качестве лекарственных препаратов. Большинство этих белков имеют эукариотическое происхождение, так что для выделения нужного гена сначала получают препарат мРНК, обогащенный интересующими исследователя фракциями, затем создают кДНКбиблиотеку и встраивают соответствующую ДНК в подходящий вектор для экспрессии. Произведя обмен участков родственных генов, кодирующих аналогичные белковые домены, или прямо заменяя сегменты клонированного гена, кодирующие функциональные части белка, можно создавать новые модификации таких белков. В качестве лекарственных средств можно использовать и некоторые ферменты. Например, для снижения вязкости слизи, которая накапливается в легких больных муковисцидозом, применяют в виде аэрозоля рекомбинантную ДНКазу I и альгинатлиазу.
Сразвитием технологии рекомбинантных ДНК и разработкой способов получения моноклональных антител, а также с установлением структуры и функций иммуноглобулинов появился интерес к использованию специфических антител для лечения различных заболеваний. Работа с генами антител облегчается тем, что отдельные домены молекулы антитела выполняют разные функции.
Лекарственные вещества или ферменты можно присоединять к моноклональным антителам или их Fv-фрагментам, специфичным в отношении поверхностных белков определенных клеток, например опухолевых. При этом лекарственное вещество может находиться в инертной форме. Если предполагаются многократные введения таких комплексов, то их иммуноглобулиновый компонент должен представлять собой антитело или фрагмент антитела человека; это позволяет предотвратить развитие перекрестной иммунной реакции и сенсибилизацию больного. Если же предполагается использовать в этих целях моноклональные антитела грызунов, их структуру следует максимально приблизить к структуре антител человека. Для этого в последних достаточно заменить CDR-участки на аналогичные фрагменты антител грызунов. Недавно удалось провести отбор и синтез моноклональных антител человека с помощью
Е. colt.
Генноинженерные методы позволяют получать уникальные лекарственные средства, которые представляют собой комплекс белка, связывающегося со специфическими клетками, например ВИЧ-инфицированными, и токсина. Этот подход пока только разрабатывается, но его перспективы обнадеживают.
ЛИТЕРАТУРА
Barbas C.F., III, D. R. Burton. 1996. Selection and evolution of high-affinity human anti-viral antibodies. Trends Biotechno\. 14: 230-234.
Bird R. E., B. W. Walker. 1991. Single chain antibody variable regions. Trends Btotechnol. 9: 132-137.
Brinkmann U., L. H. Pai, D. J. FitzCerald, M. Wülingham, 1. Pastan. 1991. B3<Fv)- PE38KDEL, a single-chain immunotoxin that causes complete regression of a human carcinoma in mice, Proc. Natl. Acad, Sei. f/&488: 8616-8620.
Brüggemann M., H. M. Caskey, С. Teale, II. Waldmann, G. T. Williams, M. A. Surani, M. S. Mcubcrgcr. 1989. A repertoire of monoclonal antibodies with human heavy chains from transgenic mice. Proc. Nail. Acad. Sei. USA 86: 6709-6713.
Bryn R. A., J. Mordenti, C. Lucas, D. Smith, S. A. Marslers, J. S. Johnson, P. Cossum, S. M. Chamow, F. M. Wurm, T. Gregory, J. E. Gronpman, D. J. Capon. 1990. Biological properties of a CD4 immunoadhesin. Nature 344: 667-670.
Buchner J., R. Rudolph. 1991. Renaturation, purification and characterization of recombinant Fab-fragmnnls produced in E. coli. Bio/Technology 9: 157-162.
Микробиологическое производство лекарственных средств |
225 |
Burton D. R. 1991Human and mouse monoclonal antibodies by repertoire cloning. Trends Biotechnol. 9: 169-175.
Capon D. J., S. M. Chamow, J. Mordent!, S. A. Marsters, T. Gregory, H, Mitsuya, R. A, Bym,
С Lucas, F. M. Wurm, J. E. Groopraan, S. Broder, D. H. Smith. 1989. Designing CD4 immunoadhesins for AIDS therapy. Nature 337: 525-530.
Chamow S. M., A. Ashkenazi. 1996. Immunoadhesins: principles and applications. Trends Biotechnol. 14: 52-60.
Chaudhary V, K., T. Mizukami, T. R. Fuerst, D. J. FitzGerald, B. Moss, L Pastan, Έ, A. Berger, 1988. Selective killing of HlV-infected cells by recombinant human CD4-Pseudomonas exotoxin hybrid protein. Nature 335: 369-372.
Chester K. A-, R. E. Hawkins. 1995. Clinical issues in antibody design. Trends Biotechnol. 13: 294—300.
Chiswell D. J., J. McCafferty. 1992. Phage antibodies: will new 'coliclonal' antibodies replace monoclonal antibodies? Trends ßiotechnol. 10: 80-84.
Collet T. A., P. Roben, R. О Kennedy, C. F. Barbas III, D. R. Burton, R. A. Lerner. 1992. A binary plasmid system for shuffling combinatorial antibody libraries. Proc. Natl. Acad. Sei. USA 89: 10026-10030.
Cunningham B. C., J. A. Wells. 1991. Rational design of receptor-specific variants of human growth hormone. Pn>c. Natl. Acad. Set. USA 88: 3407-3411.
Davis G. T., W. D. Bedzyk, E. W. Voss, T. W. Jacobs. 1991. Single chain antibody (SCA) encoding genes: one-step construction and expression in eukaryotic cells, Bio/Technology 9:165-169.
Dewerchin M., D. Collen. 1991. Enhancement of the thrombolytic potency of plasminogen activators by conjugation with clot-specific monoclonal antobodics. Bioconjugaie Chem. 2: 293—300.
Gram H., L. A. Marconi, C. F. Barbas ΙΠ, T. A. Collet, R. A. Lerner, A. S. Kang. 1992. In vitro selection and affinity maturation of antibodies from a naive combinatorial immunoglobulin library.
Proc. Natl. Acad. Sei. Î/&489: 3576-3580.
Harris W. J. 1994. Humanizing monoclonal antibodies for in vivo use. Animal Cell Biotechnol. 6: 259-279.
Hodgson ,1. 1991, Making monoclonals in microbes. Bio/Technology 9:421^125.
Huennekens F. M. 1994. Tumor targeting: activation of prodrugs by enzymemonoclonal antibody con-jugates. Trends Biotechnol. 12: 234-239.
Huse W. D., L. Sastry, S. A. Iverson, A. S. Kang, M. Alting-Mees, D. R. Burton, S. J. Benkovfc, R. A. Lerner. 1989. Generation of a large combinatorial library of the immunoglobulin repertoire in phage lambda. Science 246: 1275-1281.
Johnson I. S. 1983, Human insulin from recombinant DNA technology. Science 219: 632-637.
Little M., F. Breitling, S. Dübel, P. Fuchs, M. ßramiage). 1995. Human antibody libraries in
Escherichia coli. J. Biotechnol. 41: 187-195.
LoBuglio A. G., R. H. Wheeler, J. Trang, A. Haynes, K. Rogers, E. B. Harvey, L. Sun, J. Ghraycb, M. B. Khazaeli. 1989. Mouse/human chimeric monoclonal antibody in man: kinetics and immune response, Proc. Natl. Acad. Sei. USA 86: 4220-4224.
Marks J. D., A. D. Griffiths, M. Malmqvist, T. P. Oackson, J. M. Bye, G. Winter. 19У2. Bypassing immunization: building high affinity antibodies by chain shuffling. Bio/Technology 10: 779783.
Meyer F., A. Hinnen, A. Meister, M. G. Grutier, S. Alkan. December 1989. Hybrid inlerlcrons. U.S. patent 4, 885,166.
Mullinax R. L., Ε. Λ. Gross, J. R. Amberg, B. N. Hay, H. H. Hogrefe, M. M. Kubitz, A. Greener, M. Alting-Mees, D. Ardourel, J. M. Short, J. A. Sorge, B. Shopes. 1990. identification of human antibody fragment clones specific for tetanus toxoid in a bacteriophage λ immunoex-pression library. Proc. Natl. Acad. Sei. USA 87: 8095-8099.
Murata K., T. Inose, T. Hisano, S. Abe, Y. Yonemnto, T. Yaniashita, M. Takagi, K. Sakaguchi, A. Kimura, T. Imanaka. 1993. Bacterial alginate lyase: enzymology, genetics and appb'cation. /.
Ferment. Bioeng. 76:427-437,
Nagata S., H. Taira, A. Hall, L. Johnsrucl, M. Streu«, J. Escodi, W. Boll, K. CanteU, C. Weismann. 1980. Synthesis in E. coli of a polypeptide with human leukocyte interferon activity. Nature 284: 316-320.
Pastan I., D. FitzGerald. 1991. Recombinant toxins for cancer treatment. Science 254: 1173-1177. Pluckthun A. 1991. Antibody engineering: advances from the use of E. coli expression systems,
Bio/Technology 9; 545-551.
226 ГЛАВА 10
Primrose S. B. 1986. The application of genetically engineered microorganisms in the production of drugs. / Appl. Bacterial. 61:99-116.
Queen C., W. P. Schneider, H. E. Selfck, P. W. Payne, N. F. Landolf, J. F. Duncan, N. M.
Avdalovlc, IVL Levitt, R. P. Junghans, T. A. WaWmanih 1989. A humanized antibody that binds to the inter-leukin 2 receptor. Proc. Nail. Acad. Sa. USA 86: 10029-10033.
Reiter Y., U. Brinkmann, К. О. Webber, S.-H. Jung, I. Pastan. 1994. Engineering interchain disulftde bonds into conserved framework regions of Fv fragments: improved biochemical characteristics of recombinant immunotoxins containing disul-fide-stabilized Fv.
Protein Eng. 7:697-704.
Riechmann L., M. Clark, H. Waldmann, and G. Winter. 1988. Reshaping human antibodies for therapy. Nature 332: 323-327.
Taniguchi T.t Y. Fiyii-Kuriyama, M. Muramatsu. 1980, Molecular cloning of human Interferon cDNA. Proc. Nat!. Acad. Sei. USA 77:4003-4006.
van Leen R. W., J. G. Bakhuis, R. F. W. С. van Bedthorcn, H. Burger, L· С J. Dorssers, R. W. J. Hommes, P. J. Lemson, B. Noordam, N. L. M. Persoon, G. Wagemaker, 1991. Production of human inter-leukin-3 using industrial microorganisms. Bio/Technology 9: 47-52.
Vaughan T. J., A. J. Williams, K. Pritchard, J. K. Osbourn, A. R. Pope, J. C. Earnshaw, J. M<Caffertv, R. A. Hodits, J. WiKon, K S. Johnson. 19%. Human antibodies with sub-nanomolar affinities isolated from a large non-immunized phage display library, Nat. Biotechnol. 14: 309-314.
Waldmann T. A, 1991, Monoclonal antibodies in diagnosis and therapy. Scietice252i 1657— 1662.
Winter G., C. Milstein. 1991. Man-made antibodies, Nature 349: 293-299.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Вам нужно клонировать и экспрессировать фрагмент ДНК, кодирующий интерферон человека, У вас нет нужного ДНК-зонда для гибридизации, но вам удалось выделить линию клеток человека, в которых можно индуцировать синтез интерферона с интенсивностью, превышающей фоновую примерно в 100 раз. Какую стратегию клонирования и экспрессии этой ДНК вы выберете?
2. |
Что такое Fc-фрагмент молекулы антитела? Fab-фрагмент? Fv-фрагмент? CDR- |
участок? |
|
3. |
Как осуществляется координированный синтез легкой и тяжелой цепей антитела в |
Е. соli |
|
4.Какова роль ДНКазы I и альгинатлиазы при лечении муковисцидоза?
5.Как зарегистрировать синтез альгинатлиазы, кодируемой клонированным геном, в трансформированных клетках Е. coif?
6. Что такое комбинаторная библиотека кДНК?
7.Как с помощью бактериофага М13 можно отбирать Fv-фрагменты, связывающиеся со специфическими антигенами-мишенями?
8.Что такое стабилизированная дисульфидными связями и одноцепочечная Fvмолекулы?
9.Как, присоединяя ферменты к моноклональным антителам или их Fv-фрагментам, можно получать лекарственные средства?
10.Как получить моноклональные мышиные антитела, максимально близкие по структуре к антителам человека? Почему они необходимы?
11. Опишите способ получения терапевтического средства, которое «помечает» и уничтожает специфические клетки.
ГЛАВА 11. Вакцины
Вакцинация способствует формированию у реципиента иммунитета к патогенным микроорганизмам и тем самым защищает его от инфекции. В ответ на пероральное или парентеральное введение вакцины в организме хозяина вырабатываются антитела к патогенному микроорганизму, которые при последующей инфекции приводят к его инактивации (нейтрализации или гибели), блокируют его пролиферацию и не позволяют развиться заболеванию.
Эффект вакцинации открыл более 200 лет назад — в 1796 г. — врач Эдвард Дженнер. Он доказал экспериментально, что человек, перенесший коровью оспу, не очень тяжелую болезнь крупного рогатого скота, становится невосприимчивым к оспе натуральной. Натуральная оспа — высококонтагиозное заболевание с высокой смертностью; даже если больной не погибает, у него нередко возникают различные уродства, психические расстройства и слепота. Дженнер публично провел прививку коровьей оспы 8-летнему мальчику Джеймсу Фиппсу, использовав для этого экссудат из пустулы больной коровьей оспой, а затем через определенное время дважды инфицировал ребенка гноем из пустулы больного натуральной оспой. Все проявления заболевания ограничились покраснением в месте прививки, исчезнувшим через несколько дней.
Ранее такие инфекционные болезни, как туберкулез, оспа, холера, брюшной тиф, бубонная чума и полиомиелит, были настоящим бичом для человечества. С появлением вакцин, антибиотиков и внедрением мер профилактики эти эпидемические болезни удалось взять под контроль. Однако защитные меры со временем становились неэффективными, и возникали новые вспышки заболеваний. В 1991 г. эпидемия холеры поразила Перу; в течение трех следующих лет было выявлено примерно 1 млн. заболевших, несколько тысяч из них умерли. К сожалению, против многих болезней человека и животных вакцин не существует. Сегодня во всем мире более 2 млрд, людей страдают заболеваниями, которые можно было бы предотвратить с помощью вакцинации. Вакцины могут оказаться полезными и для профилактики постоянно появляющихся «новых» болезней (например, СПИДа).
Как правило, современные вакцины создают на основе убитых (инактивированных) патогенных микроорганизмов либо живых, но невирулентных (аттенуированных) штаммов. Для этого штамм дикого типа выращивают в культуре, очищают, а затем инактивируют или модифицируют таким образом, чтобы он вызывал иммунный ответ, достаточно эффективный в отношении вирулентного штамма. Несмотря на значительные успехи в создании вакцин против таких заболеваний, как краснуха, дифтерия, коклюш, столбняк, оспа и полиомиелит, производство современных вакцин сталкивается с целым рядом ограничений.
•Не все патогенные микроорганизмы удается культивировать, поэтому для многих заболеваний вакцины не созданы.
•Для получения вирусов животных и человека необходима дорогостоящая культура животных клеток.
•Титр вирусов животных и человека в культуре н скорость их размножения часто бывают очень низкими, что удорожает производство вакцин.
228 |
ГЛАВА 11 |
•Необходимо строго соблюдать меры предосторожности, чтобы не допустить инфицирования персонала.
•При нарушении производственного процесса в некоторые партии вакцины могут попасть живые или недостаточно ослабленные вирулентные микроорганизмы, что может привести к неумышленному распространению инфекции.
•Аттенуированные штаммы могут ревертировать к исходному штамму, поэтому необходимо постоянно контролировать вирулентность.
•Некоторые заболевания (например, СПИД) нельзя предупреждать с помошью традиционных вакцин.
•Большинство современных вакцин имеют ограниченный срок годности и сохраняют активность только при пониженной температуре, что затрудняет их использование в развивающихся странах.
В последнее десятилетие, с развитием технологии рекомбинантных ДНК, появилась возможность создать новое поколение вакцин, не обладающих недостатками традиционных вакцин. Для их разработки применяют методы генной инженерии.
•Патогенный микроорганизм модифицируют, делегируя гены, ответственные за вирулентность. Способность вызывать иммунный ответ при этом сохраняется. Такой микроорганизм можно безбоязненно использовать в качестве живой вакцины, поскольку выращивание в чистой культуре исключает возможность спонтанного восстановления целого гена,
•Создают живые непатогенные системы переноса отдельных антигенных детерминант неродственного патогенного организма. Такая система переноса способствует развитию выраженного иммунного ответа на патогенный микроорганизм.
•Если патогенные микроорганизмы не растут в культуре, можно изолировать, клонировать и экспрессироватъ в альтернативном хозяине (например, в E, coli или линии клеток млекопитающих) гены тех белков, которые содержат основные антигенные детерминанты, и
использовать эти белки как «субъединичные", вакцины (см, следующий раздел). • Некоторые патогенные микроорганизмы действуют опосредованно, вызывая развитие аутоиммунной реакции на инфицированные клетки организма-хозяина. Для таких заболеваний можно создать систему специфического уничтожения клеток-мишеней, сконструировав ген, кодирующий химерный белок, одна часть которого будет связываться с инфицированной клеткой, а другая — уничтожать ее. Эта система не является истинной вакциной, хотя она и действует только на инфицированные клетки, устраняя саму причину развития аутоиммунной реакции.
К вакцинам для животных предъявляются менее жесткие требования, поэтому первыми вакцинами, полученными с помощью технологии рекомбинантных ДНК, были вакцины против ящура, бешенства, дизентерии и диареи поросят. Создаются и другие вакцины для животных, а в скором времени появятся и рекомбинантные вакцины, предназначенные для человека (табл. 11.1).
Субъединичные вакцины
Как правило, вакцины содержат неповрежденные патогенные микроорганизмы, но при этом неживые или аттенуированные. Антитела, вырабатываемые в ответ на их введение, связываются с поверхностными белками патогенного организма и запускают иммунный ответ. Б связи с этим возникает вопрос: должна ли вакцина содержать целые клетки или лишь какие-то специфические поверхностные компоненты? Что касается вирусов, то, как было показано, для выработки в организме-хозяине антител в ответ на вирусную инфекцию достаточно очищенных поверхностных белков вируса (белков капсида или внешней оболочки) (рис. 11.1). Вакцины, содержащие лишь отдельные компоненты патогенного микроорганизма, называют «субъединичными»; для их разработки с успехом используется технология рекомбинантных ДНК.
Субъединичные вакцины имеют свои достоинства и недостатки. Достоинства состоят в том, что препарат, содержащий очищенный иммуно-

Вакцины 229
Таблица 11.1. Патогенные микроорганизмы, против которых в настоящее время разрабатываются вакцины
Микроорганизм |
Заболевание |
|
|
Вирусы |
|
Вирус ветряной оспы— опоясывающего |
Ветряная оспа |
лишая |
|
Цитомегаловирус |
Постнатальные инфекции и снижение иммунного статуса |
Вирус Денге |
Геморрагическая лихорадка |
Вирус гепатита А |
Высокая температура, поражение печени |
Вирус гепатита В |
Хроническое поражение печени |
Вирус простого герпеса типа 2 |
Язвы гениталий |
Вирусы гриппа А и В |
Острые респираторные заболевания |
Вирус японского энцефалита В |
Энцефалит |
Вирус парагриппа |
Воспаление верхних дыхательных путей |
Вирус бешенства |
Энцефалит |
Респираторно-синцитиальный вирус |
Поражение верхних и нижних дыхательных путей |
Ротавирус |
Острый гастроэнтерит новорожденных |
Вирус желтой лихорадки |
Поражение сердца, почек и печени |
Вирус иммунодефицита человека |
СПИД |
Бактерии |
|
Vibrio cholerae |
Холера |
Энтеротоксичные штаммы Е, coli |
Диспепсия |
Neisseria gonorrhoeae |
Гонорея |
Haemophilus influenzae |
Менингит, сепсис |
Mycobacterium leprae |
Проказа |
Neisseria meningitidis |
Менингит |
Bordetella pertussis |
Коклюш |
Штаммы Shigella |
Дизентерия |
Streptococcus группы А |
Скарлатина, ревматическая атака, ангина |
Streptococcus группы В |
Сепсис, урогенитальная инфекция |
Streptococcus рпеитопiaе |
Пневмония, менингит |
Clostridiutn tetani |
Столбняк |
Mycobacterium tuberculosis |
Туберкулез |
Salmonella typhi |
Брюшной тиф |
Паразиты |
|
Onchocerca volvulus |
«Речная слепота» |
Leishmania spp. |
Поражения кожи и внутренних органов |
Ptasmodium spp. |
Малярия |
Schistosoma mansoni |
Шистосомоз |
Trypanosoma spp. |
Сонная болезнь (американский трипаносомоз) |
Wuchereria bancrofti |
Филяриатоз |
генный белок, стабилен и безопасен, его химические свойства известны, в нем отсутствуют дополнительные белки и нуклеиновые кислоты, которые могли бы вызывать нежелательные побочные эффекты в организме-хозяине. Недостатки заключаются в том, что очистка специфического белка стоит дорого, а конформация выделенного белка может отличаться от той, которую он имеет in situ (т. е. в составе вирусного капсида или оболочки), что может приводить к изменению его антигенных свойств. Решение о производстве субъединичной вакцины принимается с учетом всех имеющих отношение к делу биологических и экономических факторов.

230 |
ГЛАВА 11 |
Рис. 11.1. Строение вируса животных. Геном вируса обычно представлен относительно небольшой молекулой нуклеиновой кислоты (одноили двухцепочечной ДНК или РНК длиной от 3 до 200 т. п. н.), заключенной в белковый капсид. У некоторых вирусов капсид окружен еще и белковой оболочкой.
Противогерпетические вакцины
Вирус простого герпеса (HSV, herpes simplex virus) вызывает инфекционные заболевания генерализованного или местного характера (тяжелые поражения глаз, энцефалит, урогенитальные инфекции и т. д.). Кроме того, он является онкогенным, поэтому вакцинация убитым или аттенуированным вирусом сопряжена с определенным риском развития рака. Для защиты от HSV-инфекции можно использовать неонко-генную субъединичную вакцину.
Для создания любой субъединичной вакцины прежде всего нужно идентифицировать те компоненты патогенного микроорганизма, которые индуцируют выработку антител. В случае НSV типа l (HSV-1) таким компонентом является гликопротеин D оболочки (gD). В ответ на введение этого гликопротеина мышам у них вырабатываются антитела, нейтрализующие интактный HSV, Ген gD HSV-1 был изолирован, клонирован в одном из экспрессирующих векторов в клетках млекопитающих и введен в яйцеклетки китайского хомячка (СНО), в которых в отличие от E. coli происходит гликолизирование чужеродных белков. Полноразмерный ген gD кодирует белок, в норме связывающийся с мембраной клетки млекопитающего (рис. 11.2, A). Такой белок труднее очистить, чем раствори-
мый, поэтому ген gD модифицировали, удалив ту его часть, которая кодирует С- концевой трансмембранный домен (рис. 11.2, Б), Затем модифицированным геном трансформировали СНО-клетки, которые гликозилировали белковый продукт и секретировали его во внешнюю среду, поскольку он не мог встраиваться в клеточную мембрану. Лабораторные испытания показали, что антитела, вырабатываемые в ответ на введение модифицированного белка gD, эффективны в отношении как HSV-1, так и HSV-2.
Противоящурные вакцины
Вирус ящура (FMDV, foot-and-mouth disease vims) в высшей степени вирулентен и вызывает массовую гибель крупного рогатого скота и свиней. Для защиты от FMDVинфекции используют вакцину, содержащую вирус, инактивированный фор-
Рис. 11. 2. А. Молекула gD HSV-1 с транс мембранным доменом, погруженным в плазматическую мембрану. Б. Растворимый белок gD, не содержащий трансмембранного домена.
