
Molekulyarnaya_biotekhnologia_Glik_B__Pasternak_Dzh
.pdf
Направленный мутагенез и генная инженерия белков |
161 |
встраиванию в ДНК при репликации нескольких остатков dUTP вместо dTTP. Второй фермент – это дефектная урацил-К-гликозилаза (ung). В отсутствие функциональной урацил-М-гликозилазы остатки dUТР, случайно встроившиеся в ДНК, не могут быть удалены. В одноцепочечной ДНК M13, синтезированной в таких клетках Е. соli, примерно 1% тимидиновых остатков оказываются замененными уридиновыми. Олигонуклеотид с некомплементарным основанием отжигают с урацилсодержащей ДНК М13 и in vitro достраивают вторую
Рис. 8.2. Повышение выхода мутантного фага M13 путем трансформации штамма Е. colt dia ung. Ген-мишень встраивают в двух цепочечную репликативную форму ДНК фага MI3 и полученными молекулами трансформируют штамм Е. coli dut ung. Мутация dut вызывает повышение содержания dUTP в клетке, что приводит к включению в ДНК нескольких остатков dUTP (U). а мутация ung блокирует их удаление. Двухцепочечной ДНК М13, содержащей ген-мишень, трансформируют клетки E. coli дикого типа. Продукт гена ung дикого типа (урацил-N- гликозилаза) удаляет все остатки урацила из исходной цепи, и она деградирует. Мутантная цепь остается интактной, поскольку она не содержит остатков урацила. Эта цепь служит матрицей для репликации ДНК, и в результате доля фаговых частиц, несущих мутантный ген, увеличивается.
цепь. Двухцепочечной ДНК трансформируют штамм E. coli, содержащий функциональный ген ung. Активная урацил-N-гликозилаза хозяйских клеток удаляет остатки уридина из ДНК M13 (рис. 8.2), исходная матричная цепь М13 деградирует и далее реплицируется только мутантная цепь, не содержащая dUTP, В результате выход фаговых частиц, несущих мутантный ген, значительно увеличивается.
Олигонуклеотид-направлепный мутагенез с использованием плазмидной ДНК
Основной недостаток одигонуклеотид-направленного мутагенеза с использованием фага М13 — большое число процедур. Чтобы выделить мутантную форму нужного гена, приходится затратить много времени. В качестве альтернативы системе с использованием фага M13 было разработано множество других подходов, основанных на применении плазмидных ДНК. Это позволяет обойтись без переноса интересующего исследователя гена из плазмиды в фаговую ДНК, а после завершения мутагенеза — обратно в плазмиду. Один из этих подходов включает встраивание ДНК в плазмидный вектор, который несет функциональный ген устойчивости к тетрациклину и неактивный ген устойчивости к ампициллину; в середине последнего заменен один нуклеотид (рис. 8.3). Клетки E. coli трансформируют вектором, несущим ДНК-мишень, и двухцепочечную плазмидную ДНК денатурируют щелочью с тем, чтобы получить одноцепочечные кольцевые молекулы. Денатурированную ДНК отжигают с тремя разными олигонуклеоти-

162 |
ГЛАВА 8] |
дами. Один из них предназначен для внесения изменений в клонированную ДНКмишень, второй — для устранения мутации в гене устойчивости к ампициллину, третий — для замены одного нуклеотида в гене устойчивости к тетрациклину с тем, чтобы инактивировать этот ген. В реакционную смесь добавляют четыре дезоксирибонуклеозидтрифосфата и ДНК-полимеразу Т4, функционирующую аналогично фрагменту Кле-нова ДHК-полимеразы I Е. coli. Гибридизовавшиеся олигонуклеотиды служат затравками для синтеза ДНК, а интактная кольцевая молекула
Рис, 8.3. Олигонуклеотиднаправленный мутагенез с использованием плазмидной ДНК. Ген-мишень встраивают в полилинкер вектора pALTER. Плазмидную ДНК денатурируют в щелочи и отжигают с тремя олигонуклеотидами: «мутагенным» олигонуклеотидом, олигонуклеотидом, восстанавливающим устойчивость к ампициллину (Ampr), и олигонуклеотидом, придающим чувствительность к тетрациклину (Tets). Эти олигонуклеотиды служат затравками для синтеза ДНК с помощью ДНК-полимеразы Т4, а исходная цепь — матрицей. Одноцепочечные разрывы в новосинтезированной цепи зашиваются ДНК-лигазой Т4. Продуктами реакции трансформируют клетки E. coli и
отбирают трансформантов Аmрг и
TetS.
Направленный мутагенез и генная инженерия белков |
163 |
ДНК — матрицей. Одноцепочечные разрывы в новосинтезированной цепи зашиваются с помощью ДНК-лигазы Т4. По окончании синтеза и лигирования продуктами реакции трансформируют клетки E. coli. Трансформантов отбирают по признаку устойчивости к ампициллину и чувствительности к тетрациклину. Примерно 90% из них содержат специфическую мутацию в клонированном гене. У остальных трансформантов клонированный ген не был изменен либо потому, что олигонуклеотид не гибридизовался с ним, либо потому, что он вытеснялся в ходе синтеза ДНК. Клетки, несущие мутантный клонированный ген, идентифицируют с помощью гибридизации. Все плазмиды, штаммы, ферменты, олигонуклеотиды (кроме того, который предназначен для изменения клонированного гена), а также буферы продаются в наборе, что облегчает работу.
Олигонуклеотид-направленный мутагенез с использованием ПЦРамплификации
Более простой и быстрый метод получения больших количеств мутантных генов, альтернативный системе с использованием фага М13, -сайт-специфический мутагенез в сочетании с полимеразной цепной реакцией (ПЦР), Один из вариантов этого подхода состоит в следующем. Ген-мишень встраивают в плазмидный вектор (рис. 8.4) и помешают препарат в две пробирки. В каждую из них добавляют по два специфических праймера для ПЦР: 1 и 2 в одну пробирку, 3 и 4 — в другую. Праймеры 2 и 3 полностью комплементарны одному из участков клонированного гена или прилегающей к нему последовательности, а 1 и 3 комплементарны другому участку, но содержат один некомплементарный нуклеотид и гибридизуются с разными цепями, так что в результате происходит замена обоих нуклеотидов данной пары. Положение сайтов гибридизации праймеров l и 2 в одной пробирке и 3 и 4 — в другой таково, что ΠЦР-продукты в разных пробирках имеют разные концы. По окончании ПЦР содержимое пробирок объединяют и проводят денатурацию, а затем ренатура-цию. Поскольку концы амплифицированных молекул ДНК из двух пробирок неодинаковы, одноцепочечные ДНК из разных пробирок ассоциируют с образованием кольцевых молекул с двумя одноцепочечными разрывами. Эти разрывы репарируются in vivo после трансформации E. coli. При ренатурации одиночных цепей из одной пробирки образуются линейные молекулы. В клетках E. coti стабильно поддерживаются в виде плазмид и наследуются только кольцевые, а не линейные молекулы, при этом все они несут сайт-специфическую мутацию. Таким образом, с помощью описанного метода можно вносить точковые мутации в клонированный ген, при этом отпадает необходимость во встраивании гена в ДНК фага M13, использовании мутантных штаммов Е. coli типа dut ung и в переносе мутантного гена из М13-вектора в экспрессирующий вектор.
Случайный мутагенез с использованием «вырожденных» олигонукмотидных праймеров
К сожалению, обычно бывает неизвестно, какую нуклеотидную замену в клонированном гене нужно произвести, чтобы получить белок с нужными свойствами. Поэтому часто приходится изменять один определенный нуклеотидный сайт всеми возможными способами. Например, можно синтезировать олигонуклеотидные праймеры, в одном из сайтов которых находятся разные нуклеотиды. Такие «вырожденные» олигонуклеотиды обычно получают, добавляя в автоматический синтезатор ДНК на определенном этапе, когда к цепи должен просоединяться специфический нуклеотид, небольшое количество (до нескольких процентов) трех других нуклеотидов (рис. 8.5). В результате получается гетерогенный по одному сайту набор олигонуклеотидных праймеров, с помощью которых можно получить соответствующий набор мутантных генов-мишеней с нуклеотидными заменами в специфическом сайте.
Этот подход имеет два преимущества: 1) не нужно в точности знать, какую роль играет тот или иной аминокислотный остаток в функционировании белка: 2) поскольку в данном сайте происходят разные аминокислотные замены, могут случайно синтезироваться белки с разнообразными интересными и полезными свойствами. Конечно, если ни один из образующихся белков не обладает нужными свойствами, приходится все начинать сначала, синтезировав новый набор "вырожденных" праймеров, комплементарных другой области гена.

164 |
ГЛАВА 8 |
Рис. 8.4. Олигонуклеотид-направленный мутагенез с использованием ПЦР. Реакцию проводят в двух пробирках, в каждой из которых содержится одинаковая двухце π очечная плазмидная ДНК, но разные наборы праймеров. Πраймеры 1 и 3 содержат один неспаривающийся нуклеотид и комплементарны разным цепям плазмидной ДНК. Праймеры 2 и 4 полностью комплементарны соответствующим участкам плазмидной ДНК и тоже гибридизуются с разными цепями. Положение сайтов гибридизации для праймеров каждой пары различается, но их концы стыкуются. В результате ПЦР-амплификации образуются линейные молекулы. По окончании реакции содержимое пробирок смешивают и проводят денатурацию, а затем ренатурацию. В результате кроме двух исходных линейных амплифицированных молекул образуются две кольцевые плазмидные ДНК, каждая с двумя одноцепочечными разрывами. После трансформации кольцевыми молекулами клеток Е. coli разрывы репарируются ферментами клетки-хозяина, и плазмида может реплицироваться независимо. Линейные молекулы ДН К в E. coli не сохраняются.

Направленный мутагенез и генная инженерия белков |
165 |
Олигонуклеотид-направленный мутагенез с использованием векторов на основе фага M 13: эффективный универсальный метод внесения точковых мутаций в любой фрагмент ДНК
M.J. Zoller, M.Smith Nucleic Acids Rea, .10: 6487-6500. 1982
Методика |
|
олигонуклеотид- |
вносить в нее мутации. К |
его |
|
основе |
лежит |
|||||||
направленного мутагенеза (сайт- |
сожалению, этот и другие методы |
использование фага М13 E соli. |
||||||||||||
специфического мутагенеза) была |
олигонуклеотид-направленного |
Чужеродную |
ДНК |
встраивают |
в |
|||||||||
разработана |
в |
основном |
в |
мутагенеза |
требовали |
для своего |
двухцепочечную |
|
репликативную |
|||||
лаборатории |
М, |
Смита |
как |
применения специальных навыков |
форму |
фаговой |
|
ДНК, |
к |
|||||
модификация |
метода «спасения |
и вначале применялись только в |
одноцепочечной |
ДНК |
добавляют |
|||||||||
маркера». При «спасении маркера» |
нескольких |
|
научно- |
олигонуклеотид |
с |
необходимыми |
||||||||
мутацию в фаговой ДНК устраняют |
исследовательских лабораториях. |
заменами, |
получают |
мутантную |
||||||||||
с помощью отжига мутантной ДНК |
Подход, |
разработанный |
копию ДНК. а затем мутантную |
|||||||||||
с фрагментом |
комплементарной |
Цоллером и Смитом, позволял |
двухцепочечную |
|
|
форму. |
||||||||
ДНК дикого типа. Было показано, |
относительно просто, |
специфично |
Впоследствии |
эта методика была |
||||||||||
что, |
отжигая |
химически |
и быстро вносить мутации в любой |
существен |
но |
усовершенствована |
||||||||
синтезированный олигонуклеотид с |
клонированный ген и сразу же |
и упрощена и использовалась для |
||||||||||||
фаговой |
ДНК, можно, напротив. |
получил |
|
широкое |
направленного |
мутагенеза тысяч |
||||||||
|
|
|
|
|
распространение. В |
|
разных генов. |
|
|
|
|
|
||
Частично вырожденные олигонуклеотиды могут быть встроены в ген-мишень разными способами. Один из подходов состоит в следующем. Ген встраивают в плазмиду между двумя уникальными сайтами рестрикции и проводят амплификацию его
Рис. 8.5. Химический синтез олигонуклеотидных праймеров. содержащих в определенных сайтах разные нуклеотиды. В данном случае в сосуде с С- фосфорамидитом (94%) содержатся также фосфорамидиты А (2%), С (2%) и Т (2%), так что в результате реакции образуется смесь олигонуклеотидов, в которых в тех сайтах, где должен находиться С, присутствуют А, С или Т.
левого и правого перекрывающихся между собой фрагментов при помощи нескольких ПЦР (рис. 8.6). Пара праймеров, которая используется для амплификации левого фрагмента, включает неполностью комплементарный олигонуклеотид, спаривающийся с тяжелой цепью гена-мишени, и обычный, полностью комплементарный праймер, гибридизующийся с участком легкой цепи, фланкирующим левый уникальный сайт рестрикции. Один из праймеров, использующихся для амплификации правого фрагмента, содержит некомплементарные нуклеотиды и спаривается с тяжелой цепью гена-мишени, а второй праймер полностью комплементарен участку легкой цепи, фланкирующему второй (правый) уникальный сайт рестрикции. Продукты ПЦР-амплификации очищают и объединяют, а затем подвергают денатурации и ренатурации. В результате образуется некоторое количество частично двухцепочечных молекул ДНК, спаренных в области гена-мишени. Их достраивают до полностью двухцепочечных с помощью ДНК-полимеразы, а затем проводят ПЦРамплификацию с парой праймеров, комплементарных противо-
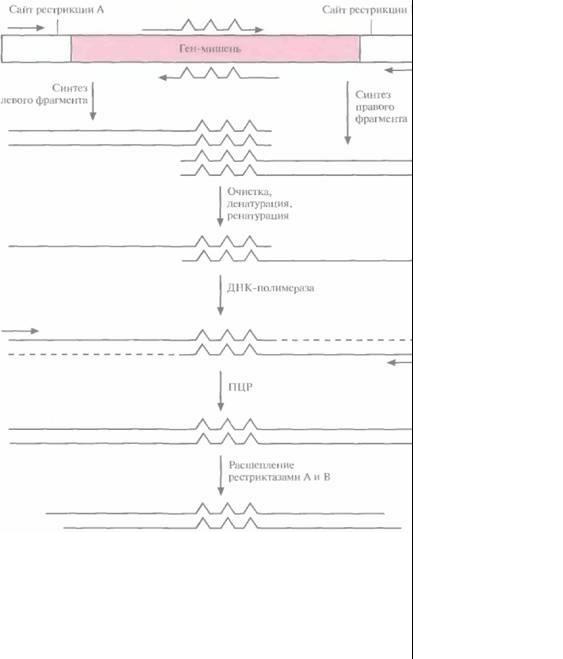
166 |
ГЛАВА 8 |
Рис. 8.6. Случайный мутагенез с использованием «вырожденных» олигонуклеотидов и ПЦР. Левую и правую части гена-мишени амплифициру-ют по отдельности с помощью ПЦР, Соответствующие праймеры показаны горизонтальными стрелками. «Вырожденные» олигонуклеотиды изображены стрелками с тремя зазубринами, каждая из которых отвечает нуклеотиду, не комплементарному соответствующему нуклеотиду в генемишени, Амплифицированные фрагменты очищают, денатурируют до полного разделения цепей и ренатури-руют. В результате образуются частично двух цеп очечные молекулы ДНК, спаренные в области гена-мишени. Их достраивают с помошью ДНК-полимеразы и проводят ПЦРамплификацию. ПЦРпродукты расщепляют эндонуклеазами рестрикции А и В и встраивают в вектор, обработанный теми же ферментами.
положным концам молекул. Амплифицированные молекулы обрабатывают двумя эндонуклеазами рестрикции, уникальные сайты которых находятся на концах фрагмента, и встраивают в соответствующий плазмидный вектор. Этот подход позволяет получить измененные гены со случайными мутациями.
Случайный мутагенез с использованием аналогов нуклеотидов
Помимо методов внесения мутаций в клонированный ген, основанных на использовании фага М13, были разработаны другие подходы, в
которых использовались плазмидные ДНК, Один из них схематично представлен на рис. 8.7. Ген-мишень встраивают в плазмиду поблизости от двух тесно расположенных сайтов рестрикции. Эти сайты подбирают так, чтобы после расщепления двумя рестриктазами образовывались укороченные 3'- и 5'-концы, а именно, чтобы 3'-конец сайта расщепления, расположенного рядом с клонированным геном, был укорочен, а 3'- конец с другой стороны плазмиды выступал.
Экзонуклеаза III (ExoIII) E. coli расщепляет молекулу ДНК только с укороченных 3'- концов,

Направленный мутагенез и генная инженерия белков |
167 |
но не с выступающих 3'- или любых 5'-концов. Ее добавляют в реакционную смесь после инкубированния ДНК с двумя рестриктазами, и она отщепляет от укороченного 3'-конца цепи по одному нуклеотиду. Через определенное время реакцию останавливают и заполняют пробел с помощью фрагмента Кленова ДНК-полимеразы I, используя смесь обычных четырех дезоксирибонуклеотидов с добавлением аналога одного из них. В результате получают плазмиды, содержащие ген-мишень, в одном или нескольких сайтах которого находится аналог соответствующего нуклеотида. Ими трансформируют клетки Е. coli. Плазмиды реплицируются, и в клонированный ген включается нуклеотид, отличный от такового в исходном гене.
Помимо описанного выше, для случайного мутагенеза используют и другие методы, например один из вариантов олигонуклеотид-направленного мутагенеза с применением ДНК фага M13. В этом случае затравкой для синтеза ДНК служит смесь олигонуклеотидов, содержащих случайные замены. В результате получают библиотеки клонов, несущих множество мутаций в различных сайтах. Недостаток подходов, при которых в клонированном гене образуется большое число случайных мутаций, состоит в необходимости тестирования каждого клона для идентификации того, который детерминировал бы синтез нужного белка. Это весьма непростая
Рис. 8.7. Внесение случайных мутаций в клонированный ген. Вектор, несущий клонированный ген, расщепляют рестриктазами RE1 и RE2, в результате чего образуются один 3'- и один 5'-укороченные концы (и соответственно один 3'- и один 3’-выступающие концы). Затем его обрабатывают ферментом ExoIIl, который расщепляет ДНК только с укороченного 3'-конца, удаляя по одному нуклеотиду. Через некоторое время реакцию останавливают и заполняют образовавшийся пробел с помощью фрагмента Кленова ДНК-полимеразы I E. coli. При этом в реакционную смесь добавляют все четыре дезоксинуклеозидтрифосфата (dNTP) и в небольшом количестве - аналог одного из них. Обрабатывают продукт нуклеазой S1 для образования тупых концов, лигируют с помощью ДНК-лигазы и трансформируют клетки Ε. coll. При последующей репликации векторной ДНК в комплементарную цепь включаются нуклеотиды, отличные от исходных, в том сайте, где находится аналог нуклеотида. В результате в клонированный ген вносится мутация.
168 |
ГЛАВА 8 |
задача, но зачастую только так можно выявить белки, обладающие новыми свойствами. Как только эта задача решена, определяют нуклеотидную последовательность соответствующего клонированного гена и идентифицируют измененный сайт (сайты).
Генная инженерия белков
На долю 20 из многих тысяч изученных и охарактеризованных ферментов приходится более 90% всех ферментов, используемых в настоящее время в промышленности. В табл. 8.1 перечислены некоторые наиболее важные из них и указана область их применения. Остальные ферменты не используются потому, что присущая им активность не удовлетворяет требованиям, предъявляемым высокоспециализированными процессами, протекающими in vitro. Большинство ферментов быстро денатурируют при высокой температуре и в присутствии органических растворителей, а именно в этих условиях протекают многие промышленные процессы. Конечно,
Таблица 8, 1. Некоторые ферменты и области их применения
Фермент |
Применение |
|
|
|
|
||
α-Амилаза |
Пивоварение, производство спирта |
||
Аминоацилаза |
Получение L-аминокислот |
||
Бромелаин |
Размягчение |
мяса, |
осветление |
|
соков |
|
|
Каталаза |
Антиоксидант в |
готовых к |
|
|
употреблению пишевых продуктах |
||
Целлюлаза |
Получение спирта и глюкозы |
||
Фицин |
Размягчение |
мяса, |
осветление |
|
соков |
|
|
Глюкоамилаза |
Пивоварение, производство спирта |
||
Глюкозоизоме |
Производство сиропов с высоким |
||
раза |
содержанием фруктозы |
|
|
Глюкозооксид |
Антиоксидант в готовых к |
||
аза |
|
|
|
|
употреблению пишевых продуктах |
||
Инвертаза |
Инверсия сахарозы |
|
|
Лактаза |
Утилизация |
сыворотки, гидролиз |
|
|
лактозы |
|
|
Липаза |
Сыроварение, |
получение |
|
|
ароматизаторов |
|
|
Папаин |
Размягчение |
мяса, |
осветление |
|
соков |
|
|
Пектиназа |
Осветление |
соков, |
производство |
|
спирта |
|
|
Протеаза |
Детергент, производство спирта |
||
Реннет |
Сыроварение |
|
|
термостабильные ферменты можно выделить из термофильных микроорганизмов, однако эти организмы не всегда синтезируют именно те специфические ферменты, которые нужны, Впрочем, эти трудности можно преодолеть при помощи направленного мутагенеза и клонирования генов-мишеней.
Образование дополнительных дисульфидных связей
Термостабильность белковых молекул можно повысить, внеся в них изменения, благодаря которым они дольше нс разворачиваются при повышении температуры. Кроме того, такие термостабильные белки часто не разрушаются в органических растворителях и при нефизиологических условиях (например, при экстремальных pH). К значительному повышению стабильности белковой молекулы может привести образование в ней дополнительных дисульфидных связей. Основная проблема здесь заключается в том, чтобы эти связи не мешали нормальному функционированию белка. В одном из экспериментов при помощи олигонуклеотид-направленного мутагенеза были созданы шесть вариантов лизоцима фага Т4 с новыми внутри-цепочечными дисульфидными связями. Для этого два, четыре или шесть специфических аминокислотных остатков в полинуклеотидной цепи были заменены на остатки цистеина, в результате чего образовалась одна, две и три дисульфидных связи соответственно (табл. 8.2).
Аминокислотные остатки, замененные на остатки цистеина, располагались в активном ферменте близко друг к другу, так что при образовании новых дисульфидных связей общая конформация молекулы существенно не изменялась. Кроме того, они находились вне активного центра фермента — области, наиболее чувствительной к малейшим изменениям конформации. Связи образовывались между остатками 3 и 97, 9 и 164, 21 и 142 (начало нумерации с N-конца).
После мутагенеза мутантные гены идентифицировали и Экспрессировали в Е. coli, рекомбинантные белки очищали и определяли их ферментативную активность и термостабильность (табл. 8,2). Последняя обычно характеризуется температурой, при которой молекула денатурирует на 50%; степень денатурации определяется

Направленный мутагенез и генная инженерия белков |
169 |
Таблица 8,2, Свойства лизоцима Т4 и шести его вариантов, полученных с помощью генной инженерии1*
Ферме ΗТ |
Положения аминокислотных остатков |
|
|
Число |
Активность, |
Тm,°C |
||||
|
|
|
|
|
|
|
|
связей |
|
|
|
3 |
9 |
21 |
54 |
97 |
142 |
164 |
S— S |
% |
|
|
|
|
|
|
|
|
|
|
|
|
1) По данным работы Matsumura el al., Nature 342:291-293, I998.
по изменению кругового дихроизма раствора белка. Исходная (нативная) форма лизоцима Т4 содержит два свободных остатка цистеина, не участвующих в образовании дисульфидных связей. У фермента так называемого «псевдодикого типа» они заменены на остатки Thr и Ala, при этом активность и термостабильность фермента остались прежними. Последовательность «псевдодикого типа» служила стандартом при сравнении вариантов с потенциально термостабилизирующими дисульфидными связями и также предотвращала образование случайных дисульфидных связей между вновь введенными остатками цистеина и остатками, присутствующими в нативном белке.
Результаты этого эксперимента показали, что термостабильность фермента повышается при образовании новых дисульфидных связей, при этом наиболее термостабильным является белок с максимальным числом таких связей. Однако некоторые варианты (С, E и F), будучи более термостабильными, чем нативный фермент или фермент «псевдодикого типа», не обладают ферментативной активностью. Возможно, это обусловливается искажением конформации белковой молекулы при образовании дисульфидной связи между остатками 21 и 142, Хотя создание новых белков с помощью методов генной инженерии часто представляет собой эмпирический процесс (т. е, далеко не всегда бывает ясно, замены каких именно аминокислот позволяют получить «наилучший» вариант), описанный эксперимент показывает, что получение термостабильных белков с дополнительными дисульфидными связями вполне реально.
Была предпринята также попытка получения термостабильной мутантной ксиланазы Bacillus circulans — фермента, который можно использовать при производстве бумаги. Одним из этапов этого процесса является удаление гемицеллюлозы из пульпы с целью ее отбеливания, при этом образуются большие количества токсичных отходов. Обработка древесной массы ксиланазой позволяет использовать меньше отбеливающих химикатов. К сожалению, перед добавлением фермента пульпу обрабатывают горячей щелочью, а поскольку современные технологии имеют тенденцию к уменьшению количества воды, расходуемой на охлаждение пульпы, ксиланаза должна оставаться активной при относительно высоких температурах.
Чтобы определить, в какие участки полипептидной цепи могут быть введены одна, две или три дисульфидных связи для стабилизации фермента без нарушения его каталитической активности, использовали компьютерное моделирование пространственной структуры ксиланазы. Были получены восемь производных ксиланазы В. circulans. Все они обладали более высокой термостабильностью, чем нативный фермент, и при этом три были столь же активны при 60 °С, как и нативный белок, а один, содержащий дисульфидную связь между N- и С-концами, был даже в два раза более активным и сохранял свыше 85% своей активности после 2-часовой инкубации при 60 °С, в то время как нативный фермент полностью утрачивал активность в этих условиях уже через 30 мин. Успех этих экспериментов показывает, что данную стратегию можно использовать для повышения термостабиль-

170 |
ГЛАВА 8 |
ности различных ферментов, если только для них имеются достаточно полные рентгеноструктурные данные. 11 тем не менее пока нельзя быть уверенным, что термостабильная ксиланаза будет широко использоваться при производстве бумаги.
Замена аспарагина на другие аминокислоты
При высоких температурах остатки аспарагина и глутамина могут дезамидироваться с образованием аммиака. Теряя амидную группу, они превращаются в аспарагиновую и глутаминовую кислоты соответственно, что приводит к локальным изменениям конформации полипептидной цепи и как следствие — к утрате активности белков, в которые они входят.
Чтобы установить, какое влияние оказывает замена некоторых остатков аспарагина в молекуле триозофосфат-изомеразы Saccharomyces cerevisiae на свойства фермента, были поставлены специальные эксперименты. Триозофосфатизомераза состоит из двух идентичных субъединиц; каждая из них содержит два остатка аспарагина, замена которых может приводить к изменению термочувствительности белка, поскольку они расположены в месте соприкосновения субъединиц. При помоши олигонуклеотид-направленного мутагенеза были заменены остатки аспарагина в положениях 14 и 78 (табл. 8.3). Замена одного из них на остаток треонина или изолейцина приводила к повышению термостабильности фермента, на аспарагиновую
Таблица 8.3. Стабильность при 100 °С триозофосфат-изомеразы дрожжей и ее генноинженерных вариантов1'
Ферме |
Положения |
|
Время |
||
нт |
аминокислотных остатков |
полужнзнн, |
|||
|
|
|
|
||
|
|
|
|
мин |
|
|
14 |
|
78 |
|
|
Дикий |
|
|
Asn |
|
|
Asn |
13 |
||||
|
|||||
тип |
|
|
|
|
|
A |
Asn |
Thr |
17 |
||
B |
Asn |
!,·· |
16 |
||
C |
Thr |
Πι |
::; |
||
D |
|
|
Aul ! |
11 |
|
1) По данным работы Ahern el al,. Fret. Nail. Acad. Sei. USA 84: 675-679, 1987.
Термостабильность фермента оценивают как время полужизни (скорость инактивации фермента) при 100 'С. Чем оно больше, тем более стабилен фермент.
кислоту — к понижению. Фермент, получающийся при замене обоих остатков аспарагина на остатки аспарагиновой кислоты, оказался нестабильным даже при нормальной температуре и обладал низкой ферментативной активностью (в табл. 8.3 не представлен),
Оценка чувствительности рекомбинантных белков к протеолитическому расщеплению показала, что существует положительная корреляция между термостабильностью белка и его устойчивостью к протеолитическому расщеплению. Полученные данные говорят о возможности создания термостабильных форм других ферментов путем замены несущественных остатков аспарагина.
Уменьшение числа свободных сульфгидрильных групп
Чужеродный белок, синтезируемый в организме-хозяине, иногда оказывается менее активным, чем ожидалось, и чтобы повысить его активность, можно использовать методы генной инженерии. Например, при экспрессии в Е. coli клонированной комплементарной ДНК (кДНК) ß-интерферона человека (ИΦβ) белковый продукт обладал в 10 раз меньшей противовирусной активностью, чем нативная гликозилированная форма. При этом ИΦβ синтезировался в довольно большом количестве, однако почти все его молекулы образовывали димеры и более высокомолекулярные неактивные комплексы.
Как показал анализ нуклеотидной последовательности гена ИΦβ, в нем присутствуют три остатка цистеина, и один из них или несколько, возможно, участвуют в образовании дисульфидных связей, приводящих к образованию димеров и олигомеров в клетках E. coli, но не в клетках человека. Было высказано предположение, что замена одного или нескольких цистеиновых кодонов на сериновые приведет к синтезу интерферона, не образующего олигомеров. Серин был выбран потому, что его структура сходна со структурой цистеина за исключением того, что вместо серы он содержит кислород и поэтому не может образовывать дисульфидные связи.
Приступая к этим экспериментам, исследователи не располагали детальной информацией относительно молекулярной структуры ß-интерферона и были вынуждены опираться на соответствующие
