
Molekulyarnaya_biotekhnologia_Glik_B__Pasternak_Dzh
.pdf
Направленный мутагенез и генная инженерия белков |
171 |
данные для родственных белков. Иными словами, они не знали, какой из трех остатков цистеина был ответствен за формирование межмолекулярных дисульфидных связей. К счастью, локализация остатков цистеина, участвующих в образовании внутримолекулярных дисульфидных связей в молекуле ИФ с аналогичной структурой, была известна, что делало возможным сравнение аминокислотных последовательностей этих двух молекул (рис. 8.8), Как показали результаты анализа, остатки Cys-31 и Cys-141 в ИΦβ находятся в тех же позициях, что и остатки Cys-29 и Cys-138 в ИФ . Поскольку последние участвуют в образовании в ИФ внутримолекулярных дисульфидных связей, было разумно предположить, что Cys-17 в ИΦβ не вовлечен в формирование таких связей и его можно заменить,
Это предположение оказалось правильным: при синтезе в клетках Е. coli Ser-17-ИΦβ мультимерные комплексы не образовывались. Кроме того, этот интерферон обладал такой же удельной активностью, как и аутентичный нативный ИФβ, и был более стабилен при длительном хранении, чем нативная форма.
Повышение ферментативной активности
С помощью направленного мутагенеза можно не только повышать стабильность ферментов, но и изменять их каталитическую активность. В настоящее время для существенного изменения ферментативной активности любого достаточно хорошо охарактеризованного фермента необходимо располагать детальной информацией о геометрии его активного центра. В этом случае можно предсказать, какие замены необходимо произвести для изменения специфичности фермента к данному субстрату.
Возможности данного подхода иллюстрируют результаты эксперимента по изменению специфичности связывания субстрата тирозил-тРНК—синтетазой из В. stearothermophïlus. Этот фермент катализирует аминоацилирование тРНК, которая специфически связывает тирозин (тРНКт>1), в ходе двухступенчатой реакции:
(1)Туг + АТР --> Туr-А + PPi
(2)Туг-А + тРНКТуг--> Туг-тРНКTyr +АМР
1
Рнс. 8.8, Локализация остатков цистеина в молекулах ИФ и ИΦβ, между которыми образуются дисульфидные связи. Выявленные внутримолекулярные дисульфидные связи в ИФ обозначены штриховыми линиями, а предполагаемая связь в ИФβ — пунктирной.

172 |
ГЛАВА 8 |
На стадии 1 АТР активирует тирозин (Туг), в результате чего образуется связанный с ферментом тирозиладенилат (Туг-А) и пирофосфат (РР;). На стадии 2 тирозиладенилат гидролизуется при участии свободной 3'-гидроксильной группы молекулы тРНК, так что тирозин присоединяется к тРНК с высвобождением AMP. В ходе обеих реакций субстраты остаются связанными с тирозил-тРНК—синтетазой.
Ко времени постановки эксперимента была определена пространственная структура тирозил-тРНК—синтетазы В. stearothermophilus и локализован ее активный центр, так что при помощи компьютерного моделирования можно было предсказать влияние замены в нем одного или нескольких аминокислотных остатков на взаимодействие фермента с субстратами. Чтобы проверить правильность прогнозов, с помощью олигонуклеотиднаправленного мутагенеза в ген тирозил-тРНК—синтетазы были внесены специфические мутации. Остаток треонина в положении 51 (Thr-51) был заменен на остаток аланина или пролина. В нативном ферменте гидроксильная группа Thr-51 образует водородную связь с атомом кислорода рибозного кольца тирозиладенилата, и предполагалось, что разрыв этой слабой связи увеличит сродство фермента к АТР.
Чтобы охарактеризовать получившиеся ферменты, определили их кинетические константы. В некоторых случаях изменения оказались более существенными, чем ожидалось (табл. 8.4). Так, если для Ala-51-фермента константа связывания (KM) с АТР уменьшилась примерно в два раза без значительного изменения каталитической константы (kсаt), то для Рro-51-фермента — более чем в 100 раз. При этом каталити-
Таблица 8.4. Эффективность аминоацилирования, осуществляемого нативной (Thr-51) и модифицированной (А1а-51 и Рго-51) тирозил -тРНК— синтетазами 1)
Ферм |
|
|
|
ент |
|
|
|
Thr- |
4,7 |
2,5 |
I860 |
51 |
|
|
|
А1а- |
4,0 |
1,2 |
3200 |
51 |
|
|
|
|
|
|
|
Рго- |
I,8 |
0,019 |
95800 |
51 |
|
|
|
1) По данным работы Wilkinson et al.. Nature 307; 187-188, I984.
ческая эффективность (kсаt/Kм) реакции аминоацилирования увеличилась в обоих случаях. Результат, полученный для Рго-51-фермента. был неожиданным, поскольку замена треонина на пролин должна была привести к нарушению (по крайней мере локальному) структуры α-спирали в этой области, что предположительно должно отрицательно сказаться на связывании субстрата.
Зги данные показывают, что несмотря на всю сложность прогнозирования результата специфических аминокислотных замен, с помощью описанного подхода все же можно идентифицировать боковые группы, замена которых приведет к улучшению кинетических свойств фермента. Кроме того, стало очевидно, что сродство данного фермента к субстрату, а также каталитическую эффективность реакции можно повысить in vitro, внося соответствующие изменения в клонированный ген.
Изменение потребности ферментов в металлических кофакторах
Субтилизины — сериновые протеиназы, секретируемые в культуральную среду грамположительными бактериями, — широко используются в качестве биодеградируемых детергентов. Все они прочно связывают один или несколько атомов кальция, повышающих их стабильность. К сожалению, субтилизины используются в таких промышленных процессах, где участвуют в больших количествах соединения, хела-тирующие металлы, в том числе кальций, и в таких условиях субтилизины быстро теряют свою активность. Чтобы решить эту проблему, попытались сначала лишить субтилизин способности связьшать кальций, а затем увеличить стабильность модифицированного фермента.
Получение модифицированного субтилизина было начато с идентификации гена ΒΡΝ Bacillus amyloliquefaciens. Прежде всего с попомшью рентгеноструктурного анализа высокого разрешения была определена структура белка, а затем с использованием олигонуклеотид-направленного мутагенеза создан мутантный ген с делетированными нуклеотидами, кодирующими участок белковой молекулы от 75

Направленный мутагенез и генная инженерии белков |
173 |
до 83 аминокислотного остатка, который отвечал за связывание кальция. Белок с делецией не связывал кальций и, что удивительно, сохранял конформацию, сходную с таковой исходного белка.
Далее для повышения стабильности субтилизина без кальцийсвязывающего домена идентифицировали сайты, которые необходимо изменить, и аминокислотные остатки, которые нужно ввести в эти сайты. Было высказано предположение, что все аминокислоты, взаимодействующие с кальцийсвязывающим доменом в исходном ферменте, не являются оптимальными в новых условиях. В качестве кандидатов были выбраны 10 аминокислот, а поскольку заранее не было известно, включение какого именно аминокислотного остатка приведет к наибольшей стабилизации фермента, для внесения изменений в каждый из 10 сайтов использовали случайный мутагенез.
Выбранные аминокислоты были локализованы в четырех разных областях белковой молекулы: N-концевом участке (остатки со 2 по 5), в омега-петле (остатки с 36 по 44), в α- спиральной области (остатки с 63 по 85) и в одном из ß-слоев (остатки с 202 по 220). Чтобы идентифицировать оптимальную для данного сайта аминокислоту, мутантные клоны выращивали в плашках, прогревали при 65 °С в течение 1 ч, охлаждали и измеряли активность субтилизина. Для синтеза активного, не связывающего кальций субтилизина пришлось использовать В. subtilis, поскольку для E. coli такой белок оказался токсичным.
Предварительный анализ выявил наличие стабилизирующих мутаций в 7 из 10 исследованных сайтов (табл. 8.5). Фермент, полученный при их внесении в один ген, обладал кинетическими свойствами, сходными с таковыми исходного субтилизина. Кроме того, мутантный субтилизин в отсутствие кальция был почти в 10 раз более стабилен, чем исходный и, как это ни удивительно, примерно на 50% более стабилен, чем исходный фермент в присутствии кальция. Полученные результаты показывают, что несмотря на трудоемкость этих экспериментов с помощью генной инженерии можно изменять свойства ферментов, которые зависят от большого числа аминокислотных остатков.
Таблица 8.5. Влияние случайных имен аминокислотных остатков в определенных участках на стабильность субтилизина BPN', лишенного кальцийсвязывающего домена 1)
Изменение специфичности фермента
Олигонуклеотид-направленный мутагенез используют в основном для улучшения уже существующих свойств ферментов, но, вероятно, с его помощью можно изменять ферменты таким образом, чтобы они преобретали другую специфичность. Например, таким способом на основе относительно неспецифичной эндонуклеазы Fok1 были получены новые сайтспецифичные эндонуклеазы.
К настоящему времени идентифицировано более 2500 ферментов рестрикциимодификации, происходящих из большого числа разных организмов. Многие из них узнают одну и ту же нуклеотидную последовательность, так что всего существует около 200 разных рестриктазных сайтов, при этом размер большинства из них составляет от 4 до 6 п. н. Эндонуклеазы рестрикции, узнающие такие сайты, расщепляют молекулу ДНК в очень многих местах и используются для получения больших фрагментов ДНК не столь широко, как эндонуклеазы рестрикции, узнающие нуклеотидные последовательности длинной в 8 п. н, или больше. Поиск новых эндонуклеаз рестрикции — весьма непростая задача, для ее решения требуется много времени. Вряд ли можно надеяться, что удастся найти достаточно много фер-
174 |
ГЛАВА 8 |
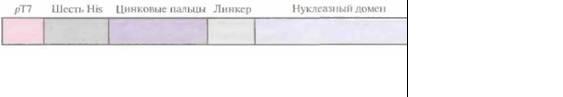
Рис. 8.9.
Генноинженерная конструкция, копирующая рекомбининтный белок «цинковые пальцы ~ эндонуклеаза рестрикции
FokI».
ментов, узнающих сайты длинной 8 п. н. и больше, так что для получения новых рестриктаз необходимо использовать альтернативные генно-инженерные подходы.
Существует весьма интересный класс белков, в молекуле которых присутствуют уникальные структурные домены, связывающие атомы Zn2+, — так называемые цинковые пальцы. Эти белки связываются со специфической нуклеотидной последовательностью, встраиваясь своим -спиральным участком в большую бороздку двойной спирали. Так, белок Zif268 из клеток мышей содержит три цинковых пальца, каждый из которых взаимодействует с определенным кодоном ДНК. Поскольку эти пальцы связываются с ДНК независимо друг от друга, их можно объединить в составе одного пептида таким образом, чтобы связывание происходило с определенным сайтом. Это позволяет создавать нук-леазы, расщепляющие ДНК в уникальных сайтах, объединив нуклеотидные последовательности, кодирующие цинковые пальцы, с частью гена неспецифичной нуклеазы FokI бактерии Flavobacterium okeanokoites. Чтобы проверить реальность этого предположения, был создан химерный ген, кодирующий участок из шести остатков гистидина на N-конце белковой молекулы для упрощения очистки рекомбинантного белка, три цинковых пальца, линкер (G1y4Ser)3 для придания гибкости рекомбинантной молекуле, а также содержащий часть гена нуклеазы FokI (рис, 8.9), После очистки рекомбинантного белка N-концевые остатки гистидина были удалены обработкой тромбином.
Бактерии, синтезирующие эндонуклеазы рестрикции, зашищают собственную ДНК от расщепления с помощью ферментов, метилирующих те участки молекулы, с которыми связывается соответствующая эндонуклеаза рестрикции. Однако геном клетки-хозяина не защищен от рекомбинантной рестриктазы FokI, и чтобы предотвратить гибель растущих клеток, синтез гибридного фермента подавляли, поместив ее ген под контроль системы экспрессии бактериофага Т7,
В результате этих экспериментов были получены две рекомбинантные эндонуклеазы рестрикции FokI. Одна из них расщепляла ДНК фага λ в том сайте, который и ожидался, а вторая — в ожидаемом сайте и — в меньшей степени — в двух других сайтах. Это не удивительно, поскольку цинковые пальцы распознают в основном два из трех оснований триплета. Хотя эти рекомбинантные ферменты пока нельзя использовать в лаборатории, описанный подход создания уникальных эндонуклеаз рестрикции представляется весьма перспективным.
Повышение стабильности и специфичности фермента
Фермент, называемый активатором тканевого плазминогена (tPA), — это сериновая протеина-за, состоящая из нескольких доменов; ее используют в клинике для растворения сгустков крови, К сожалению, tPA быстро выводится из системы кровообращения, поэтому его приходится вводить путем инфузии. Чтобы добиться желаемого терапевтического эффекта, необходимо использовать высокие концентрации фермента, а это может приводить к неспецифическому внутреннему кровотечению. Таким образом, было бы весьма желательно получить долгоживущий фермент tPA, обладающий высоким сродством к фибрину в тромбах и не вызывающий кровотечения. Белок с такими свойствами можно получить, внося специфические мутации в ген нативного 1РА, Заменив Thr-103 на Asn, получили фермент, сохраняющийся в плазме кролика примерно в 10 раз дольше, чем нативный вариант. Заменив аминокислоты 296-299 с Lys-His-Arg-Arg на Ala-Ala-Ala-Ala, добились существенного повышения сродства фермента к фибрину. Заменив Asn-117 на Gin, получили фермент с такой же фибринолитической активностью, как у исходного фермента. Внеся эти три мутации в один белок, получили фермент, обладающий всеми тремя свойствами (табл. 8.6). Чтобы выяснить, можно ли использовать его вместо нативного tРА, нужно провести дополнительные исследования.

Направленный мутагенез и генная инженерия белков |
175 |
|
|
|
|
|
||
Таблица 8.6. Стабильность и активность различных мутантных вариантов фермента tРА1), 2) |
||||||||
|
|
|
|
|
|
|
|
|
Вар |
Модификация(и) |
|
Стабильн |
|
Срод |
Актив |
Эффектив |
|
иант |
|
|
ость в плазме |
ство |
к ность |
в ность |
||
|
|
|
|
|
фибрину |
плазме |
растворения |
|
|
|
|
|
|
|
0,34 |
|
сгустков |
1 |
|
10 |
|
|
|
0,68 |
0,56 |
|
|
|
|
|
|
|
|
||
2 |
|
0,85 |
|
|
0,93 |
0,13 |
1,01 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
0,33 |
0,13 |
0,65 |
|
|
5,3 |
|
|
||||
|
|
|
|
|
|
|
|
|
4 |
|
|
3,4 |
|
|
1,0 |
1,13 |
1,17 |
|
|
|
|
|
||||
5 |
|
|
|
|
|
1,33 |
0,16 |
1,38 |
|
|
|
|
|||||
|
|
1,2 |
|
|
||||
|
|
|
|
|
0,87 |
0,06 |
0,85 |
|
6 |
|
|
|
|
||||
|
|
|
|
|||||
|
|
8,3 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1)По данным работы Pena et al., Prix. Nati, Acad.Sсi, USA91: 3670-3674, 1994.
2)Все значения нормированы относительно соответствующих значений для исходного фермента. Стабильность в плазме обратна времени, необходимому для осветления плазмы; чем больше приведенная величина, тем выше стабильность. Сродство к фибрину коррелирует с эффективностью растворения сгустков. По отношению к активности в плазме имеет место отрицательная корреляция.
ЗАКЛЮЧЕНИЕ
Свойства любого белка зависят от его конформации, которая в свою очередь определяется аминокислотной последовательностью. Некоторые аминокислоты в полипептидной цепи играют ключевую роль в определении специфичности, термостабильности и других свойств белка, так что замена единственного нуклеотида в гене, кодирующем белок, может привести к включению в него аминокислоты, приводящему к понижению его активности, либо, напротив, к улучшению каких-то его специфических свойств. С развитием технологии рекомбинантных ДНК появилась возможность производить специфические замены в клонированных генах и получать белки, содержащие нужные аминокислоты в заданных сайтах. Такой подход получил название направленного мутагенеза. Как правило, интересующий исследователя ген клонируют в ДНК фага М13. Одноцепочечную форму ДНК этого фага копируют с использованием олигонуклеотидного праймера, синтезированного таким образом, чтобы в ген-мишень был встроен определенный нуклеотид. Затем трансформируют двухпепочечными ДНК М13 клетки Е. coli. Часть образующихся в клетках фаговых частиц несет ген, содержащий нужную мутацию. Такие частицы идентифицируют, встраивают мутантный ген в экспрессирующий вектор, синтезируют белок и определяют его активность. Вносить изменения в клонированные гены можно также с помощью плазмид или ПЦР. Обычно заранее не известно, какую именно аминокислоту (аминокислоты) необходимо заменить для того, чтобы улучшить то или иное свойство белка-мишени. Поэтому предпочтительно использовать случайный, а не олигонуклеотид-направленный мутагенез.
Выбор аминокислоты, подлежащей замене, как правило, производится с учетом ее роли в функционировании белка. Данные об этом получают в ходе генетических исследований или методом ренттеноструктурного анализа трехмерной структуры белка. Изменяя специфические сайты или целые участки белковой молекулы, можно повысить термостабильность белка, изменить его чувствительность к pH, специфичность, аллостерическую регуляцию, потребность в кофакторе и другие свойства. Так, термостабильность триозофосфатиозомеразы удалось повысить, заменив аминокислоты в двух позициях. Этот подход можно использовать как для придания новых свойств уже существующим белкам, так и для создания уникальных ферментов.
ЛИТЕРАТУРА
Ahern Т. J., J. I. Casai, G. A. Petsko, A. M. Kli-
banov. 1987. Control of oligometric enzyme thermostability by protein engineering. Proc. Nati.
Acaà. Sei. USA 84: 675-679. Brange J., U. Ribel, J. F. Hansen, G. Dodson, M, T. Hansen, S. Havdund, S. G. Mdberg, F. Norris, K. Noms, L. Snel, A. R. Sorensen, H. O, Voigt. 1988. Monomeric insulins obtained
176 |
ГЛАВА 8 |
by protein engineering and their medical implications. Nature 333: 679-682.
Chen K.( F. H. Arnold. 1991. Enzyme engineering for nonaqueous solvents: random mutagenesis to enhance activity of subtilisin E in polar organic med'm.Bio/Technology 9: 10731077.
Deng W. P., J. A. Nickoloff. 1992. Site-directed mutagenesis of virtually any plasmid by eliminating a unique site. Anal. Biochem. 200: 81—88.
Geisselsoder J., F. Witney, P. Yuckenberg. 1987. Efficient site-directed in vitro mutagenesis.
Bio Techniques Si 786-791.
Herlitze S., M. Koenen. 1990. A general and rapid mutagenesis method using polymerase chain reaction. Gene91: 143-147.
Hermes J. D., S. M. Parekh, S. C. Blacklow, H. Küster, J. R. Knowles. 1989. A reliable method for random mutagenesis: the generation of mutant libraries using spiked oligodeoxyribonucleotide primers. Gene 94: 143—151.
Keyt B. A., N. F. Paoni, C. J. Refino, L. Berleau, H. Nguyen, A, Chow, J. Lai, L. Pena, C. Pater, J. Ogez, T. Etcherary, D. Bofetein, W. F. Bennett. 1994. A faster-acting and more potent form of tissue plasminogen activator. Proc. Natl. Acad. Sei. №/(91:3670-3674.
Kim Y.-G., J. Cha, S. Chandrasegaran. 1996. Hybrid restriction enzymes: zinc finger fusions to Fok\ cleavage domain. Proc. Natl. Acad. Sei. USA 93: 1156-1160.
KirchhoffF., R. C. Desrosiers. 1995. Random mutagenesis of short target DNA sequences via PC R with degenerate oligonucleotides. Methods Mol. ß/o/. 57: 323-333.
Landt О., H.-P. Grunert, U. Hahn. 1990. A general method for rapid site-directed mutagenesis usirig the polymerase chain reaction. Седа 96: 125-128.
Mark D. F., S. D. Lu, A. A. Creasey, R. Yaniaiiioto, L. S. Lin. 1984. Site-specific mutagenesis of the human fibroblast interferon gene. Prof. Natl. Acad. Sei. USA 81: 5662-5666.
Matsumura M., G. Signor, B. W. Mathews. 1989. Substantial increase of protein stability by multiple disulfide bonds. Nature 342: 291-293.
Nosoh Y., T. Sekiguchi. 1990. Protein engineering forthermostability. Trends Biotechnol. 8: 16-20.
Piccftocki M. P., R. N. Hines. 1994. Oligonucleotide design and optimized protocol for sitedirected mutagencsis. Bio Techniques 16: 702—707.
Sliiraishi H., Y. Shimura. 1988. A rapid and efficient method for targeted random mutagenesis. Gene 64: 313-319.
Smith M. 1985. In vitro mutagenesis. Annu. Rev. Genet. 19: 423-462.
Strausberg S. L., P. A. Alexander, D. T. Gallagher, G. L. Gilliliuid, B. L. Barnett, P. N. Bryan. 1995. Directed evolution of a subtilisin with calcium-independent stability, Bio/Technology
13:669-673.
Wakarchuk W. W., W. L. Sung, R. L. Campbell, Λ. Cunningham, D. C. Watsnn, M. Yaguclii.
1994 Thermostabilization of the BadIlus circulons xylanase by the introduetion of disulfitle bonds.
Protein Eng. 7: Ш9-1386.
Wetze! R., L. J. Perry, С. Veilleux. 1991. Mutations in human interferon gamma affecting inclusion body formation identified by a general immuno-chemical screen. Bio/Technology 9: 731—737.
Wilkinson A. J., A. R. Fersht, D. M. Blow, P. Carter, G. Winter. 1984. A large increase in enzyme-substrate affinity by protein engineering. Nature 307: 187-188.
Zoller M. J,, M. Smith. 1982. Oligonucleotide-directed mutagenesis using M13-derived vectors: an efficient and general procedure for the production of point mutations in any fragment of DNA. Nucleic Acids Res. 10: 6487-6500.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какие физические и химические свойства ферментов можно изменить с помощью направленного мутагенеза?
2.Предположим, что вы клонировали бактериальный ген, экспрессирующийся в E. coli,
ихотите изменить его активность. Однако в результате применения стандартного метода мутагенеза с использованием ДНК М13 по ряду технических причин лишь небольшая часть клонов приобрела мутантный ген-мишень, а большинство из них содержит интактный ген. Как увеличить долю клонов, содержащих ДНК с нужной мутацией?
3.Предположим, что вы выделили ген фермента, синтезирующегося в E. coli. Опишите стратегию изменения каталитической активности этого фермента, принимая во
Направленный мутагенез и генная инженерия белков |
177 |
внимание тот факт, что вы знаете нуклеотидную последовательность кодирующего его гена, но не знаете, какой из участков молекулы фермента ответствен за каталитическую активность.
4.Каковы преимущества и недостатки олигонуклеотид-направленного мутагенеза с использованием бактериофага М13 и ПЦР?
5.Опишите стратегию олигонуклеотид-направленного мутагенеза с использованием плазмидной ДНК.
6.Как, используя «вырожденные" праймеры, можно вносить случайные мутации в
ДНК?
7.Опишите стратегию повышения стабильности белка, в котором а) отсутствуют остатки цистеина; б) присутствует нечетное число остатков цистеина.
8.Как влияет замена аспарагина на другой аминокислотный остаток на стабильность
белка?
9.Каким образом можно изменить потребность фермента в кофакторах?
10.Как вы будете изменять каталитическую активность или субстратную специфичность фермента, ген которого вы выделили? В чем смысл этой процедуры?
ЧАСТЬ II.
Mолекулярная
биотехнология
микробиологических
систем
Сразвитием технологии рекомбинантных ДНК появилась возможность более эффективно использовать многие полезные свойства микроорганизмов. В ч. II мы рассмотрим некоторые примеры практического применения микробиологических систем, модифицированных методами генной инженерии.
Спомощью современных генетических методов биологи научились превращать бактерии в своеобразные «биологические фабрики» по производству белковых препаратов (например, рестрицируюших эндонуклеаз), различных химических соединений, аминокислот, антибиотиков и т. д. Клонируя в бактериальных клетках специфические гены, они создают новые пути биосинтеза для получения уникальных метаболитов, применяют клонированные гены болезнетворных микроорганизмов в качестве зондов для диагностики заболеваний человека
идомашних животных, используют изолированные гены для получения безопасных и эффективных вакцин.
Методами генной инженерии можно усиливать природную способность определенных видов бактерий к осуществлению специфических биологических процессов. Например, уже получены штаммы бактерий, которые более эффективно разрушают токсичные отходы, загрязняющие окружающую среду, способствуют ускорению роста сельскохозяйственных культур, эффективно расщепляют целлюлозу до низкомолекулярных углеродных соединений, уничтожают вредных насекомых.
Часто думают, что выращивание больших количеств микроорганизмов представляет собой рутинную процедуру. Однако для успешного производства рекомбинантных белков в промышленных масштабах необходимо контролировать множество параметров, от которых зависит рост синтезирующих их микроорганизмов и чистота получаемых продуктов.
