
Molekulyarnaya_biotekhnologia_Glik_B__Pasternak_Dzh
.pdfОптимизация экспрессии генов, клонированных в прокариотических системах |
131 |
перегрузке. Разработан целый ряд способов, позволяющих минимизировать этот эффект и одновременно оптимизировать выход белка-мишени и стабильность трансформированных клеток.
Системы экспрессии весьма разнообразны, и исследователям приходится каждый раз подбирать условия, наиболее подходящие для получения того или иного белка в том или ином организме-хозяине. И все же, несмотря на различия в деталях, для создания самых разных систем экспрессии используются одни и те же основные приемы.
ЛИТЕРАТУРА
Ашапл E., J. Brosius. 1985. "ATG vectors" for regulated high-level expression of clones genes in
Escherichia coll. Gene A»: 183-190.
Aristidou A. A., K. Y. San, G. N. Bennett. 1995. Metabolic engineering of Escherichia coli to enhance recombinant protein production through acetate reduction. Biotechnol Prog. II:475—478.
BachniairA., D, Finley, A. Varshavsky. 1986. In vivo half-life of a protein in a function of its arnino-termimit residue. Science 234: 179—186.
Bagdasarian M. M., E. Amann, R. Lurz, B. Ruckert, M. Bagdasarian. 1983. Activity of the hybrid
Op-lac (tac) promoter of Escherichia coli in Pseudomonas putida. Construction of broad-host-range, controlled-expression vectors, Gene 26: 273-282.
Baker R. T., A. Varshavsky. 1991. Inhibition of the N-end rule pathway in living cells. Proc. Naît. Acad. Set. Î/&488: 1090-1094.
Chaitan K., J. E. Curtis, J. De Modena, U. Rinas, J. E. Bailey. 1990. Expression of intracellular hemoglobin improves protein synthesis in oxygen-limited Escherichia coli. Bio/Technology 8: 849-853.
Chou С. H., G. N. Bennett, K. V. San. 1994. Effect of modified glucose uptake using genetic engineering techniques on high-level recombinant protein production in Escherichia coli dense cultures.
Biotechnol. Bioeng. 44: 952-960.
deBoer H. A., L J. Cnmstnck, M. Yasser. 1983. The tac promoter a functional hybrid derived from the trp and lac promoters. Proc. Nafl. Acad. Set. USA 80: 21-25.
Donovan R. S., C. W. Robinson, B. R. Click. 1996. Optimizing inducer and culture conditions for expression of foreign proteins under the control of the lac promoter. /. Ind. Microbiol. 16: 145-154.
Ernst J. F. 1988. Codon usage and gene expression. Trends Biotechnol. 6: 196-199.
Friesen J. D., G. An. 1983. Expression vehicles used in recombinant DNA technology. Biotechnol. Adv. 1: 205-227.
Geisow M. J. 1991. Both bane and blessing-inclusion bodies. Trends Biotechnol. 9: 368-369.
Gentz R., A. Langner, A. C. Y. Chang, S. N. Cohen, fL Bujard. 1981. Cloning and analysis of strong promoters is made possible by the downstream placement of a RNA termination signal, Proc. Natl. Acad. Sei. USA 78: 4936-4940.
Click B. R. 1995. Metabolic load and heterologous gene expression. Biotechnol. Adv. 13: 247— 261,
Click B. R., G. K. Whitney. 1987. Factors affecting the expression of foreign proteins in
Escherichia coli. J. Ind. Microbiol. I: 277-282.
Goldstein M. A., R. H. Doi. 1995. Prokaryotic promoters in biotechnology, In p. 105—128. M. R. El-Gewely (ed.), Biotechnology Annual Review, vol. 1. Elsevier Science B. V., Amsterdam, The Nertherlands.
Gwynne D. I., F. P. Buxton, S. A. Williams, S. Garven, R. W. Davies. 1987. Genetically engineered secretion of active human interferon and a bacterial endoglucanase from Aspergillus niduians. Bio/Technology 5: 713-719.
Halfmann G., H. Brailly, A. Bernadac, F. A. Mon-tero-Julian, C. Lazdimski, D. Baty. 1993. Targeting of interleukin-2 to the periplasm of Escherichia coli. J. Gen. Microbiol. 139: 2465-2473.
Hartley J. L., T. J. Gregori. 1981. Cloning multiple copies of a DNA gene. Geve 13: 347-353. Hockney R. C. 1994. Recent developments in heterologous protein production in Escherichia coli.
Trends Biotechnol. 12: 456-463.
Hopp T. P., K. S. Pricket t, V. L. Price, R. T. Libby, C. J. March, D. P. Cerretti, D. L. Urdal, P. J. Conlon. 1988. A short polypeptide marker sequence useful for recombinant protein identification and purification. Bio/Technology 6: 1204-1210.
Hsiung H. M., A. Cantrell, J. Luirink, B. Oudega, A. J. Veros, G. W. Becker 1989. Use of bacteri-
132 |
ГЛАВА 6 |
ocin release protein in E. coll for excretion of human growth hormone into the culture medium.
Bio/Technology 7: 267-271.
Jay G., G. Khoury, A. K. Seth, E. Jay. 1981. Construction of a general vector for efficient expression of mammalian proteins to bacteria: use of a synthetic ribosome binding site. Proc. Natl. Acad. Sei. USA 78: 5543-5548.
Jespers L. S., J. H. Messens, A. De Keyset. D. Lee kin »tit, 1. Van den Brande, Y. (i. (Îansemaiis.
M. J. Lauwereys, G. P. Vlasuk, P. E. Stanssens. 1995. Surface expression and ligand-based sélection of cDNAs fused to filamentous phage gene VI. Bio/Technology 13: 378-382.
Kaffio P., A. Palva, I. Palva. 1987. Enhancement of α-amylase production by integrating and amplifying the α-amylase gene of Bacillus amylotique-faciens in the genome of Bacillus subtilis. Appt. Microbiol. Biotechnol 27: 64-71.
Kiel J. A. K. W., A. M. ten Berge, P. Borger, G. Venema. 1995. A general method for the consecutive integration of single copies of a heterol-ogous gene at multiple locations in the Bacillus subtilis chromosome by replacement recombination. Appf. Environ. Microbiol. 61: 4244—4250.
Kolata G. 1986. New rule proposed for protein degradation. Science234: 151—153.
Kolowsky K. S., J. G. K. Williams, A. A. Szalay. 1984. Length of foreign DNA in chimeric plasmids determines the efficiency of its integration into the chromosome of the cyanobacterium
Synechococcus R2. Gene 27: 289-299.
Kozlowski M., A. VanBrunschot, G. Nash, R. W. Davies. 1988. A novel vector allowing the expression of genes in a wide range of gram-negative bacteria. Gene 70: 199-204.
Labes M., A. Puhler, R. Simon. 1990. A new family of RSFlOlO-derived expression and /йсfusion broad-host-range vectors for gram-negative bacteria. Gene 89: 37-46.
Lee N., J. Cozzitorto, N. Wainwright, D. Testa. 1984. Cloning with tandem gene system for high level gene expression. Nucleic Acids Res. 12: 6797-6812.
Leemans R., E. Remaut, W. Fiers. 1987. Broad-host-range expression vector based on the pL promoter of соliphage 1: regulated synthesis of human interleukin 2 in Erwinia and Serratia species. J. Bacterioi. 169: 1899-1904.
Little M., F. Breitling, B. Micheel, S. Dübel. 1994. Surface display of antibodies, Biotechnol. Adv.
12: 539-555.
Liu S. C., D. A. Webster, M. L. Wei, В. С. Stark. 1996. Genetic engineering to contain the Vitreoscilla hemoglobin gene enhances degradation of be n zoic acid by Xanthomonas maltophilia. Biotechnol. Bioeng. 49: 101-105.
Looman A. C., J. Bodlaender, M. de Gruyter, A. Vogelaar, P. H. van Knippenberg. 1986. Secondary structure as primary determinant of the efficiency of ribosomal binding sites in Escherichia coii. Nucleic Acids Res. 14: 5481-5497.
Magnolo S. K., D. L. Leenutaphong, J. A. DeMu-dena, J. E. Curtis, J. E. Bailey, J. L. Gala//«,
D. E. Hughes. 1991. Actinorhodin production by Streptomyces coeticoior and growth of Streptomyces lividans are improved by the expression of a bacterial hemoglobin. Bio/Technology 9: 473-476.
Meerman H. J., G. Georgiou. 1994. Construction and characterization of a set of E, coli strains deficient in all known loci affecting the prote-olytic stability of secreted recombinant proteins.
Bio/Technology 12: 1107-1110.
Miescliendahl M., B. Miiller-HUl. 1985. F'-coded, temperature -sensitive λ cI857 represser gene for each construction and regulation of λ promoter-dependent expression systems. J. Bacterioi. 164: 13661369.
Mieschendahl M., T. Pétris, U. Hanggi. 1986. A novel prophage independent trp regulated XpL expression system. Bio/Technology 4: 802-808.
Murby M., M. Üblen, S. Stähl. 1996. Upstream strategies to minimize proteolytic degradation upon recombinant production in Escherichia coii. Protein Expr. Purif. 7: 129-136.
Nagai K., H. C. Thogersen, 1984, Construction of ß-globin by sequence-specific proteolysis of a hybrid protein produced in Escherichia coii. Nature 309:810-812.
Nygren P. Λ., S. Stahl, M. Uhlén. 1994. Engineering proteins to facilitate bioprocessing. Trends Biotechnol. 12; 184-188.
O'Neil К. Т., R H. Hoess. 1995. Phage display: protein engineering by directed evolution. Curr, Opin. Struct. Biol. 5: 443-449.
Оптимизация экспрессии генов, клонированных в прокариотических системах |
133 |
Perez-Perez J., G. Marquez, J. L. Barbero, J. Gutierrez. 1994. Increasing the efficiency of protein export in Escherichia con". Bio/Technology 12: 178-180.
Remaut E., H. Tsao, W. Fiers. 1983. Improved plas-mid vectors with thermoinducible expression and temperature-regulated runaway regulation. Gene 22: 103-113.
Rogers S., R. Wells, M. Rechsteiner. 1986. Amino acid sequences common to rapidly degraded proteins: the PEST hypothesis. Science 234: 364-368.
Sander F. C., R. A. Fachini, D. £. Hughes, J. L. Galazzo, J. E. Bailey. 1994. Expression of
Vitreoscilla hemoglobin in Corynebacterium glu-tamicum increases final concentration and yield of L-Jysine, p. 607-610, /« L. Alberghina, L. Frontali. P. Sensi ied.). Proceedings of the 6th European Congress on Biotechnology. Eisevier Science B.V., Amsterdam, The Netherlands.
Sassenfeld H. M., 1990. Engineering proteins for purification. Trends Biotechnol. 8: 88—93. Simmons L. C., D. G. Yansura. 1996. Translational level is a critical factor for the secretion
of heterol-ogous proteins in Escherichia coli. Nat. Biotechnol. 14: 629-634.
Sung W. L., F. L. Yao, D. M. Zahab, S. A. Narang. 1986. Short synthetic oligodeoxyribonucleotide leader sequences enhance accumulation of human proinsulin synthesized in Escherichia coli. Proc. Nail. AcaO. Sei. USA 83: 561-565.
Talmadge K., W. Gilbert. 1982. Cellular location affects protein stability in Escherichia coli. Proc. Nail. AcaO. Sei. USA 79: 1830-1833.
Taylor W. M., P. J. Hagerman. 1987. A general method for cloning DNA fragments in multiple copies. Gene 53: 139-144.
Tobias J. W., T. E. Schrader, G. Rocap,
A. Varshavsky. 1991. The N-end rule in bacteria. Science 254: 1374-1377.
Tsuchiya M., Y. Morinaga. 1988. Genetic control systems of Escherichia coli can confer inducible expression of cloned genes in coryneform bacteria. Bio/Technology 6: 428-430.
Weinstock G. M., C. A. Rhys, M. L. Berman,
B. Hampar, D. Jackson, T. J. Silhavy, J. Weisemann, M. Zweig. 1983. Open reading frame expression vectors: a general method for antigen production in Escherichia coli using pro-
tein fusion to ß-galactosidase. Proc. Natl, Acad. Sei. USA 80: 4432-4436.
Wilcox G., G. M. Studnicka. 1988. Expression of foreign proteins in microorganisms.
Biotechnol. Appl. Biochem. 10: 500-509.
Wilkinson D. L., R. G. Harrison, 1991. Predicting the solubility of recombinant proteins in
Escherichia coli. Bio/Technology 9: 443—448.
Williams J. G. K., A. A. S/alay. 1983. Stable integration of foreign DNA into the chromosome of the cyanobacterium Synechococcus R2. Gene 24: 37-51.
Wong R. S. Y., R. A. Wirtz, R, E. W. Hancock. 1995. Pseudomonas aeruginosa outer membrane protein OprF as an expression vector for foreign epitopes: the effects of positioning and length on the anti-genicity of the epitope. Gene 158: 55—60.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какими способами можно влиять на экспрессию генов, клонированных в прокариотических организмах?
2.Что такое ген lacIq и как его используют?
3.Почему плазмидный вектор с максимально сильным промотором не всегда является наилучшим экспрессирующим вектором?
4.Что такое tac-промотор и как осуществляется его регуляция?
5.Промотор pL фага λ, способного инфицировать только E. coli, тем не менее иногда
используют как составную часть экспрессиру-ющего вектора с широким кругом хозяев. Как «приспособить» рL-промотор для инициации транскрипции в других организмах?
6.Иногда стратегия синтеза белка-мишени включает получение этого белка в составе химерного продукта. В чем преимущество такого подхода? Как создают химерный белок?
7.Что такое тельца включения и как избежать их образования?
8.В чем преимущество локализации чужеродных белков на поверхности клеток? Какие стратегии используются для того, чтобы сделать белки секретируемыми?
9.Как встроить в одну плазмиду несколько копий гена?
134 |
ГЛАВА 6 |
10.Как решить проблему обеспечения кислородом клеток Е. соli, синтезирующих в большом количестве чужеродный белок?
11.Последовательность-мишень может быть встроена в хромосомную ДНК двумя способами: 1) сама по себе; 2) в составе плазмиды, которая несет эту последовательность. Как происходит каждое из этих событий? Какие
преимущества или недостатки имеет интеграция плазмидного вектора в хозяйскую ДНК?
12.Что такое метаболические перегрузки и какова их причина?
13.Предложите несколько способов снижения метаболической перегрузки E. coli, синтезирующих в большом количестве рекомбинантный белок.
ГЛАВА 7 Получение рекомбинантных белков с
помощью эукариотических систем
Для получения гетерологичных рекомбинантных белков с клонированной уукариотической комплементарной ДН К (кДНК) обычно используются прокариотические системы экспрессии. Однако и некоторых случаях эукариотические белки, синтезированные в бактериях, оказываются нестабильными или биологически неактивными. Кроме того, как бы тщательно ни проводилась очистка, конечный продукт может быть загрязнен токсичными веществами или веществами, вызывающими повышение температуры у человека и животных (пирогенами). Чтобы решить эти проблемы, для получения рекомбинантных белков, предназначенных для использования в медицине, были разработаны эукариотические системы экспрессии. Такие белки должны быть идентичны природным по своим биохимическим, физическим и функциональным свойствам. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена в основном отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций,
Белки в клетках эукариот претерпевают следующие посттрансляционные изменения:
•Образование дисульфидных связей. Эту реакцию катализирует фермент дисульфидизомераза. Неправильно уложенный белок оказывается нестабильным и неактивным.
•Протеолитическое расщепление предшественника, удаление определенного участка полипептидной цепи с образованием функционально активного белка.
•Гликозилирование: основная модификация, благодаря которой белки приобретают
стабильность, а в некоторых случаях — особые свойства. Наиболее распространенная
реакция гликолизировгшия — это присоединение специфического сахарного остатка либо к серину или треонину (О-гликозилирование), либо к аспарагину (N-гликолизирование).
* Модификации аминокислот в составе белка: фосфорилирование, ацетилирование, ацилирование, гамма-карбоксилирование, сульфатирование, миристилирование и пальмитоилирование.
Из всех этих модификаций прокариотические хозяйские клетки наименее всего способны осуществлять правильное гликозилирование и модификацию специфических аминокислот в гетерологичном белке. Однако ни одна эукариотическая система не может осуществить одновременно все посттрансляционные изменения в каждом потенциальном гетерологичном белке. Таким образом, для получения белка с полным набором специфических модификаций необходимо провести тестирование различных эукариотических систем экспрессии и найти такую, которая воспроизводила бы биологически аутентичный продукт.
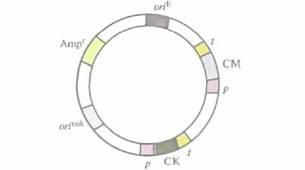
Эукариотические экспрессируюшие векторы имеют такую же структуру, что и их прокариотические аналоги (рис. 7.1), и должны содержать:
* эукариотический селективный маркер * эукариотический промотор
* |
соответствующие эукариотические сайты терминации транскрипции и трансляции |
* |
сигнал полиаденилирования мРНК. |
136 |
ГЛАВА 7 |
Рис. 7.1. Обобщенная структура эукариотического экспрессирующего вектора. Его основные элементы: эукариотический транскриптон с промотором (p), сайтом клонирования (СК) и сигналами терминации и полиаденилирования (t); эукариотический селективный маркер (СМ); сайт инициации репликации, функционирующий в клетках эукариот (orieuk); сайт инициации репликации, функционирующий в E. coli (oriЕ); селективный маркер E. coli (Аmрг).
Если вектор представляет собой плазмиду, реплицирующуюся независимо от хромосомы, то он должен содержать сайт инициации репликации, функционирующий в хозяйской клетке. Если же вектор предназначен для встраивания в хозяйскую хромосомную ДНК, то для обеспечения рекомбинации он должен нести последовательность, комплементарную определенному участку хромосомной ДНК хозяина (хромосомный сайт интеграции). Поскольку технически многие операции с реком-бинантными ДНК сложнее проводить в клетках эукариот, чем прокариот, большинство эукариотических векторов сконструированы как челночные. Другими словами, эти векторы несут два типа сайтов инициации трансляции и два типа селективных маркерных генов, одни из которых функционируют в Escherichia coli, a другие — в эукариотических хозяйских клетках. Такие векторные системы экспрессии разработаны для дрожжей, насекомых и клеток млекопитающих.
Введение ДНК в бактериальные и дрожжевые клетки называется трансформацией. В микробиологии этот термин используется для описания наследственных изменений в результате внедрения (приобретения) экзогенной (чужеродной) ДНК, А применительно к животным клеткам трансформация обозначает изменение характера их роста в культуре, обусловленное превращением нормальных клеток в раковые. Чтобы избежать путаницы в терминологии, для обозначения наследственных изменений в животных клетках после введения в них экзогенной ДНК был выбран термин трансфекция.
Для трансформации дрожжей обычно используют три способа. В первом случае экзогенную ДНК добавляют к клеткам дрожжей, клеточные стенки которых удалены химически или энзиматически (протопласты) ( 1 ). В других случаях клетки перед добавлением чужеродной ДНК обрабатывают ацетатом лития (2) или подвергают электропорации (3). Трансфекцию культур животных клеток осуществляют инкубацией клеток с ДНК, осажденной фосфатом кальция или ДЕАЕ-декстраном (1), либо электропорацией в присутствии очищенной трансфи-цирующей ДНК (2). Как уже упоминалось в гл. 4, электропорация заключается в воздействии на клетки коротких мощных импульсов электрического тока, вследствие чего в наружной мембране или клеточной стенке образуются временные поры, через которые в клетку может проникнуть ДНК. В некоторых эукариотических системах для доставки ДНК в реципиент-ные клетки используют вирусы.
Системы экспрессии Saccharomyces cerevisiae
Для экспрессии клонированных эукариотических генов интенсивно используют обычные дрожжи Saccharomyces cerevisiae. Тому есть несколько причин. Во-первых, это одноклеточный организм, генетика и физиология которого детально изучены и который можно выращивать как в небольших лабораторных колбах, так и в промышленных биорсак горах. Во-вторых, выделены и охарактеризованы несколько сильных промоторов этих дрожжей, а для систем эндогенных дрожжевых экспрессирующих векторов могут использоваться природные, так называемые 2 мкм-плазмиды. В-третьих, в клетках S. cerevisiae осуществляется большое число посттрансляционных модификаций. В-четвертых, лишь очень немногие из собственных дрожжевых белков секретируются в среду; таким образом, если гетерологичный белок секретируется

Получение рекомбинантных белков с помощью эукаристических систем |
137 |
клеткой, то его очистка не составит большого труда. В-пятых, поскольку дрожжи уже многие годы используют в хлебопечении и пивоварении, Департамент по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США) включил S. cerevisiae в список «организмов, признаных безопасными» (GRAS, generally recognized as safe). Таким образом, использование этих организмов для получения белков, применяемых в медицине, не требует дополнительных экспериментов, необходимых при работе с неразрешенными к применению микроорганизмами. Некоторые белки, синтезированные в S. cerevisiae, уже применяются в качестве вакцин и фармацевтических препаратов, а также для диагностики (рис. 7.2).
Рис. 7.2. Рекомбинантные белки, синтезируемые в системах экспрессии S. cerevisiae. HIV-I — вирус иммунодефицита человека 1 типа.
Векторы для S. cerevisiae
Существует три типа экспрессирующих векторов для S. cerevisiae. 1) эписомные, или плазмидные векторы; 2) интегрирующие векторы; 3) искусственные дрожжевые хромосомы (YAC). Плазмидные векторы уже широко использовались для получения как секретируемых, так и несекретируемых гетерологичных белков. Однако системы экспрессии, основанные на использовании плазмид, зачастую оказываются нестабильными при выращивании клеток в больших объемах (> 10 л). Стратегия с использованием векторов второго типа пока не получила широкого распространения, несмотря на то что в результате интеграции экспрессирующего вектора или транскриптона в хромосомную ДНК получается стабильный рекомбинантный организм. Причиной этого служит то, что число копий клонированного гена ограничивается одной на хромосому, иными словами, конечный выход белка невысок. Можно было бы использовать тандемные последовательности генов, но они часто оказываются нестабильными. Поэтому исследователи остановились на плазмидных векторах с одним клонированным геном, но попытались изменить условия роста, с тем чтобы повысить стабильность плазмид.
Искусственные дрожжевые хромосомы (YAC) предназначены для клонирования больших фрагментов ДНК (100 т. п. н.), которые затем поддерживаются в дрожжевой клетке как отдельные хромосомы. YAC-система чрезвычайно стабильна. С ее помощью проводили физическое картирование геномной ДНК человека и анализ больших транс-криптонов, создавали геномные библиотеки, содержащие ДНК индивидуальных хромосом человека. YАС-вектор напоминает хромосому, поскольку он содержит последовательность, функционирующую как сайт инициации репликации ДНК (автономно реплицирующуюся последовательность), сегмент центромерной области дрожжевой хромосомы и последовательности, образующиеся на обоих концах при линеаризации ДНК и действующие как теломеры, обеспечивающие стабильность хромосомы (рис. 7.3). При встраивании чужеродной ДНК в YAC может происходить нарушение рамки считывания маркерного дрожжевого гена. В результате продукт этого гена не образуется, и при выращивании клеток на специальной среде можно наблюдать цветную реакцию. Кроме того, некоторые YACвекторы несут селективный маркер, независимый от сайта клонирования. Несмотря на все преимущества, YAC пока не использовались для промышленного синтеза гетерологичных белков.
Прямая экспрессия в S. cerevisiae
Термин «прямая экспрессия» применяется для описания векторных систем, при использовании которых синтезированные белки аккумули-

138 |
ГЛАВА 7 |
Рнс. 7.3. YAC-
система клонирования.
YAC-плазмида (pYAC)
содержит селективный маркерный ген E. coli (Ampr), сайт инициации репликации, функционирующий в E. coli (oriE); сегмент дрожжевой ДНК, включающий участки
URA3, CEN, TRP1 и
ARS (CEN -
последовательность, выполняюшая центромерную функцию, ARS
дрожжевая автономно реплицирующаяся последовательность, эквивалентная дрожжевому сайту инициации репликации, VRA3 — один из генов биосинтеза урацила,
TRP1
- один из генов биосинтеза
триптофана). Т — это теломерные области дрожжевой хромосомы, Sinai — сайт, по которому осуществляется клонирование. pYAC сначала обрабатывают SmaI, ВатHI и щелочной фосфатазой, а затем сшивают с фрагментом ДНК длиной 100т. п. н. Конечная генетическая конструкция содержит клонированную ДНК и может стабильно поддерживаться в дрожжевых клетках Ura-
Trp-
руются в цитоплазме хозяйской клетки. Несколькими группами исследователей были разработаны различные экспрессирующие дрожжевые векторы, но все они имеют сходные основные черты. Мы рассмотрим процесс экспрессии чужеродного гена в S. cerevisiae на примере синтеза фермента супероксиддисмутазы человека.
Супероксид-анион — это побочный продукт утилизации кислорода аэробными организмами. У человека он участвует в стимуляции иммунного ответа фагоцитов и направлении лейкоцитов к месту инфекции. Однако избыток данного соединения и его производных может вызывать повреждение клеток. В минимизации потенциального цитотоксического воздействия таких веществ и принимает участие цитоплазматический фермент Cu/Zn-супероксиддисмутаза (Cu/Zn-SOD); он катализирует связывание супероксиданиона и иона водорода с образованием пероксида водорода, который в свою очередь служит субстратом для каталазы или пероксидазы. Супероксид-анион образуется также при повторной перфузии органа, кровоснабжение которого было прекращено перед хирургическим вмешательством. Чтобы избежать повреждения клеток супероксид-анионом, исследователи предложили перед повторной перфузией вводить в орган Cu/Zn-SOD. Cu/7nSOD может использоваться также для лечения таких воспалительных заболеваний, как остеоартрит, ревматоидный артрит, склеродермия и болезнь Бехтерева. При этом в

Получение рекомбинантных белков с помощью эукариотических систем |
139 |
обоих случаях лучше использовать белок, аутентичный Cu/Zn-SOD человека, для того чтобы избежать любых нежелательных иммунных реакций, которые могут возникнуть при введении фермента от других видов.
Первоначально кДНК Cu/Zn-SOD человека была клонирована в системе экспрессии Е. coll. Но в этом случае от молекулы Cu/Zn-SOD только отщеплялся инициаторный N- концевой метионин — так, как это происходит со всеми белками, синтезируемыми в Е. coït, a следующая аминокислота (аланин) не ацетилировалась, как в клетках человека. Поэтому для получения аутентичного фермента кДНК Cu/Zn-SOD человека была встроена в дрожжевой эписомный вектор. Дрожжевые клетки не способны эффективно вырезать интроны, поэтому для кодирования специфичных генных продуктов необходимо использовать соответствующие кДНК или химически синтезированные последовательности. Дрожжевой вектор с кДНК Cu/Zn-SOD человека (рис. 7.4) содержал: 1) дрожжевой ген биосинтеза лейцина (LEU2); 2) сегмент 2мкм-плазмиды с сигналом инициации репликации ДНК дрожжей, что обеспечивало репликацию плазмиды в дрожжевых клетках; 3) селективный маркер — Е. соli-ген устойчивости к ампициллину (Ampr) и сайт инициации репликации, активный в Е. œli, что позволяет осуществлять стандартные генноинженерные манипуляции, необходимые для создания плазмиды, в клетках Е. coli; 4) кДНК Cu/Zn-SOD человека, встроенную между промотором дрожжевого гена глицеральдегидфосфатдегидрогеназы (GAPDp) и последовательностью, содержащей сигналы терминации транскрипции и полиаденилирования мРНК того же гена (GAPDt).
Этим вектором трансформировали штамм дрожжей, не способный к синтезу лейцина (LEU2~), и высевали их на среду без лейцина. В этих условиях могут расти только клетки с функционирующим LEU2-геном, находящимся в векторе. GAPD-промотор не регулируется, транскрипция с него происходит непрерывно. Поэтому кДНК Cu/Zn-SOD человека транскрибируется в течение всего периода роста (конститутивно). В этом эксперименте в дрожжевых клетках накапливались большие количества Cu/Zn-SOD, в котором, подобно нативному
Рис. 7.4. Экспрессирующий вектор S. cerevisiae. Между промотором {GAPDp} и сигналом терминации-полиаденилирования (GAPDt) гена глицеральдегидфосфатдегидрогеназы S. cerevisiae встроена кДНК Cu/Zn-SOD человека. Ген LEU2, встроенный в середину дрожжевой 2мкм-плазмиды, кодирует один из ферментов биосинтеза лейцина. Ген устойчивости к ампициллину (Ampr) и сайт инициации репликации Е. coli (oriE) переклонированы из плазмиды pBR322.
белку из клеток человека, аминогруппа N-концевого остатка аланина была ацетилирована.
Секреция гетерологичных белков, синтезируемых S. cerevisiae
В дрожжевых клетках гликозилируются только секретируемые белки, поэтому для получения рекомбинантных белков, которые для перехода в активную форму должны подвергнуться N-или О-гликозилированию, необходимо использовать системы секреции. Для этого перед кДНК, которая кодирует интересующий исследователи белок, нужно поместить так называемый пре-про-α-фактор - лидерную (сигнальную) последовательность гена а1 фактора спаривания дрожжей. Синтезируемый рекомбинантный белок сможет в этом случае эффективно секретироваться дрожжами.
Во время транспорта белка в нем образуются дисульфидные связи, происходят протеолитическое расщепление и другие посттрансляционные модификации, так что в некоторых случаях в среду попадает уже активный белок. Лидерный пептид обеспечивает проникновение белка через цитоплазматическую мембрану и секрецию, при этом сам он отщепляется дрожжевой эндопротеиназой, узнающей дипептид Lys-Arg. Поэ-
140 |
ГЛАВА 7 |
тому кодоны Lys и Arg должны располагаться непосредственно перед кДНК, так чтобы после отщепления сигнального пептида синтезированный белок содержал на N-конце нужный аминокислотный остаток.
Используя эписомный экспрессирующии вектор с сигнальной последовательностью α- фактора, удалось получить правильным образом модифицированный, биологически активный белок гирудин: он синтезировался и секретировался штаммом S. cerevisiae. Ген гирудина был выделен из клеток беспозвоночного — пиявки Hirudo medicinalis. Этот белок является мощным антикоагулянтом и не вызывает нежелательных иммунологических реакций у человека. Его можно получать в активной форме в больших количествах, что упростило исследование его способности разрушать сгустки венозной крови и устранять другие проявления тромбоза. К сожалению, клинические исследования 12 142 больных, у 4131 из которых имелись сердечнососудистые заболевания, выявили лишь незначительные преимущества рекомбинантного гирудина перед гепарином. Эти преимущества не могут компенсировать высокую стоимость рекомбинантного гирудина, так что его широкое использование в клинике представляется маловероятным.
Чтобы повысить эффективность секреции рекомбинантных белков штаммами S. cerevisiae, были предприняты дальнейшие исследования, Так, попытались выяснить, способствует ли повышению выхода рекомбинантного белка суперэкспрессия такого природного фермента системы секреции, как дисульфидизомераза, которая обеспечивает правильную укладку белковой молекулы в процессе секреции. Для этого в хромосому 5. cerevisiae встроили ген дрожжевой дисульфидизомеразы, находящийся под контролем конститутивного промотора глицеральдегидфосфатдегидрогеназы и сигнала терминации транскрипции. Уровень синтеза дисульфидизомеразы модифицированным штаммом был в 16 раз выше по сравнению со штаммом дикого типа. Далее в штамм — суперпродуцент дисульфидизомеразы ввели внехромосомный экспрессирующий вектор, несущий ген фактора роста тромбоцитов В человека. Количество секретируемого этим штаммом тромбоцитарного фактора роста В человека превысило в 10 раз количество фактора, секретируемого штаммом с нормальным уровнем синтеза дисульфидизомеразы. Суперпродукция дисульфидизомеразы повышает секрецию белков только с дисульфидными связями. Изменение других белков дрожжевой системы секреции может повысить количество секретируемых рекомбинантных белков с другими требованиями к укладке белковой молекулы.
Другие дрожжевые системы экспрессии
С помощью систем экспрессии S. cerevisiae удалось получить много разных рекомбинантных белков, К сожалению, в большинстве случаев уровень их экспрессии был довольно низким, Кроме того, обнаружились и другие проблемы.
•При увеличении масштабов системы часто происходит потеря плазмид, даже если используются индуцируемые промоторы.
•Гетерологичный белок зачастую оказывается гипергликозилированным и содержит более 100 остатков маннозы в каждой боковой олигосахаридной цепи, в то время как в нативных белках их содержится только от 8 до 13 на цепь. Наличие лишних маннозных остатков может изменять биологическую активность продукта или его иммуногенность.
•Во многих экспериментах белки, которые должны были секретироваться, на самом деле концентрировались в периплазматическом пространстве, что еще более осложняло их очистку.
Все это заставило ученых исследовать возможность получения гетерологичных белков с помощью других видов дрожжей и с использованием эукариотических систем, В частности, изучались соответствующие векторы — системы экспрессии, содержащие видоспецифичные регуляторные последовательности транскрипции и трансляции, возможность трансформации этих видов и получения высокого выхода белков и возможность крупномасштабного культивирования организма-хозяина, В качестве альтернативы S. cerevisiae можно использовать Kluyveromyces lactis, дрожжи, которые применяют для промышленного производства лактозы
