
- •1. Аллергические пробы in vivo и in vitro, их сущность, применение.
- •2. Анатоксины. Получение, применение. Антитоксический иммунитет
- •3. Антибактериальные препараты. Классификация. Механизмы антибактериального действия. Механизмы возникновения и распространения устойчивости.
- •4. Антимикробные препараты. История создания. Классификация. Способы получения.
- •5. Бактериологический метод диагностики. Требования к выращиванию бактерий в искусственных условиях.
- •6. Бактериоскопический метод диагностики, его задачи и возможности. Методы микроскопии и их применение.
- •7. Бактериофаги. Взаимодействие фага с бактериальной клеткой. Умеренные и вирулентные бактериофаги. Лизогения.
- •8. Бактериофаги. Получение, титрование. Практическое применение в диагностике, профилактике и лечение
- •9. Вакцины Вакцинопрофилактика и вакцинотерапия
- •10. Внутривидовое типирование бактерий. Методы. Использование в практике
- •11. Врожденный иммунитет. Фагоцитоз. Показатели фагоцитоза
- •12. Геном бактерий. Хромосома, нехромосомные элементы генома. Подвижные элементы генома и их роль в изменчивости бактерий
- •Характеристика генетического аппарата бактерий Организация генома.
- •Плазмиды могут интегрировать в бактериальную хромосому, тогда их называют эписомами. Репликация плазмид начинается со связывания с итероном (место старта репликации) инициирующего репликацию белка.
- •Плазмиды классифицируют на несколько групп в зависимости от:
- •Ø 1 Размера: большие, средние, малые (космиды).
- •Как правило, являются конъюгативными. Состоят из двух участков:
- •Плазмиды участвуют в генетических перестройках, обеспечивают горизонтальный перенос генов, используют в качестве векторов в генной инженерии.
- •Различают два класса подвижных элементов: транспозоны и ретротранспозоны. Такая классификация основана на механизмах, с помощью которых перемещаются подвижные элементы.
- •13. Гиперчувствительность замедленного типа. Кожно-аллергические пробы и их использование в диагностике некоторых инфекционных заболеваний.
- •14 Грибы. Строение клетки. Классификация грибов по морфологии таллома.
- •15. Действие физических и химических факторов на микроорганизмы. Использование в практике.
- •16. Дисбиозы. Препараты для восстановления микробиоты
- •17 Иммунодиагностика (серодиагностика) инфекционных заболеваний. Принципы и диагностические критерии.
- •18. Иммунопрофилактика, иммунотерапия. Осложнения: анафилактический шок, сывороточная болезнь. Их предупреждение
- •19. Иммуноферментный анализ, иммуноблоттинг. Принципы методов, используемые реагенты и оборудование, применение.
- •20. История микробиологии. Этапы развития. Современные задачи.
- •21. Культивирование бактерий in vitro. Требования к условиям культивирования. Питательные среды, их классификация. Требования, предъявляемые к питательным средам
- •22. Методы культивирования вирусов. Вирусологический метод, основные этапы.
- •24. Методы определения чувствительности бактерий к антибиотикам. МПК (МИК) и МБК. Критерии определения бактериальных изолятов как чувствительные, устойчивые, умеренно чувствительные
- •Достоинства метода
- •Недостатки метода
- •Мудл:
- •Метод пограничных значений (break-point method)
- •Достоинства метода
- •Недостатки метода
- •Метод разведений в жидкой среде
- •Достоинства метода
- •Недостатки
- •Недостатки метода
- •25. Механизм фагоцитоза. Выживание микобактерий туберкулеза в фагоците. Туберкуломы.
- •Общая информация по учебнику Зверева.
- •Фагоцитоз – процесс поглощения клеткой частиц или крупных макромолекулярных комплексов, складывающийся из нескольких этапов:
- •*Фагоциты – это макрофаги (моноциты и тканевые макрофаги) и микрофаги (нейтрофилы).
- •Касаемо туберкулеза и фагоцитоза:
- •Фагосома→фаголизосома→ в результате процессирования МБТ в фаголизосоме фрагменты микобактерии презентуются на поверхность макрофага. Исходы попадания МБТ в фаголизосому:
- •26 . Механизмы возникновения и распространения устойчивости бактерий к антибактериальным препаратам. Природная и приобретенная устойчивость к антибактериальным препаратам.
- •Различают природную (видовую, первичную, естественную) и приобретенную устойчивость.
- •Видовая устойчивость
- •является постоянным видовым признаком
- •Детерминируется хромосомой
- •Отсутствие мишени для АМП или недоступность мишени из-за инзкой проницаемости ЦПМ или ферментативной инактивации АПМ
- •свойство отдельных штаммов бактерий сохранять жизнеспособность при концентрациях антибиотиков, которые подавляют основную часть микробной популяции
- •эффективность препарата не всегда снижается
- •Генетические механизмы АБ-резистентности
- •Мутации
- •Рекомбинации (перераспределение генов с созданием новых комбинаций)
- •Репликативные единицы
- •Нерепликативные едицины
- •o Генные кассеты – автономные, нереплицирующиеся, замкнутые в кольцо элементы.
- •o Интегрон – система захвата и экспрессии генов, например, в генной кассете
- •Биохимические механизмы развития устойчивости к химиотерапевтическим препаратам.
- •1. Выработка ферментов, инактивирующих АБ
- •2. Снижение проницаемости ЦМП бактерии для АБ
- •3. Структурные изменения мишени
- •4. Альтернативные пути метаболизма
- •5. Эффлюкс – актиный выброс АБ из клетки
- •Диагностика резистентности:
- •o Диско-диффузионный метод
- •o Е-тест
- •o Метод серийных разведений
- •27. Механизмы обмена генетической информацией у бактерий
- •28. Механизмы формирования и распространения устойчивости к антибактериальным препаратам бактерий – возбудителей инфекционных болезней
- •29. Микробиота желудочно-кишечного тракта человека
- •30. Микробиота урогенитального тракта человека
- •31. Моноклональные антитела. Получение. Использование
- •32. Морфология микроорганизмов. Морфологические группы бактерий
- •33. Нагрузочные серологические реакции. Реакции непрямой гемагглютинации. Компоненты. Применение
- •34. Наследственность и изменчивость у бактерий. Механизмы обеспечения и передачи дочерним клеткам генетической информации. Механизмы изменчивости
- •35. Органеллы бактериальной клетки. Функциональное назначение органелл
- •36. Особенности биологии вирусов. Принципы классификации вирусов
- •37. Особенности противовирусного иммунитета
- •38. Отличительные черты риккетсий. Методы культивирования. Риккетсиозы, общая характеристика.
- •39. Патогенность и вирулентность бактерий. Факторы вирулентности. Генетические основы распространения факторов вирулентности среди бактерий.
- •40. Понятие о морфологических свойствах микроорганизмов. Морфологические группы бактерий.
- •41.Понятие об инфекции. 3 участника инфекционного процесса. 3 звена эпидемической цепи
- •42. Предмет и задачи медицинской микробиологии и иммунологии. Вклад российских ученых в развитии микробиологии и иммунологии.
- •44. Принципы классификации инфекционных заболеваний.
- •45. Противогрибковые препараты.
- •46. Различия в строении микроорганизмов прокариот и эукариот
- •47. Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
- •48. Реакция иммунофлюоресценции. Механизм, типы, компоненты, применение для индикации антигенов и иммунодиагностики
- •49. Реакция нейтрализации токсина антитоксином. Механизм. Способы постановки, применение
- •50. Реакция преципитации. Механизм, компоненты. Способы постановки. Применение.
- •Компоненты: АГ (преципитоген), АТ (известная преципитирующая сыворотка), электролит (физ.раствор).
- •Способы постановки (с применением)
- •51.Роль врожденного и приобретенного иммунитета в развитии инфекции
- •52. Рост и размножение бактерий в искусственных условиях. Фазы размножения
- •53. Спирохеты. Характеристика. Особенности строения. Роль в патологии человека
- •54. Стерилизация, способы, аппаратура
- •55. Строение бактериального генома. Хромосомные и внехромосомные элементы. Подвижные элементы. Умеренные бактериофаги и их роль в изменчивости генома
- •56. Структура и функции клеточной стенки бактерий. Особенности строения клеточной стенки грамположительных и грамотрицательных бактерий.
- •57. Тинкториальные свойства бактерий. Цели и методы окраски
- •Источник: Mikrobiologia_Zverev, khoroshie_lektsii_po_mikre
- •58. Типы и механизмы питания бактерий. Классификация бактерий по используемым источникам углерода и энергии. Прототрофы и ауксотрофы
- •59. Токсины бактерий, их природа и свойства. Получение и применение экзо- и эндотоксинов.
- •60. Транспорт веществ в бактериальную клетку. Экскреция высокомолекулярных соединений из бактериальной клетки
- •61. Ферменты бактерий. Роль ферментов в патогенности бактерий Идентификация бактерий по ферментативной активности
- •62. Чистые культуры микроорганизмов. Принципы и методы выделения
- •63. Энергетический метаболизм у бактерий. Типы энергетического метаболизма. Типы дыхания.
- •64. Этапы взаимодействия вирусов с чувствительными клетками и факторы, способные их нарушить. Формы вирусной инфекции.
- •1. Аденовирусная инфекция. Характеристика возбудителей. Лабораторная диагностика.
- •2. Актиномицеты. Актиномикозы, диагностика и принципы лечения
- •Морфология. Род Actynomyces Ветвящиеся бактерии.
- •Ветвящиеся грамположительные некислотоустойчивые неспорообразующие бактерии. Они полиморфны и могут быть палочковидной неправильной формы, прямыми или слегка изогнутыми с утолщениями на концах.
- •В мазках располагаются одиночно, парами Y-, V-образно или в виде палисада. Часто образуют нити длиной 10–50 мкм и хорошо развитый истинный несептированный мицелий (у одних видов — длинный редко ветвящийся, у других — короткий и сильноветвящийся).
- •Не содержат в клеточной стенке хитина, стенка имеет строение грамположительных бактерий. Мицелий имеет вид тонких прямых палочек, образуют нити.
- •Все морфологические формы способны к истинному ветвлению, особенно на тиогликолевой полужидкой среде. По Граму окрашиваются плохо, часто образуют зернистые либо четкообразные формы; некислотоустойчивы.
- •Типовой вид — Actinomyces bovis.
- •Антигенная структура. В ИФА выделяют 6 cepoгpyпп: A, B, C, D, E и F
- •Патогенез. Вызывают оппортунистическую инфекцию. Наиболее частым возбудителем которой является A. israelii.
- •Клиника. Актиномикоз.
- •Актиномицеты вызывают актиномикоз — хроническое гнойно-воспалительное заболевание с образованием гранулем.
- •Для диагностики используют бактериоскопический, бактериологический, серологический и аллергологический методы.
- •По обнаружению в исследуемом материале друз актиномицетов, имеющих вид мелких желтоватых или серовато-белых зернышек с зеленоватым отливом. По Граму споры окрашиваются в темно-фиолетовый, мицелий — в фиолетовый, а друзы — в розовый цвет.
- •Лечение. Лучшие результаты дает сочетание этиотропной терапии (антибиотики) и иммунотерапии актинолизатом. Применение пенициллина, тетрациклина, эритромицина, клиндамицина.
- •Профилактика. Специфическая профилактика - нет. Неспецифическая - повышение иммунного статуса.
- •Источники: Mkb_-_teoriaA.pdf, Уч. Микробиология _Зверев
- •3. Аспергиллез. Морфология возбудителей. Методы и критерии диагностики.
- •4. Вирусы герпеса. Классификация, значение в патологии человека. Профилактика
- •5. Вирусы ЭКХО и Коксаки, вызываемые ими заболевания. Лабораторная диагностика энтеровирусных инфекций.
- •6. ВИЧ-инфекция. Характеристика возбудителей. Лабораторная диагностика. Профилактика.
- •7. Возбудители анаэробной газовой инфекции. Характеристика. Лабораторная диагностика. Специфическая и неспецифическая профилактика. Принципы лечения
- •8. Возбудители бруцеллеза. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •9.Возбудители брюшного тифа и паратифов. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •10. Возбудители возвратных тифов. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения
- •11. Возбудители гнойно-септических инфекций. Принципы лабораторной диагностики.
- •12.Возбудители гриппа. Характеристика. Лабораторная диагностика. Специфическая профилактика.
- •13. Возбудители кишечного иерсиниоза и псевдотуберкулеза. Характеристика. Лабораторная диагностика. Профилактика
- •14. Возбудители коклюша и паракоклюша. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •15. Возбудители микобактериозов. Морфология, особенности строения микобактериальной клетки). Распространенность. Лабораторная диагностика
- •16. Возбудители микозов кожи и ее придатков
- •17. Возбудители ОРВИ. Общая характеристика. Принципы диагностики, профилактики и лечения.
- •18. Возбудители пищевых токсикоинфекций. Лабораторная диагностик.
- •19. Возбудители сальмонеллезных гастроэнтеритов. Характеристика возбудителей. Лабораторная диагностика. Профилактика. Принципы лечения
- •20. Возбудители пищевых токсикоинфекций. Лабораторная диагностика.
- •21. Возбудители туберкулеза. Классификация. Особенности микобактериальной клетки. Распространенность.
- •22. Возбудители хламидиозов. Характеристика. Лабораторная диагностика. Принципы лечения
- •23. Возбудители шигеллезов. Характеристика. Лабораторная диагностика. Специфическая профилактика и принципы лечения
- •24. Возбудители эшерихиозов. Характеристика. Лабораторная диагностика эшерихиозов
- •25. Возбудитель бешенства. Характеристика. Патогенез. Специфическая профилактика.
- •26. Возбудитель ботулизма. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •27. Возбудитель дифтерии. Характеристика. Лабораторная диагностика. Выявление антитоксического иммунитета. Специфическая профилактика. Принципы лечения
- •Возбудитель дифтерии Corynebacterium diphtheria (только токсигенные штаммы).
- •Характеризуется фибринозным воспалением в месте входных ворот и интоксикацией организма с преимущественным поражением сердца, почек, нервной системы.
- •Характеристика:
- •Источник инфекции – человек, больной или носитель.
- •Таксономия возбудителя дифтерия: порядок (Actinomycetales), семейство (Corynebacteriaceae), род (Corynebacterium), вид (Corynebacterium diphtheria).
- •Дополнительная характеристика биовара: способность к продукции дифтерийного экзотоксина (гистотоксина).
- •Морфология:
- •В мазках располагаются римскими V, X.
- •Неподвижные
- •Имеют микрокапсулу
- •Споры не образуют
- •Физиология:
- •Тип питания: гетеротроф
- •Тип дыхания: факультативный анаэроб
- •Требовательность к пит среде: требователен, т.к. растёт только на специальных средах
- •Характер роста на плотной среде: На среде Клауберга -II (кровь+теллурит калия) 3 типа колоний: крупные серые неровные, напоминающие маргаритки; мелкие чёрные выпуклые и ровные; колонии смешанного вида
- •Характер на жидкой среде: Не растёт. засевают в полужидкую среду обогащения на 16ч, но потом пересаживают
- •Ферменты:
- •Нелиполитические, как и большинство в семействе. Большинство штаммов не ферментирует крахмал, декстрин и гликоген.
- •Факторы адгезии и защиты от фагоцитоза (микрокапсула, пили)
- •Экзотоксин (гистотоксин: субъединица А – это токсичный полипептид (продукция определяется бактериальным геном), субъединица В – это транспортный полипептид (продукция определяется геном умеренного бактериофага))
- •Антигенные свойства:
- •Наличие антигенных разновидностей: На основании культуральных свойств выделяют 3 биовара: gravis, mitis, intermedius
- •O-ag – группоспецифический полисахаридный антиген клеточной стенки, прекрасно реагирующий с антигенами микобактерий и нокардий
- •K-ag – полисахаридный антиген микрокапсулы – 58 сероваров.
- •* Corynebacterium pseudodiphtheria “ближайший родственник” Corynebacterium diphtheria. входит в состав нормальной микрофлоры человека. Отличается только тем, что не продуцирует экзотоксин.
- •Устойчивость к факторам внешней среды:
- •Устойчивость возбудителя во внешней среде: средняя устойчивость. весьма чувствителен к действию многих антибиотиков, но устойчив к высушиванию и низким температурам.
- •- Чувствительны к стандартным дезинфицирующим процедурам
- •Биохимические свойства:
- •Расщепляют цистин с образованием H2S
- •Продуцирует экзотоксин
- •Каталаза (+)
- •Не расщепляет мочевину
- •Расщепляет глюкозу, мальтозу и не расщепляет сахарозу
- •Восстанавливает нитраты в нитриты
- •Расщепление крахмала различается у разных биоваров
- •Эпидемология:
- •Источник: больной человек или носитель.
- •Механизм передачи: основной - аспирационный. Пути передачи: воздушно-капельный, но возможен и контактно-бытовой (бельё, игрушки).
- •Патогенез:
- •Входные ворота – слизистые носа, зева, дых.путей. По локализации процесса принято различать Дифтерия зева, носа, гортани, трахеи и бронхов, глаз, наружных половых органов, кожи и пр-
- •Дифтерия зева — наиболее частая форма; она наблюдается в 85—90% и более всех случаев Дифтерия. Различают три основные формы: локализованную, распространённую и токсическую.
- •При токсической Дифтерия обнаруживаются изменения в надпочечниках: в мозговом и корковом веществе отмечаются резкая гиперемия, кровоизлияния и деструктивные изменения клеток вплоть до полного некроза и распада.
- •Наиболее глубокие дегенеративные изменения отмечаются в миокарде — паренхиматозное перерождение мышечных волокон вплоть до полного миолиза, глыбчатый распад (рисунок 3) или диффузное дегенеративное ожирение.
- •- др. формы: дифтерия носа, глаз, раны, наружных половых органов у девочек
- •Иммунитет – Приобретенный иммунитет – стойкий напряженный антитоксический
- •*Определение токсигенности C. diphtheriae:
- •биологическая проба на животных – при внутрикожном введение морским свинкам культуры дифтерийной палочки – некроз в месте введения, последующая гибель животного;
- •заражение куриных эмбрионов (наблюдается гибель под действием токсина);
- •внесение в культуру клеток (оказывает ЦПД);
- •использование ДНК-зондов для обнаружения tox-оперона в геноме;
- •РДП по Илеку и Оухтерлони – основывается на способности токсина и антитоксина диффундировать в агар и образовывать по ходу диффузии усы, полосы, стрелы преципитации
- •Серологический метод – сыворотка (РПГА)
- •Молекулярно-биологический метод – ПЦР (обнаружение tox-гена)
- •Источник: лекции 21 года и Коваленко
- •28. Возбудитель кампилобактериоза. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения.
- •29. Возбудитель клещевого энцефалита. Характеристика
- •30. Возбудитель кори. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •Эпидемиология.
- •Источник - атропонозная инфекция - только больной человек, состояние вирусоносительства при кори не установлено. Вспышки обычно в конце зимы и весной.
- •Путь: аэрогенно – воздушно-капельно. Индекс контагиозности 100%.
- •Профилактика. Для профилактики кори используют вакцины:
- •31. Возбудитель краснухи. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •32. Возбудитель Ку-лихорадки. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения
- •33. Возбудитель паротита. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •34. Возбудитель сибирской язвы. Характеристика. Лабораторная диагностика. Специфическая профилактика Принципы лечения
- •35. Возбудитель сифилиса. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения.
- •36. Возбудитель туляремии. Характеристика. Лабораторная диагностика. Специфическая профилактика. Принципы лечения.
- •Таксономия.
- •Морфология.
- •Очень мелкие (0,1*1.5мкм) полиморфные(кокки, овоиды, зерна, неправильной формы) Гр (-) палочки, неподвижные, не образующие спор, могут образовывать капсулу.
- •Культуральные свойства.
- •При культивировании на искусственных средах происходит аттенуация бактерий и превращение их из вирулентной в авирулентную форму.
- •Биохимические свойства.
- •Антигенные свойства.
- •Факторы патогенности
- •Эпидемиология
- •Устойчивость в окружающей среде
- •В окружающей среде сохраняется долго при низких температурах, особенно в зерне и соломе. Бактерии нестойки к высокой температуре, УФ-лучам и чувствительны к большинству АБ.
- •Патогенез
- •Клиническая картина
- •Иммунитет
- •После перенесенной инфекции иммунитет сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя.
- •Бактериоскопическое исследование. Из исследуемого материала готовят мазки, окрашивают по Граму. В чистой культуре - мелкие кокки. В мазках из органов преобладают палочковидные формы. Спор не образуют, Гр (-).
- •Лечение
- •Применяют АБ аминогликозиды, макролиды и фторхинолоны. При затяжном тячении проводят комбинированную АБ-терапию и вакцинотерапию с применением убитой лечебной вакцины (курс 6-10 инъекций)
- •Профилактика
- •Специфическая профилактика - применяют живую туляремийную вакцину (из штамма №15). Иммунитет длительный (5-6 лет), проверяется с помощью пробы с тулярином.
- •Неспецифическая профилактика – направлена на борьбу с грызунами.
- •37.Возбудитель холеры. Характеристика. Лабораторная диагностика. Специфическая профилактика
- •38. Возбудитель чумы. Характеристика. Лабораторная диагностика. Специфическая профилактика Принципы лечения
- •39. Гонококки. Характеристика. Лабораторная диагностика. Профилактика. Принципы лечения
- •40. Классификация микозов по локализации инфекционного процесса
- •41. Криптококкоз. Возбудители. Лабораторная диагностика криптококкоза
- •42. Лекарственная устойчивость микобактерий туберкулеза. Эпидемиология. Механизмы действия основных противотуберкулезных препаратов и механизмы возникновения устойчивости к ним. Лабораторная диагностика
- •43. Микологический метод диагностики микозов. Методы идентификации дрожжей и нитчатых грибов.
- •44. Микоплазмы. Биологические свойства, особенности строения. Роль в патологии человека. Принципы диагностики и лечения
- •45. Микоплазмы. Биологические свойства, особенности строения. Роль в патологии человека. Принципы диагностики и лечения.
- •46. Общая характеристика рода Candida. Методы и критерии диагностики.
- •47. Патогенные и условно-патогенные грибы. Классификация грибов по группам патогенности.
- •49 Стафилококки.Характеристика. Лабораторнаядиагностика стафилококковых инфекций. Стафилококковое носительство
- •50. Стрептококки. Характеристика. Лабораторная диагностика стрептококковых инфекций.
- •51. Факторы риска развития микозов. Шесть основных групп больных микозами.
- •Наиболее значимые факторы:
- •Основные группы подверженные развитию микозов это:
- •Пульмонологические больные тяжелой формой астмы, ХОБЛ, туберкулезом, муковисцидозом
- •Нарушение биологических защитных барьеров при обширных травмах, ожогах, повреждениях слизистых
- •Женщины детородного возраста склонные к развитию кандидозных вагинитов в т.ч. рецидивирующих
- •Здоровые люди с очаговыми микозами, например поражения ногтей или волос, кожи.
- •Лечению подобные формы поддаются достаточно тяжело и имеют склонность к хронитизации.
- •52. Характеристика возбудителей гепатитов. Методы диагностики и профилактики.
- •Выделяют 10 возбудителей вирусных гепатитов: A, B, C, D, E, F, G, H, TTV и SEN, которые с учетом механизма передачи разделяются на 2 группы:
- •Вирусные гепатиты с энтеральным (фекально-оральным) механизмом передачи – A, E, F;
- •● Гепатит А (синонимы: инфекционный, эпидемический гепатит, болезнь Боткина) – острое инфекционное заболевание с фекально-оральным механизмом передачи, характеризующееся поражением печени.
- •Семейство – Picornaviridae
- •Род – Hepatovirus (Enterovirus)
- •Вид – HAV=Hepatitis A virus (тип 72)
- •Антигенная структура. У вируса гепатита А выделяют один антиген – HA-Ag – видоспецифический, связанный с капсидными белками.
- •Культивирование. Вирус гепатита А выращивают:
- •Репродукция: аналогична всем пикорнавирусам.
- •Резистентность.
- •HAV значительно устойчив во внешней среде. Годами сохраняется при низкой температуре (- 200С), при комнатной температуре (210С) – несколько недель, 600С – 12 часов, 1000С – 5 минут.
- •Вирус устойчив к кислотам, щелочам, не инактивируется эфиром. В растворе формалина погибает в
- •Эпидемиология.
- •Источник инфекции – больной человек.
- •Механизм передачи – фекально-оральный (пути – водный, алиментарный, контактно-бытовой).
- •Отмечается выраженная осенне-зимняя сезонность заболевания (пик – август-сентябрь).
- •Чаще болеют дети дошкольного и начального школьного периода в возрасте от 5 до 14 лет.
- •Патогенез и клинические особенности.
- •температуры тела до фебрильного уровня и катаральными симптомами) и диспепсическом (характеризуется ухудшением аппетита, тошнотой, иногда рвотой, горечью во рту, чувство тяжести в правом подреберье).
- •3. Вторичная репродукция вируса в гепатоцитах: HAV оказывает прямое
- •цитопатическое действие на гепатоциты, что приводит к их некрозу (синдром цитолиза) и
- •нарушению всех видов обмена (белкового, углеводного, жирового и пигментного), в особенности к нарушению биллирубинового обмена. Клинически – стадия разгара болезни, проявляющаяся потерей
- •4. Вторичная вирусемия и генерализация инфекции.
- •5. Иммуногенез и высвобождение организма от возбудителя с полным выздоровлением.
- •Осложнения возникают редко, хронические формы не развиваются.
- •Иммунитет.
- •У переболевших формируется постинфекционный иммунитет – гуморальный, стойкий, пожизненный.
- •Микробиологическая диагностика. Маркеры острой инфекции:
- •HAV-РНК в сыворотки крови;
- •HAV-Ag в фекалиях и в сыворотке крови;
- •анти-HAV-IgM в сыворотки крови;
- •Маркеры перенесенного гепатита:
- •анти-HAV-IgG в сыворотке крови.
- •Специфическая профилактика проводится по эпидпоказаниям.
- •Пассивная при контакте с больным – введении донорского γ-глобулина, который обеспечивает защиту в течении 3-4 месяцев;
- •гидроокиси алюминия.
- •Специфическое лечение не существует
- •Возбудителями парентеральных вирусных гепатитов является вирус гепатита В, а также вирусы гепатитов D, C, G.
- •Семейство – Hepadnoviridae (от лат. hepa – печень, от англ. dna – ДНК)
- •Вид – HBV (Hepatitis B virus)
- •Геном вируса гепатита В представлен двухнитевой кольцевой молекулой ДНК, причем одна нить – «плюс-цепь» на 30% короче другой – «минус-цепи». Тип симметрии нуклеокапсида – кубический.
- •Антигенная структура.
- •У вируса гепатита В выделяют четыре антигена:
- •Особенности репродукция вируса.
- •Репродукция вируса происходит в гепатоцитах. Сначала коротка цепь ДНК достраивается по длинной с помощью ДНК-полимеразы. Достроенные вирионы содержат полноценную ДНК, способную к репликации.
- •Культивирование.
- •Плохо культивируется в лабораторных условиях. Выращивают в:
- •Культуре клеток, полученных из ткани первичного рака печени (не оказывают ЦПД, малое накопление вирионов);
- •Восприимчивых животных (шимпанзе, гориллы, орангутанги);
- •В куриных эмбрионах не культивтруется.
- •Источник инфекции – больные люди острым и хроническим гепатитом В, носители (в мире насчитывается около 400 млн.).
- •Механизм передачи инфекции:
- •Парентеральный (пути – трансфузионный, артифициальный – через медицинские инструменты, половой, контактно-бытовой – через предметы личной гигиены – зубные щетки, расчески, ножницы).
- •Вертикальный (путь – трансплацентарный).
- •Очень низкая инфицирующая доза.
- •Группы риска: гематологические больные, наркоманы, гомосексуалисты, медицинские работники (хирурги, стоматологии).
- •Патогенез гепатита В сложен, до конца не изучен. В механизме развития патологического процесса выделяется несколько ведущих звеньев:
- •1. Внедрение возбудителя – входными воротами инфекции являются кровеносные сосуды. Вирус с кровью разносится по всему организму.
- •2. Фиксация вируса на гепатоцитах и проникновение внутрь клетки. Причем вирус не обладает прямым цитопатическим действием, поражение печени при гепатите В является иммунообусловленным.
- •5. Формирование иммунитета и выздоровление (при интеграции HBV в геном гепатоцитов они «ускользают» от иммунной системы, развивается хронический процесс или носительство).
- •Клинически выделяют следующие периоды:
- •3. Желтушный период – длительность до 21 дня: потеря аппетита, тошнота, рвота, боли в области правого подреберья, холурия, ахолия, желтушное окрашивание кожи и слизистых оболочек.
- •5. Исходы – выздоровление, вирусоносительство, развитие хронического гепатита, цирроза печени.
- •У переболевших вырабатывается постинфекционный иммунитет – в основном клеточный, слабонапряженный, непродолжительный.
- •Микробиологическая диагностика.
- •Наиболее значимые маркеры острого гепатита В:
- •ДНК вируса, ДНК-pol;
- •Маркеры перенесенного гепатита В:
- •Анти-HBcor-IgG
- •Маркеры хронического гепатита В:
- •Анти-HBe-IgG
- •Анти-HBV-роl
- •Маркер носительства: HBs-Ag
- •Специфическая профилактика.
- •Пассивная с целью экстренной профилактики – введении донорского HВ-иммуноглобулина (главное показание – иммунизация детей, рожденных от матерей-носителей HBs-Ag).
- •В России зарегистрировано и другие вакцины, в состав которых входит HВsAg: Энджерикс B (Бельгия), HB VAX (США) и другие.
- •Спецефическое лечение – не разработано. Этиотропная терапия на современном этапе заключается в применении рекомбинантных интерферонов (например: Виферон, Реаферон, Роферон А).
- •Семейство Flaviviridae
- •- в качестве внешней оболочки ВГD использует НВs-антиген внешней оболочки вируса гепатита В.
- •Эпидемиология:
- •Микробиологическая диагностика: осуществляется серологическим методом путем определения антител к ВГD методом ИФА. В биоптатах печени методом ПЦР можно обнаружить в гепатоцитах РНК вируса.
- •Лечение и профилактика. Используют препараты интерферона. Профилактика гепатита D учитывает все те мероприятия, которые используют для профилактики гепатита В. Вакцина против гепатита В защищает и от гепатита D.
- •● Вирус гепатита С (ВГС): относится к семейству Flaviviridae, pоду Hepacivirus.
- •Микробиологическая диагностика:
- •Материалом для исследования является кровь.
- •Используются ПЦР (подтверждением активного инфекционного процесса служит обнаружение в крови вирусной РНК) и серологический метод. Проводится ИФА методом парных сывороток.
- •Антитела к ВГС появляются через несколько недель (т.е. образуется серонегативное окно), при этом кровь потенциально инфекционна. Поэтому ПЦР — метод выбора для ранней диагностики гепатита С.
- •Лечение и профилактика: для лечения применяют интерферон и рибовирин.
- •Специфическая профилактика не разработана.
- •Для неспецифической профилактики используют те же мероприятия, что и при гепатите В.
- •Вирус гепатита G пока изучен слабо. Известно, что он имеет РНК-зависимую протеиназу, поверхностный (HGs) и сердцевинный (HGc) антигены.
- •ЗАДАЧА 1.
- •ЗАДАЧА 2
- •ЗАДАЧА 3.
- •ЗАДАЧА 4.
- •ЗАДАЧА 5.
- •ЗАДАЧА 6.
- •ЗАДАЧА 7.
- •ЗАДАЧА 8.
- •ЗАДАЧА 9.
- •ЗАДАЧА 10.
- •ЗАДАЧА 11.
- •ЗАДАЧА 12.
- •ЗАДАЧА 13.
- •ЗАДАЧА 14
- •ЗАДАЧА 15.
- •ЗАДАЧА 16
- •ЗАДАЧА 17.
- •ЗАДАЧА 18.
- •ЗАДАЧА 19
- •ЗАДАЧА 20.
- •ЗАДАЧА 21.
- •ЗАДАЧА 22. (эту задачу я еще уточню у преподавателя)
- •ЗАДАЧА 23.
- •ЗАДАЧА 24.
- •ЗАДАЧА 25.
- •ЗАДАЧА 26.
- •ЗАДАЧА 27
- •ЗАДАЧА 28.
- •ЗАДАЧА 29.
- •ЗАДАЧА 30.
- •ЗАДАЧА 31.
- •ЗАДАЧА 32.
- •ЗАДАЧА 33.
- •ЗАДАЧА 34.
- •ЗАДАЧА 35.
- •ЗАДАЧА 36.
- •ЗАДАЧА 37.
- •ЗАДАЧА 38.
- •ЗАДАЧА 39.
- •ЗАДАЧА 40.
- •ЗАДАЧА 41
- •ЗАДАЧА 42.
- •Действующее вещество:
- •ЗАДАЧА 43
- •ЗАДАЧА 44
- •2. При нарушении функции почек
- •ЗАДАЧА 45.
- •ЗАДАЧА 46.
- •ЗАДАЧА 47.
- •ЗАДАЧА 48.
- •ЗАДАЧА 49.
- •ЗАДАЧА 50.
- •ЗАДАЧА 51.
- •ЗАДАЧА 52
- •ЗАДАЧА 53.
- •ЗАДАЧА 54.
- •ЗАДАЧА 55.
- •ЗАДАЧА 56.
- •ЗАДАЧА 57.
- •ЗАДАЧА 58.
- •ЗАДАЧА 59.
- •ЗАДАЧА 60.
- •ЗАДАЧА 61.
- •ЗАДАЧА 62.
- •ЗАДАЧА 63
- •ЗАДАЧА 64.
- •ЗАДАЧА 65.
- •ЗАДАЧА 66
- •ЗАДАЧА 67.
- •ЗАДАЧА 68.
- •ЗАДАЧА 69
- •ЗАДАЧА 70.
- •ЗАДАЧА 71.
- •ЗАДАЧА 72.
- •ЗАДАЧА 73.
- •ЗАДАЧА 74.
- •ЗАДАЧА 75.
- •ЗАДАЧА 76.
- •ЗАДАЧА 77
- •ЗАДАЧА 78
|
|
|
Рост бактерий |
Клостридии образуют гладкие (S) или |
|
||||
|
|
|
|
шероховатые (R) колонии, прозрачные, |
|
||||
|
|
|
|
которые могут быть окружены зоной |
|
||||
|
|
|
|
гемолиза (Cl. botulinum, Cl. perfringens, |
|
||||
|
|
|
|
Cl. |
tetani), |
колонии |
источают |
|
|
|
|
|
|
характерный запах, образуют газ, |
|
||||
|
|
|
|
истончающий столбик агара |
|
|
|||
|
|
|
|
|
|
||||
|
Молоко |
по |
Питательная |
Молоко (5-6%) в 1% пептонной воде |
|
||||
|
Тукаеву |
|
основа |
|
|
|
|
|
|
|
(жидкая) |
|
|
|
|
|
|
|
|
|
|
Дыхательный |
Лактоза (в составе молока) |
|
|
||||
|
|
|
|
|
|||||
|
|
|
(энергетический) |
|
|
|
|
|
|
|
|
|
субстрат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Редуцирующий |
Казеин |
|
|
|
|
|
|
|
|
фактор |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Рост бактерий |
Cl. perfringens при посеве чистой |
|
||||
|
|
|
|
культуры |
или |
патологического |
|
||
|
|
|
|
материала образует сверток за 6 часов |
|
||||
|
|
|
|
(«штормовая реакция»); Cl. tetani |
|
||||
|
|
|
|
сбраживает молоко очень медленно с |
|
||||
|
|
|
|
образованием мелких хлопьев; Cl. |
|
||||
|
|
|
|
botulinum по-разному растет на молоке в |
|
||||
|
|
|
|
зависимости от серотипа |
|
|
|||
|
|
|
|
|
|
||||
|
Среда |
|
Питательная |
Питательный агар с печеночным отваром |
|
||||
|
Блаурокка |
(для |
основа |
|
|
|
|
|
|
|
Bifidobacterium) |
|
|
|
|
|
|
|
|
|
- плотная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дыхательный |
Глюкоза |
|
|
|
|
|
|
|
|
субстрат |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Редуцирующий |
Цистеин |
|
|
|
|
|
|
|
|
фактор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22. Методы культивирования вирусов. Вирусологический метод, основные этапы.
Вирусологический метод состоит из данных этапов:
1. Отбор и обработка материала для исследования. Исследуемый материал (фекалии, носоглоточные смывы, секционный материал, спинномозговая жидкость, кровь моча и т.д. – зависит от характера заболевания) центрифугируют, фильтруют, обрабатывают для подавления бактериальной и грибковой микрофлоры антибиотиками, добавляют к смеси гептан и фреон. Отбор проводится в ранние сроки заболевания при соблюдении правил, предотвращающих контаминацию материала посторонней микрофлорой и инфицирование медицинского персонала. Для предупреждения инактивации вирусов при транспортировке материала, он помещается в вирусную транспортировочную среду (ВТС), состоящую из сбалансированного солевого раствора,
антибиотиков и сывороточного альбумина. Транспортируется материал в специальном контейнере с термоизоляцией и закрытыми пластиковыми пакетами, содержащими лед.
2.Заражение серии:
·Куриных эмбрионов (КЭ)
Для успешного культивирования вирусов в КЭ требуется определенный температурный режим (36-38С), влажность (50-70%) и достаточная вентиляция. Заражают куриные эмбрионы определенного возраста, инкубированные от 6 до 13 дней. Перед заражением куриные эмбрионы овоскопируют: определяют их жизнеспособность, отмечают на скорлупе границу воздушного мешка и месторасположение эмбриона («темный глаз» эмбриона). Работа с куриными эмбрионами проводится в стерильном боксе стерильными инструментами (пинцеты, шприцы, ножницы, копье и др.). После выполнения фрагмента работы инструменты погружают в 70 % этиловый спирт и перед следующей манипуляцией прожигают. Перед заражением скорлупу куриного эмбриона протирают горящим спиртовым тампоном и спиртовым раствором йода. Объем исследуемого материала, вводимого в эмбрион, составляет 0,1-0,2 мл. Для выделения вирусов из одного материала используют не менее 4 куриных эмбрионов. Могут производит заражение на хорионаллантоисную оболочку, в аллантоисную полость, в полость амниона, в желточный мешок.
·Культур клеток
Для успешного получения клеточных культур и последующего размножения в них вирусов культивируемые клетки должны постоянно находиться в сбалансированной среде, содержащей все необходимые компоненты для их жизнедеятельности и размножения. Для этой цели используют солевые растворы и вирусологические питательные среды. Нередко добавляются антибиотики, чтобы избежать бактериального и грибкового заражения. Вирусологические питательные среды – естественные питательные среды (солевые растворы Хенкса и Эрла + сыворотки + амниотическая жидкость + эмбриональные экстракты, напр., среда HeLa), ферментативные гидролизаты белковых веществ (напр., гидролизат лактальбумина + раствор Хенкса), синтетические питательные среды (напр., среда Паркера, среда Игла и т.д.).
·Лабораторных животных
Используются белые мыши, морские свинки, хомяки, кролики и др. Белые мыши наиболее чувствительны к большому числу видов вирусов. Способ заражения животных определяется тропизмом вируса к тканям. Заражение в мозг применяется при выделении нейротропных вирусов (вирусы бешенства, полиовирусы и др.). Интраназальное заражение проводят при выделении возбудителей респираторных инфекций. Широко используются внутримышечный, внутривенный, внутрибрюшинный, подкожный и другие методы заражения. Заболевших животных усыпляют эфиром, вскрывают и производят забор материала из органов и тканей.
3.Оценивают феномены, указывающие на присутствие вируса
·Куриные эмбрионы – РГА, гибель, отставание в развитии, изменение оболочек
·Культуры клеток – ЦПД, образование бляшек, цветная проба Солка, гемадсорбция, интерференция, РГА, иммуннофлюоресценция
·Животные – заболевание, гибель, морфологические изменения в тканях

4.Титрование выделенного вируса
5.Идентификация выделенного вируса - используют диагностические иммунные сыворотки в РН, РТГА, РСК, цветной пробе Солка, РТНАдс, в реакции подавления бляшкообразования и др.
23.Методы микроскопического исследования (световая, люминесцентная, темнопольная, фазово-контрастная, электронная микроскопия)
Методы микроскопического исследования (в том числе и бактериоскопический метод) относятся к методам, основанным на прямом выявлении инфекционных агентов (бактерий, грибов, вирусов, простейших) в живом/инактивированном состоянии или на прямом выявлении его специфичных фрагментов в патологическом материале путем визуализации объекта. С помощью микроскопии исследуют нативный (не поврежденный при исследовании, естественный) материал и/или окрашенный препарат (окрашенный мазок этого материала).
Преимущества микроскопии – быстрота, техническая простота, общедоступность, недорогая стоимость; недостатки – низкая чувствительность, низкая информативность, от врачаклинициста требуются знания техники приготовления препаратов сразу после взятия патологического материала, с помощью микроскопии можно поставить окончательный диагноз только при некоторых заболеваниях: гонорея, туберкулез, возвратные тифы, сифилис, в остальных случаях результаты микроскопии являются предварительными, ориентировочными; достоверность исследования будет зависеть от квалификации микроскописта в связи с субъективной трактовкой препарата (нужна «насмотренность», опыт врача).
Особенности микроскопического исследования влажных препаратов: исследуемый материал НЕ подвергается фиксации, что позволяет обнаружить ЖИВЫЕ микроорганизмы и идентифицировать их по характеру подвижности, морфологическим свойствам; пример: диагноз «сифилис» может быть поставлен с помощью темнопольной микроскопии при обнаружении в отделяемом из твердого шанкра/ в сукровице из розеол подвижных спирохет; так же диагностируются микозы, протозойные инфекции (в т.ч. трихомониаз) и гельминтозы.
*может использоваться при обнаружении клеток, пораженных вирусами – клеток «кошачий глаз» (диагностика цитомегаловирусной инфекции)
Особенности микроскопического исследования окрашенных препаратов: исследуемый материал подвергается фиксации и окрашиванию, что позволяет определить в патологическом материале присутствие микроорганизмов и ориентировочно идентифицировать их на основании
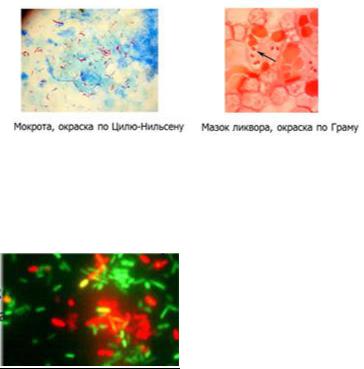
морфологических и тинкториальных свойств. Чаще используется окраска по Граму, которая позволяет в ряде случаев поставить этиологический диагноз (менингококковая инфекция, гонорея и др.) или по преобладанию в материале грам+ или грамфлоры выбрать соответствующий антибиотик широкого спектра действия для начала проведения антибактериальной терапии.
*максимальная определяемая концентрация бактерий в мазке из нативного материала - 105 кл./мл (количество микроорганизмов в единице объема исследуемого объекта) (это означает, что при необходимости выявления МО, находящихся в материале в меньших количествах, их предварительно нужно центрифугировать– при туберкулезе, менингококковой инфекции, или делать многослойные мазки, или предобогащение в культуральной среде – при трихомониазе; т.е. патологический процесс может иметь место, но метод не позволит увидеть возбудителей в мазке).
1)Световая микроскопия
Принцип работы: исследуются окрашенные клетки и ткани, для освещения применяются лучи видимого спектра, изображение создается за счет различий и степени поглощения света разными участками изучаемого окрашенного объекта, при прохождении луча через окрашенный объект происходит изменение интенсивности света, человеческий глаз улавливает изменения амплитуды световой волны.
Достоинства: техническая простота, недорогая стоимость, позволяет различить структуру и детали изучаемого объекта, если он состоит из частей с разной оптической плотностью без специальных доп. устройств
Недостатки: низкий контраст изображения, не видны объекты менее 200 нм
*окраска по Цилю-Нильсену используется для дифференцировки бактерии по строению клеточной стенки
2) Люминесцентная микроскопия
Принцип работы: мощный пучок света (из источника света, богатого ультрафиолетом) попадает на систему ультрафиолетовых светофильтров, фиолетовые и ультрафиолетовые лучи проходят через фильтр и, пройдя по оптической системе, попадают (фиолетовые на рисунке) на интерференционный светофильтр (серый на рисунке), расположенный над объективом под

углом 450. Последний не пропускает УФ-лучи и отражает их в объектив. Через объектив происходит освещение объекта, ранее окрашенного флюорохромом, возникает вторичная флюоресценция. Лучи вторичной флюоресценции (зеленым на рисунке) НЕ задерживаются интерференционным светофильтром и попадают в окуляр.
Достоинства: высокая контрастность, возможность использования специфичных методов микроскопии (реакция иммунофлюоресценции).
Недостатки: высокая стоимость.
3) Темнопольная микроскопия
Принцип работы: в микроскопе используется кардиоид-конденсор (или параболоид-конденсор), который не пропускает центральные лучи, для освещения используются боковые лучи, которые при отсутствии объекта не попадают в объектив (темное поле). При наличии объекта часть лучей, попадая на него, отражается в объектив, создавая яркое изображение.
Достоинства: возможность изучения живых микроорганизмов (изучения подвижности бактерий и простейших); отсутствие искажений, связанных с фиксацией и окраской препаратов.
Недостатки: сложная настройка освещения, высокие требования к качеству предметных и покровных стекол.
4) Фазово-контрастная микроскопия
Принцип работы: пучок света, проходящий сквозь неокрашенный препарат, меняет фазу колебания световой волны, но это колебание не воспринимается человеческим глазом. Фазовоконтрастный конденсор и фазовый объектив делают изображение контрастным, превращая фазовые изменения световой волны в видимые амплитудные.
Достоинства: возможность изучения живых микроорганизмов (изучение подвижности бактерий и простейших); отсутствие искажений, связанных с фиксацией и окраской препаратов, возможно изучение внутренней структуры крупных объектов (ядра, вакуоли).
*нужен для изучения малоконтрастных объектов, невидимых в микроскоп при наблюдении в проходящем свете в световом поле
Недостатки: слабая контрастность получаемых изображений и наличие светящихся ореолов вокруг объектов.
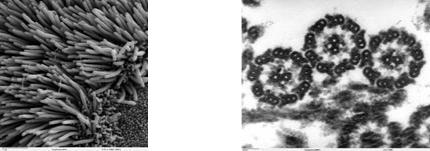
5) Электронная микроскопия
эпителий трахеи (РЭМ – растровая) Поперечное сечение через жгутики хламидомонады (ПЭМ
– просвечивающая, или трансмиссионная)
Принцип работы:
1)сканирующая (растровая) ЭМ используется для изучения поверхности объекта, образцы покрываются пленкой металла, вместо света через объект пропускается пучок электронов; 2)трансмиссионная (просвечивающая) ЭМ используется для изучения внутреннего строения клетки, пучок электронов пропускается через объект, предварительно обработанный тяжелыми металлами, которые накапливаются в определенных структурах, увеличивая их электронную плотность, электроны рассеиваются на участках клетки с большей электронной плотностью, в результате чего на изображениях эти области выглядят темнее.
Достоинства: высокое разрешение (теоретически до 0,002 нм, практически до 2 нм), возможность изучения ультраструктур клеток
Недостатки: необходимо специальное техническое оснащение, техническая сложность, труднодоступность, дороговизна
*ОБЩИЕ ПОНЯТИЯ:
Увеличение (увеличительная способность оптической системы) – то, во сколько раз можно увеличить объект при сохранении четкости изображения. Рассчитывается как произведение объектива на увеличение окуляра.
Разрешение (разрешающая способность) – минимальное расстояние между двумя точками, на котором они еще воспринимаются отдельно. Разрешение здоровой оптической системы глаза
0,2 мм.
Для микроскопии готовят мазки (микропрепараты):
1)нативный – в физ.раствор на предметное стекло наносят суспензию исследуемого материала, покрывают сверху покровным стеклом;
2)фиксированный – обезжиривают предметное стекло, наносят каплю физ.раствора, петлей/зубочисткой/стеклянной палочкой готовят суспензию исследуемого материала, высушивают, фиксируют в пламени спиртовки или хим. веществом, окрашивают, промывают, высушивают.
