
Нормальная физиология / КР5 по сердцу
.pdf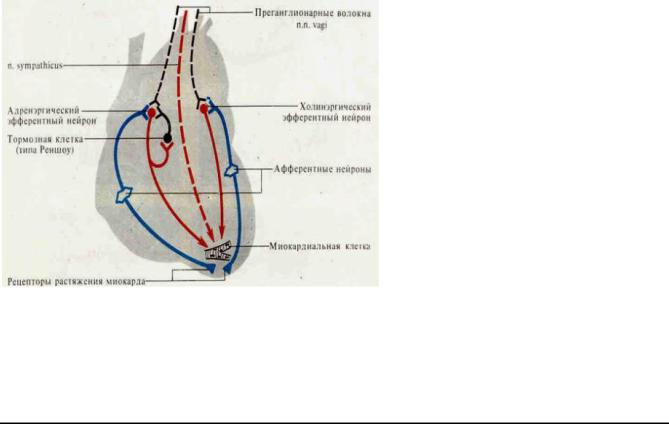
Собственная нервная система сердца представлена периферическими рефлекторными дугами. Внутрисердечная дуга в своем составе имеет три нейрона: а) афферентный нейрон,
дендриты которого являются рецепторами растяжения на кардиомиоцитах и коронарных сосудах; б) вставочный нейрон; в) эфферентный нейрон, аксон которого заканчивается на кардиомиоцитах.
Нейроны внутрисердечной нервной системы расположены поодиночке или собраны в ганглии.
Внутрисердечные рефлексы регулируют кровенаполнение полостей сердца и давление в аорте
1.Повышение растяжения правого предсердия усиливает сокращения левого желудочка, чтобы освободить место притекающей крови и разгрузить венозную систему.
2.Переполнение камер сердца кровью снижает силу сокращений - крови выбрасывается меньше и она депонируется в венозной системе.
3.Внутрисердечная нервная система предупреждает резкие колебания давления в аорте: при высоком давлении в аорте - сердечная деятельность угнетается, и, наоборот, при низком давлении – усиливается.
К числу сопряженных кардиальных рефлексов относятся также все условные рефлексы, влияющие на деятельность сердца. Примером является так называемая предстартовая лихорадка — состояние, которое наблюдается у спортсменов перед началом соревнований («Предстартовая лихорадка» (ПЛ) – это состояние эмоционального возбуждения, которое часто возникает задолго до выступления. Это избыточное волнение, при котором человек нервничает, суетится.). Оно представляет собой следствие активации симпатоадреналовой системы, которая возникает в ответ на комплекс условных раздражителей,
сопутствующих проведению спортивных мероприятий. Характерным примером условнорефлекторных изменений частоты сердечных сокращений у человека является «синдром белого халата», когда при посещении врача возрастает частота сердечных сокращений сердца и повышается артериальное давление. Формирование такого условного рефлекса происходит еще при первом посещении врача ребенком. Если, например, врач выполняет инъекцию препарата, которая сопровождается болью, стрессорной реакцией, приводящей к тахикардии, то возникает условный рефлекс: врач — условный раздражитель, болевой стимул — безусловный. В дальнейшем только посещение врача вызывает у человека услов-норефлекторное повышение частоты сердечных сокращений.
Влияние нейронов коры большого мозга на деятельность сердца усиливается в ходе формирования и реализации у человека и животных эмоциональных, поведенческих реакций и условных рефлексов. Как отмечено ранее, условные рефлексы являются сопряженными кардиальными рефлексами и формируются на основе безусловных рефлекторных реакций. У человека условнорефлекторные реакции сердца могут формироваться через вторую сигнальную систему, то есть когда условным стимулом является слово. То есть доброжелательное отношение врача к больному является мощнейшим фактором терапевтического воздействия на организм человека и сердечно-сосудистую систему. Напротив, нездоровый образ жизни, при котором слово постоянно выступает эмоциональным стрессором, способствует развитию сердечно-сосудистой патологии. Таким образом, кортикальные механизмы имеют большое значение в реализации изменений деятельности сердца и кровообращения при стрессовых и невротических состояниях человека.
Произвольно изменить параметры сердечной деятельности можно только косвенным путем, например произвольно изменяя эмоциональное состояние организма. Данный подход широко применяется в системах аутотренинга, а также в индийской системе хатха-йоги. Данная система повышает устойчивость сердечно-сосудистой системы к стрессорным факторам.

Вопрос 16. Гуморальная регуляция деятельности сердца (влияние катехоламинов, тироксина, кортизола, ионов калия и кальция).
Евлахов:
Система кровообращения, обеспечивая движение крови по сосудам, выполняет гуморальную функцию. В крови циркулирует много различных веществ, способных так или иначе влиять на деятельность сердца. Однако прямое участие в регуляции сердечной деятельности принимает относительно небольшое число гормонов. К ним относятся:
—катехоламины — гормоны мозгового вещества надпочечников;
—глюкокортикоиды — гормоны коркового вещества надпочечников;
—йодсодержащие гормоны щитовидной железы — трийодтиронин и тироксин;
—половые гормоны.
Катехоламины (адреналин, норадреналин и дофамин) непрерывно выделяются мозговым веществом надпочечников в норме в небольшом количестве, но их секреция резко возрастает в условиях возбуждения симпато-адреналовой системы.
Влияние этих гормонов на сердце обусловлено в основном активацией ими β-адренорецепторов и в меньшей степени
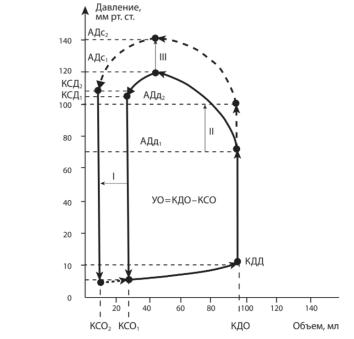
— α-адренорецепторов кардиомиоцитов. Действие катехоламинов на миокард аналогично стимуляции симпатических нервов сердца. В результате возрастают энергетический обмен, потребление миокардом кислорода, часто та сердечных сокращений и сократимость миокарда, что приводит к увеличению ударного объема сердца и сердечного выброса. Рабочая диаграмма левого желудочка в координатах «давление — объем» в условиях действия на сердце адреналина. Из этого рисунка следует, что даже в условиях постоянной величины конечнодиастолического объема левого желудочка его ударный объем возрастает благодаря уменьшению конечносистолического объема. В то же время на фоне длительной избыточной секреции катехоламинов может развиваться дистрофия миокарда.
(Адреналин: Действует на β1-адренорецепторы. β1-адренорецепторы относятся к метаботропным рецепторам. Воздействие на данную группу рецепторов катехоламинами активирует аденилатциклазуGas-субъединицей, ассоциированной с данным рецептором. Как следствие, в цитозоле повышается содержание цАМФ, происходит активация протеинкиназы А, которая активирует специфическую миозинкиназу, ответственную за фосфорилирование головок тяжелых нитей миозина.
Такое воздействие ускоряет сократительные процессы в миокарде и проявляется как положительные ино- и хронотропные эффекты.
1.Тироксин регулирует изоферментный состав миозина в кардиомиоцитах, усиливает сердечные сокращения.
2.Глюкагон оказывает неспецифическое влияние, за счет активации аденилатциклазы усиливает сердечные сокращения.
3.Глюкокортикоиды усиливают действие катехоламинов за счет того, что повышают чувствительность адренорецепторов к адреналину.
4.Вазопрессин. В миокарде имеются V1-рецепторы к вазопрессину, которые ассоциированы сG-белком. При взаимодействии вазопрессина сVi-рецептором субъединицаGaqактивирует фосфолипазу Сβ. Активированная фосфолипаза Сβ катализирует соответствующий субстрат с образованием ИФ3и ДАГ. ИФ3активирует кальциевые каналы цитоплазматиче-ской мембраны и мембраны саркоплазматического ретикулума, что приводит к увеличению содержания кальция в цитозоле.
ДАГ параллельно активирует протеинкиназу С. Кальций инициирует мышечное сокращение и генерацию потенциалов, а протеинкиназа С ускоряет фосфорилирование головок миозина, как следствие, вазопрессин усиливает сердечные сокращения.
Простагландины I2, Е2ослабляют симпатические влияния на сердце.
Глюкокортикоиды (кортизол и кортикостерон) оказывают пермиссивный (англ. permissive – разрешающий)
эффект, увеличивая количество адренорецепторов миокарда и повышая их чувствительность к катехоламинам. На фоне избытка кортизола возрастают частота и сила сердечных сокращений, тогда как при сниженном уровне кортизола в плазме у больных с недостаточностью надпочечников наблюдается брадикардия. Катехоламины и глюкокортикоиды вызывают выраженные сдвиги обмена веществ, влияющие и на метаболизм миокарда.
Йодсодержащие гормоны щитовидной железы (трийодтиронин и тироксин), оказывают длительный пермиссивный эффект по отношению к катехоламинам. Кроме этого, под влиянием тироксина уменьшается чувствительность М-холинорецепторов миокарда к ацетилхолину. Поэтому под действием тироксина эффекты катехоламинов на сердце усиливаются, и в результате частота сердечных сокращений, ударный объем сердца и сердечный выброс возрастают. Йодсодержащие гормоны щитовидной железы непосредственно регулируют изоферментный состав миозина в кардиомиоцитах желудочков, что вызывает рост сократимости миокарда.
Важно также подчеркнуть, что тироксин, влияя на основной обмен в организме, ускоряет окисление свободных жирных кислот, а также увеличивает экскрецию холестерина печенью, что уменьшает их концентрацию в крови. Присутствие в пище человека достаточного количества йодсодержащих продуктов (морская рыба, морская капуста) способствует снижению уровня холестерина и, таким образом, уменьшает риск развития атеросклероза коронарных артерий. Но при избытке йодсодержащих гормонов (гипертиреозе) у больных наблюдаются тахикардия и нарушения сердечного ритма, в частности мерцательная аритмия. На этом фоне у них развивается дистрофия миокарда («тиреотоксическое сердце»).
При тяжелых формах тиреотоксикоза резко возрастает теплопродукция, что может привести к выраженной активации механизмов терморегуляции и расширению артерий и вен кожи.
В результате возникает недостаточность периферического кровообращения, хотя сердечный выброс при этом увеличен («сердечная недостаточность высокого сердечного выброса»).
Действие других гормонов на миокард является неспецифическим. Так, наряду с клетками других тканей под влиянием инсулина повышается проницаемость мембран для глюкозы и у кардиомиоцитов. В результате на фоне увеличения уровня инсулина в крови возрастают метаболизм миокарда и его сократимость. Глюкагон, активируя рецепторы печени, способствует гликогенолизу и повышению концентрации глюкозы в крови. При этом также активируется аденилатциклаза в кардиомиоцитах, что сопровождается положительным инотропным эффектом на сердце.
Мужские половые гормоны (тестостерон, дегидроэпиандростерон), обладая анаболическим эффектом, то есть усиливая синтез белка, способствуют увеличению массы скелетных мышц, а также миокарда в результате силы сокращений сердца. Поэтому производные мужских половых гормонов — анаболические стероиды, например ретаболил, применяются при лечении инфаркта миокарда, когда необходимо ускорить образование рубца и усилить сократимость. Однако анаболические стероиды, применяемые при наращивании мышечной массы у спортсменовкультуристов, способствуют развитию атеросклероза коронарных артерий. Подобным же эффектом обладают анаболические стероиды, широко применяемые в индустриальном животноводстве и накапливающиеся в мясе сельскохозяйственных животных, используемых в пище человека.
Женские половые гормоны (эстрадиол, прогестерон) обладают протекторным действием на миокард, снижая его чувствительность к катехоламинам и стимулируя выработку оксида азота в коронарных артериях. Избыток эстрогенов, который может возникать в организме женщины,
например при применении гормональных контрацептивных препаратов, способствует развитию ожирения, атеросклероза коронарных артерий, задержке натрия и воды, а также резко увеличивает риск тромбообразования в венах и коронарных артериях. В результате многократно повышается вероятность развития ишемической болезни сердца. В силу
указанных причин фитоэстрогены, содержащиеся в сое и пиве, при поступлении их в мужской организм также способствуют развитию атеросклероза коронарных артерий и ишемической болезни сердца.
Ангиотензин и вазопрессин, активируя соответственно ангиотензин- и вазопрессин чувствительные рецепторы миокарда, вызывают увеличение его сократимости. В условиях интактной системы кровообращения на фоне увеличения концентрации в крови ангиотензина и вазопрессина положительные инотропные эффекты сердца могут быть обусловлены не только возбуждением ангиотензин- и вазопрессин-чувствительных рецепторов миокарда, но и возрастанием артериального давления и объема циркулирующей крови, то есть пост- и преднагрузки сердца. В регуляции деятельности сердца принимают участие и местные гуморальные факторы, образующиеся в миокарде и других тканях сердца. К таким веществам относятся, например, аденозин, гистамин и простагландины.
Аденозин, взаимодействуя с аденозиновыми рецепторами кардиомиоцитов, уменьшает пейсмекерную активность клеток синоатриального узла и снижает скорость проведения возбуждения в атриовентрикулярном узле и в проводящей системе сердца. Это свойство аденозина применяется в клинической кардиологии: в некоторых случаях для лечения пароксизмальных наджелудочковых тахикардий применяются соли аденозинтрифосфорной кислоты. В экспериментах на животных в условиях изолированного сердца установлено, что аденозин уменьшает сократимость миокарда. Кроме того, под влиянием аденозина происходит дилатация
коронарных артерий, что приводит к увеличению кровоснабжения миокарда. В этом заключается один из основных механизмов обеспечения коронарной вазодилатации.
Гистамин в экспериментах на изолированном сердце увеличивает сократимость миокарда, активируя гистаминовые рецепторы. В миокарде млекопитающих и человека обнаружены два типа гистаминовых рецепторов: Н1 и Н2. При возбуждении Н1-рецепторов продолжительность потенциала действия кардиомиоцитов желудочков увеличивается, тогда как при активации Н2-рецепторов она, напротив, уменьшается. Активация этих рецепторов приводит к значительному повышению в кардиомиоцитах уровня внутриклеточного циклического аденозинмонофосфата, а также инозитолтрифосфата и диацилглицерола. Это сопровождается повышением сократимости миокарда. Однако в условиях интактного кровообращения изменения деятельности сердца в ответ на применение гистамина более сложные, поскольку они в свою очередь сопровождаются различными изменениями постнагрузки правого и левого желудочков сердца. Так, в экспериментах на животных при непосредственном измерении сократимости миокарда обоих желудочков отмечено, что внутривенное введение гистамина вызывает снижение артериального давления и сократимости миокарда левого желудочка, но, напротив, повышение давления в легочной артерии и сократимости миокарда правого желудочка по механизму Анрепа. Из клинической литературы известно, что в условиях тяжелой аллергической патологии — анафилактическом шоке, когда имеет место массивный выброс гистамина тучными клетками в кровоток большого круга кровообращения, расширяются артериолы и прекапиллярные сфинктеры, что приводит к вы раженному депонированию крови в капиллярах, уменьшению венозного возврата и сопровождается резким снижением сердечного выброса и артериального давления. В результате сократимость миокарда левого желудочка значительно снижается. При аллергической форме бронхиальной астмы, которая сопровождается выбросом гистамина тучными клетками в бронхах, происходит увеличение бронхиального сопротивления, что вызывает повышение давления в легочных капиллярах и легочной артерии, то есть постнагрузки правого желудочка. В результате по механизму Анрепа и возрастает его сократимость.
Изменения ионного состава. В составе плазмы крови концентрация ионов натрия составляет 142 ммоль/л, хлора — 100 ммоль/л, ионов калия — 4,2 ммоль/л, а ионов кальция — 1,5 ммоль/л. Однако несмотря на то, что концентрация ионов калия и кальция в крови во много раз меньше, чем натрия, сердце наиболее чувствительно именно к изменению концентрации калия и особенно кальция, которая благодаря гуморальным механизмам регуляции поддерживается в плазме крови на постоянном уровне. Регуляция концентрации калия обеспечивается кортизолом и альдостероном, а постоянный уровень кальция поддерживается кальцитонином, паратгормоном и кальцитриолом.
Снижение концентрации ионов калия в крови в клинической практике отмечено у больных гипертонической болезнью при назначении мочегонных препаратов, а также у больных с почечной недостаточностью, находящихся на гемодиализе. Поскольку регуляция концентрации калия в крови тесно связана с регуляцией уровня натрия (так, под влиянием кортизола и альдостерона усиливаются реабсорбция натрия почками и выведение калия), то сдвиги концентрации натрия могут приводить к изменениям концентрации калия. Поэтому снижение натрия в плазме крови, например в условиях интенсивного потоотделения, может сопровождаться уменьшением концентрации калия в плазме крови, поскольку на фоне гипонатриемии увеличивается секреция альдостерона.
Гипокалиемия может приводить к синусовой тахикардии, экстрасистолии и другим нарушениям сердечного ритма, вплоть до фибрилляции желудочков. Поэтому в клинической практике у больных инфарктом миокарда с целью профилактики аритмий применяют внутривенное введении поляризующей смеси, содержащей раствор калия, глюкозы и инсулина, который повышает проницаемость мембран кардиомиоцитов для ионов калия. При назначении мочегонных средств, вызывающих усиленное выведение калия из организма, необходимо измерять концентрацию калия в плазме и в случае ее уменьшения назначать калийсберегающие диуретики, а также диету с повышенным содержанием калия в рационе. К продуктам с высоким содержаниям калия относятся изюм, курага, груши, апельсины и печеный картофель.
Небольшое повышение концентрации ионов калия (до 5–6 ммоль/л) приводит к деполяризации кардиомиоцитов вследствие уменьшения трансмембранного калиевого градиента. В подобных условиях возбудимость миокарда и скорость проведения возбуждения по проводящей системе сердца возрастают. Однако при значительном увеличении содержания калия в плазме (от 7 до 8 ммоль/л) увеличивается активность мембранных К+/Nа+-насосов. В результате возникает гиперполяризация кардиомиоцитов, уменьшаются возбудимость и проводимость миокарда, снижается
скорость спонтанной диастолической деполяризации пейсмекеров синоатриального узла. При этом могут иметь место синусовая брадикардия, блокады проведения возбуждения в атриовентрикулярном соединении и пучке Гиса, а также опасные для жизни человека нарушения сердечного ритма: желудочковая тахикардия и фибрилляция желудочков. Возрастание концентрации ионов калия в плазме крови свыше 10 ммоль/л приводит к асистолии — прекращению электрической и сократительной активности миокарда. Остановка сердца происходит в этом случае во время диастолы. В естественных условиях жизнедеятельности организма человека значительное повышение концентрации ионов калия в плазме крови практически невозможно благодаря эффективным механизмам регуляции водно-электролитного баланса почками. Однако гиперкалиемия может иметь место, например, при передозировке вводимых внутривенно препаратов калия или при переливании больших количеств консервированной крови. В кардиохирургии гиперкалиевые (кардиоплегические) растворы используются специально для временной остановки сердца. Увеличение концентрации ионов кальция в плазме крови свыше 1,5 ммоль/л приводит к повышению возбудимости и сократимости миокарда. В эксперименте можно наблюдать резкое увеличение силы сокращений сердца, находящегося в гиперкальциевом растворе. Однако избыток ионов кальция при его концентрации в плазме свыше 2 ммоль/л вызывает остановку сердца в систолу. Ее причиной является невозможность расслабления миокарда вследствие связывания ионов кальция с тропонином.
Ацетилхолин. Действует на М2-холинорецепторы. М2-холинорецеп-горы относятся к метаботропным рецепторам. Образование лиганд-рецепторного комплекса ацетилхолина с этими рецепторами приводит к активации, ассоциированной с М2-холинорецептором субъединицыGai, которая тормозит активность аденилатциклазы и опосредованно снижает активность протеинкиназы А.
Протеинкиназа А имеет важное значение в активности миозинкиназы, играющей определяющую роль в фосфорилировании головок тяжелых нитей миозина, ключевого процесса сокращения миоцитов, поэтому можно полагать, что снижение ее активности способствует развитию отрицательного инотропного эффекта.
При взаимодействии ацетилхолина с М2-холино-рецептором не только угнетается аденилатциклаза, но и акти вируется мембранная гуанилатциклаза, ассоциированная с этим рецептором. Это приводит к увеличению концентрации цГМФ и, как следствие, к активации протеинкиназы G, которая способна:
•фосфорилировать мембранные белки, образующие лигандуправляемые К+- и анионные каналы, что увеличивает проницаемость этих каналов для соответствующих ионов;
•фосфорилировать мембранные белки, образующие лигандуправляемые Na+- и Са++- каналы, что приводит к уменьшению их проницаемости;
•фосфорилировать мембранные белки, образующие К+/Na+- насос, что приводит к уменьшению его активности.
Фосфолирирование лигандуправляемых калиевых, натриевых, кальциевых каналов и К+Na+насоса протеинкиназойGприводит к развитию тормозного действия ацетилхолина на сердце, которое проявляется в отрицательном хронотропном и отрицательном инотропном эффектах.
Кроме того, следует иметь в виду, что ацетилхолин непосредственно активирует ацетилхолинрегулируемые калиевые каналы атипических кардиомиоцитов.
Тем самым снижает возбудимость этих клеток за счет увеличения полярности мембран атипичных кардиомиоцитовсиноатриального узла и, как следствие, вызывает урежение сердечной деятельности (отрицательный хронотропный эффект).
Кратко:
Гуморальная регуляция деятельности сердца( влияние катехоламинов, тироксина, кортизола, ионов калия и кальция) Изменения работы сердца наблюдаются при действии на него ряда биологически активных веществ, циркулирующих в крови.
Катехоламины (адреналин, норадреналин) увеличивают силу и учащают ритм сердечных сокращений, что имеет важное биологическое значение. При физических нагрузках или эмоциональном напряжении мозговой слой надпочечников выбрасывает в кровь большое количество адреналина, что приводит к усилению сердечной деятельности, крайне необходимому в данных условиях.
Электролиты: К+, Са2+ (особенно их соотношение). Если К+ > Ca2+ — торможение сердца (под влиянием К+ — гиперполяризация). Если Са2+ > К+ — увеличение силы сердечных сокращений, возможно уменьшение расслабления миокарда. При избытке Са2+ — остановка сердца в систолу.
1.адреналин — резко увеличивает частоту и силу сердечных сокращений. Это гормон экстремальных ситуаций.
2.тироксин — стимулирует сердечную деятельность, но действует постоянно. Действует за счёт стимулции окислительного фосфорилирования. Повышает чувствительность сердца к другим гормонам (адреналину).
3.минералокортикоиды (альдостерон) — увеличивают выведение К+ из организма, начинает преобладать Са2+ — сила сокращений сердца увеличивается.
4.половые гормоны — стимулируют сердечную деятельность.
Эти гормоны стимулируют работу сердца (увеличивают частоту и силу сердечных сокращений) — в итоге быстрое избавление сердца от крови: увеличивается минутный объём; уменьшается сосудистый тонус и сосуды расширяются, как следствие — снижение давления, стимулируются процессы фильтрации и реабсорбации в почках, обеспечивая задержку натрия и выведение К+ (восстанавливается электролитный состав).
NB: Прогрессирующее увеличение силы при резком уменьшении интервала между сокращении вызвано постепенным увеличением конц. внутриклеточно Ca2+, кот. способствуют:
1)увеличение числа деполяризаций в мин:
Са2+ входит в клетку миокарда в период плато каждого ПД. Когда интервал м/у сокращениями уменьшается, кол-во фаз плато в мин возрастает. Продолжительность каждого ПД уменьшается при укорочении интервала, но суммарный эффект увеличения числа фаз в мин на вход Са2+ превалирует и его внутриклеточная конц. увеличивается.
2)увеличение входящего Ca2+ тока за 1 деполяризацию:
интервал м/у сокращениями резко уменьшается, входящий Са2+-ток (ICa) прогрессивно увеличивается с каждым последующем сокращением до тех пор, пока не будет достигнут новый устойчивый максимум силы при новой длительности м/у стимулами, вызывающими сокращениями.
Гормоны мозгового в-ва н/п:
По сути, мозг. в-во н/п – составная ч. ВНС (симпат.). Осн. гормон – адреналин + чуть-чуть норадреналина. Синтез регулируется теми же механизмами, что регулируется симпат. НС. Конц. катехоламинов повышается в тех же случаях, когда активируется симпато-адреналовая система. В нормальных усл. влияние катехоламинов, циркулирующих в крови, минимальное.
•максимальная скорость повышения давления в левом желудочке – показатель сократительной способности миокарда – пропорциональна конц. норадреналина в крови.
•умеренная физ нагрузка так же увеличивала МСПД в ЛЖ почти на 100%, но конц. катехоламинов увеличивалось незначительно => изменение давление при физ нагрузке из-за норадреналина, высвобожденным из пресинапсов симпат. нервов сердц
Гормоны коры н/п.
Хроническая недостаточность коры н/п – болезнь Аддисона. Объем крови увменьшается – сильная гипотензия и сердечно-сосудистый коллапс – криз Аддисона. (адренокортикостероиды_
•в экспериментах при удалении н/п и помещении в перфузионной камере быстрее наступает утомляемость
•у здоровых гормоны н/п увеличивают сократительную способность сердца
•гидрокортизон потенциирует кардиотонический эффект катехоламинов – м/б обусловлено способность адренокортикостероидов угнетать механизмы захвата катехоламинов
Гормоны щ/ж.
Увеличивают сократительную способность миокарда. Гипертиреоз -> уведичение скорости гидролиза АТФ и поглощения внутриклеточного Са2+ саркоплазматическим ретикулумом. Гипотиреоз – обратный эффект.
+увеличивают синтез белков в сердце – гипертрофия
+влияют на миозиновые изоферменты, увеличивая их при наибольшем уровне активности АТФазы – увеличение сократительной способности Гиперфункция – интенсификация обмена веществ в организме (косвенный механищм) – расширение артериол –
снижение общего периферического сопротивления – увеличение сердечного выброса.
Инулин. Выраженное прямое положительное инотропное влияние. Гипогликемия предотвращается введением глюкозы И КОГДА блокированы бета-адренэргические рецепторы. Положительное инотропное действие усиливается антагонистами бета-адренорецепторов.
Глюкагон. Положительные ино- и хронотропное влияния. Клинически используется для усиления сердечной деятельности, в норме не играет роли.
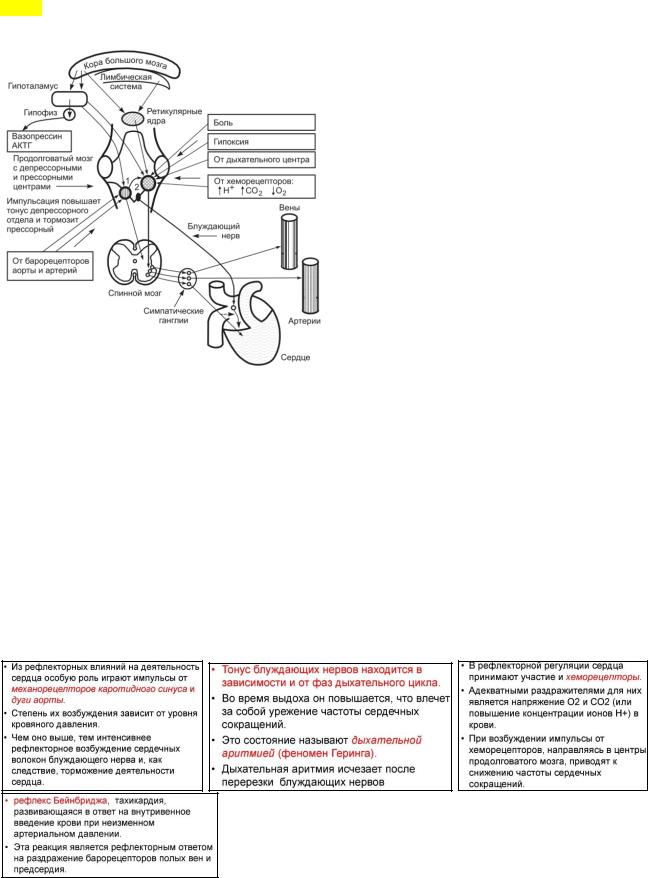
СРС 1. Приведите примеры рефлекторного изменения частоты сердечных сокращений у человека.
1 - денрессорный отдел сосудодвигательного центра; 2 - прессорный отдел сосудодвигательного центра
Важную роль в регуляции работы сердца играют рефлекторные реакции на растяжение его полостей кровью. В частности, работа сердца рсфлекторно тормозится при растяжении стенок предсердий, в которых имеются механорецепторы A-типа. Эти рецепторы реагируют на возрастание давления крови в предсердиях, вызывающее увеличение напряжения миокарда предсердий. В предсердиях и желудочках имеются механорецепторы В-типа, активирующиеся при растяжении миокарда, вызываемого увеличением объема и давления крови. В миокарде есть также болевые рецепторы, инициирующие сильные боли при недостаточной доставке кислорода к миокарду (боли при стенокардии, инфаркте). Перечисленные рецепторы реагируют на раздражение посылкой большего числа нервных импульсов в ЦНС по афферентным волокнам блуждающего и веточек симпатических нервов.
Рефлекс Ашнера {глазо-сердечный рефлекс) вызывается легким надавливанием на глазные яблоки. Это воздействие приводит к замедлению частоты сердечных сокращений. В состав рефлекторной дуги рефлекса Ашнера входят рецепторы давления, тактильные, болевые и другие рецепторы роговицы, склеры, конъюнктивы, сетчатки и других тканей глаза, образованные дендритами униполярных чувствительных нейронов, тела которых расположены в полулунном (гассеровом) узле. Их сигналы, возникающие при надавливании на глазные яблоки, передаются в ЦНС по афферентным нервным волокнам глазной ветви тройничного нерва.
Аксоны чувствительных нейронов следуют в составе тройничного нерва до уровня 2-го и 3-го шейных сегментов спинного мозга к нейронам одноименного ядра, которые связаны с нейронами ядра блуждающего нерва и другими ядрами ствола мозга. Активация нейронов ядра блуждающего нерва при надавливании на глазные яблоки вызывает рефлекторное замедление сокращений сердца.
Очень сильное тормозное влияние на работу сердца оказывает рефлекс Гольца, вызываемый поколачиванием по брюшной стенке. При этом происходит раздражение рецепторов растяжения и давления в структурах желудка, кишечника, желчного пузыря и других органов брюшной полости. Повышение тонуса ядер блуждающего нерва под влиянием раздражения этих рецепторов может быть столь сильным, что вызовет опасную остановку сердца. Это одна из причин запрета ударов ниже пояса в спортивных состязаниях.
Внутрисердечные рефлекторные влияния проявляются в изменении силы сердечных сокращений, изученных и описанных Г. И. Косицким. Растяжение мышцы одного из отделов сердца приводит к изменению силы сокращения миокарда другого отдела, гемодинамически с ним разобщенного. Например, при растяжении правого предсердия наблюдается усиление работы левого желудочка.
Изменения работы левого желудочка связаны рефлекторно с величиной давления в аорте. Растяжение правого предсердия сопровождается усилением сокращения мышц левого желудочка только в том случае, если диастолическое давление в аорте будет равным 7,98—10,64 кПа (60—80 мм рт. ст.). При более высоком давлении в аорте [15,96—18,62 кПа (120— 140 мм рт. ст.)] растяжение правого предсердия приводит к ослаблению сокращения мышц левого желудочка.
Рефлекс Бейнбриджа является примером рефлекторных влияний на деятельность сердца.
Разнообразные рефлекторные воздействия на деятельность сердца осуществляются через вегетативную нервную систему.
В стенках сосудов располагаются многочисленные рецепторы, реагирующие на изменения величины артериального давления и химического состава крови. Особенно много рецепторов имеется в области дуги аорты и сонных (каротидных) синусов (расширенная часть артериального русла в области бифуркации общей сонной и начала внутренней сонной артерии). При уменьшении артериального давления происходит возбуждение этих рецепторов и импульсы от них поступают в продолговатый мозг к ядрам блуждающих нервов. Под влиянием нервных импульсов снижается возбудимость нейронов ядер блуждающих нервов, усиливается влияние симпатических нервов на сердце, в результате чего частота и сила сердечных сокращений увеличиваются, что является одной из причин нормализации величины артериального давления.
При увеличении артериального давления нервные импульсы рецепторов дуги аорты и сонных синусов усиливают активность нейронов ядер блуждающих нервов. В результате замедляется ритм сердца, ослабляются сердечные сокращения, что также является причиной восстановления исходного уровня артериального давления. Таким образом, рефлекторное изменение деятельности сердца в ответ на раздражение рецепторов дуги аорты и сонных синусов (изменение величины артериального давления) является одним из элементов механизма само регуляции.
Возбуждение рецепторов внутренних органов, если оно достаточно сильное, может изменить деятельность сердца. В 60-х годах XIX века немецким физиологом Гольтцем было описано рефлекторное уменьшение частоты сердечных сокращений при раздражении интерорецепторов кишечника или желудка. При легком поколачивают по кишечнику или желудку лягушки Гольтц наблюдал резкое угнетение деятельности сердца вплоть до ее прекращения.
Рефлекторная дуга этого рефлекса начинается рецепторами внутренних органов, от которых нервные импульсы поступают по чревному нерву через узлы симпатической цепочки и соединительные веточки в спинной мозг; по спинному мозгу возбуждение достигает центра блуждающих нервов в продолговатом мозге. Под влиянием пришедших нервных импульсов резко увеличивается активность нейронов ядер блуждающих нервов, что приводит к уменьшению частоты сердечных сокращений.
Деятельность сердца рефлекторно может измениться при возбуждении рецепторов слуха, зрения, рецепторов слизистых оболочек и кожи. Сильные звуковые и световые раздражения, резкие запахи, температурные и болевые воздействия могут обусловить изменения в деятельности сердца.

СРС 2. Как и почему изменяется частота сердечных сокращений при наложении лигатур Станниуса?
Станниус предложил способ демонстрации в эксперименте на лягушках деятельности проводящей системы путем поперечных перевязок сердца ниткой (лигатурой). У лягушки сердце имеет желудочек и 2 предсердия. В месте впадения вен образуется венозный синус, в его стенке располагается водитель ритма. Первая лигатура накладывается между венозным синусом и предсердием. После этого венозный синус продолжает сокращаться в прежнем ритме, а предсердия и желудочек некоторое время не сокращаются, так как синоатриальный узел является водителем ритма для миокарда в целом. Через 30-40 секунд сокращения желудочка и предсердий возобновляются, но с собственной частотой, меньшей, чем частота сокращений венозного синуса (т.к. это вторичный водитель ритма). Иногда возобновление происходит только после стимуляции этой области сержца.
Если наложить 2-ю лигатуру на атрио-вентрикулярную борозду, то предсердия сокращаются в ритме синусного узла, а желудочки в более редком ритме атрио-вентрикулярного. Это доказывает, что атрио-вентрикулярный узел обладает автоматизмом, но менее выраженным, чем у синусного узла. При этом возбудимость и сократимость верхушки сердца не нарушаются — в ответ на раздражение (укол иголкой) происходит сокращение.
Если наложить лигатуру на верхушку сердца, то дистальнее лигатуры миокард несокращается, так как там нет клеток проводящей системы.
В обычных условиях автоматия всех нижерасположенных участков проводящей системы подавляется более частыми импульсами, поступающими из синоатриального узла. В атриовентрикулярном узле импульсы возникают с частотой 40–50 в минуту, в пучке Гиса — 30–40, в волокнах Пуркинье — примерно 20 в минуту. Ритм синоатриального соответствует норм. ЧСС (60-100 в мин)
Чем дальше располагаются элементы проводящей системы от синоатриального узла, тем ниже частота генерируемых этим участком проводящей системы ПД, меньше их автоматизм. Это явление называется градиентом автоматии и известно как закон градиента Гаскелла. Водителем ритма для сердца в норме является синоатриальный узел, т. е. частота сердечных сокращений определяется частотой генерации импульсов этим узлом. В этом случае все остальные образования выполняют только проводящую функцию. При повреждении проводящей системы структуры миокарда, не потерявшие связь с синоатриальным узлом, сокращаются с частотой генерируемых им ПД. Ближайший к месту повреждения дистальный участок проводящей системы берет на себя функцию водителя ритма. Однако частота сокращений этих участков миокарда будет ниже в связи с тем, что частота выработки потенциалов падает в дистальных отделах проводящей системы.
Опыты показывают, что участки сердечной мышцы, ответственные за ее самовозбуждение (очаги автоматии), имеют ограниченную локализацию и находятся, в частности, в правом предсердии, а также на границе предсердий и желудочков.
На картинке – сердце лягушки, оно отличается и здесь немного по-другому лигатуры накладываются. Конкретно здесь изолируют синус от предсердия, затем предсердие, затем разделяют лигатурами верхушку и желудочек. Выше было описано, как если бы не было лигатуры в кружочках (тогда бы ритм предсердия был такой же, как ритм синуса).
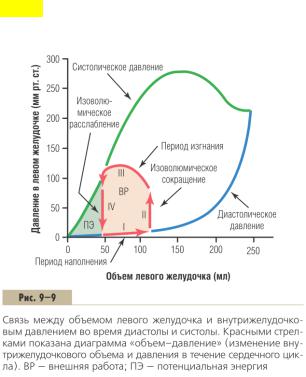
СРС 5. Рабочая диаграмма левого желудочка в координатах «давление-объем». Ударный объем и фракция выброса.
ГРАФИЧЕСКИЙ АНАЛИЗ НАСОСНОЙ ФУНКЦИИ ЖЕЛУДОЧКОВ
Ударный объем = систолический объем. 65-70 мл в покое.
Фракция выброса - это показатель доли крови, в процентном выражении, выбрасываемой из сердца в аорту во время каждого сокращения. Обычно, в покое здоровое сердце при сокращении выбрасывает 50-70% находящейся в нём крови. У многих людей, страдающих сердечной недостаточностью, фракция выброса - менее 40%.
ФВ = УО / КДО * 100%
На рис. 9–9 представлена диаграмма, которая помогает понять механизм насосной функции левого желудочка. Особое значение имеют две кривые, обозначенные «диастолическое давление» и «систолическое давление».
Это так называемые кривые «объем–давление».
Диастолическое давление измеряется перед самым началом сокращения желудочка, каждый раз в условиях все большего объема крови, наполняющей сердце. Этот показатель
называют конечно-диастолическим давлением желудочка.
Систолическое давление регистрируется во время сокращения желудочков также при разном уровне наполнения его кровью.
При увеличении объема желудочка до 150 мл диастолическое давление существенно не меняется. Это значит, что наполнение желудочка кровью происходит легко, без значимого сопротивления. Наполнение желудочка кровью объемом более 150 мл приводит к увеличению диастолического давления. Это связано с ограниченной способностью желудочка растягиваться: с одной стороны, в состав стенки желудочка входит малорастяжимая фиброзная ткань, а с другой — сердце окружено перикардом, заполненным несжимаемой жидкостью.
Во время сокращения желудочка систолическое давление растет даже при незначительном увеличении объема крови и достигает максимальной величины при объеме 150–170 мл.
Дальнейшее увеличение объема крови в желудочке приводит к снижению систолического давления, как показано на рис. 9–9. Это связано с перерастяжением миокарда, при котором актиновые и миозиновые филаменты в миофибриллах расходятся слишком далеко и взаимодействуют слишком слабо.
Интересно, что максимальный уровень систолического давления в левом желудочке здорового человека находится между 250 и 300 мм рт. ст. (см. рис. 9–9) и зависит от иннервации. В правом желудочке максимальный уровень систолического давления находится между 60 и 80 мм рт. ст.
