
Нормальная физиология / КР5 по сердцу
.pdf
Вопрос 11. Миогенные механизмы саморегуляции деятельности сердца, их физиологическое значение.
Миогенные механизмы саморегуляции сердца обеспечивают соответствие сердечного выброса венозному возврату и его постоянство при изменении давления в аорте. Выделяют механизмы гетерометрической и гомеометрической саморегуляции.
1.ИЗМЕНЕНИЕ ВЕЛИЧИНЫ СИЛЫ СС
2.ИЗМЕНЕНИЕ СЕРДЕЧНОГО ВЫБРОСА
СИЛА СОКРАЩЕНИЙ ЗАВИСИТ ОТ ИСХОДНОЙ ДЛИНЫ КАРДИОМИОЦИТОВ – ГЕТЕРОМЕТРИЧЕСКАЯ РЕГУЛЯЦИЯ РАВНОВЕСИЕ СЕРДЕЧНОГО ВЫБРОСА И ВЕНОЗНОГО ПРИТОКА К СЕРДЦУ
НЕ ЗАВИСИТ – ГОМЕОМЕТРИЧЕСКАЯ РЕГУЛЯЦИЯ
ЗАКОН ФРАНКА-СТАРЛИНГА (ЗАКОН СЕРДЦА, ГЕТЕРОМЕТРИЧЕСКАЯ РЕГУЛЯЦИЯ)
ГЕТЕРОМЕТРИЧЕСКАЯ = СИЛА СОКРАЩЕНИЯ ЗАВИСИТ ОТ ИСХОДНОЙ ДЛИНЫ МЫШЕЧНЫХ ВОЛОКОН (работа сердца изменяется при действии внешних факторов, изменяющих длину сердечной мышцы) ОБЕСПЕЧИВАЕТ -> СЕРДЕЧНЫЙ ВЫБРОС=ВЕНОЗНЫЙ ВОЗВРАТ
ПРИ ВОЗРАСТАНИИИ КДО И ДАВЛЕНИЯ В ЖЕЛУДОЧКЕ ПОВЫШАЕТСЯ УДАРНЫЙ ОБЪЕМ СЕРДЦА
ЧЕМ БОЛЬШЕ СТЕПЕНЬ РАСТЯЖЕНИЯ МИОКАРДА ОБЪЕМОМ ПРИТЕКАЮЩЕЙ КРОВИ ТЕМ БОЛЬШЕ СИЛА СОКРАЩЕНИЯ СЕРДЕЧНОЙ МЫШЦЫ
УВЕЛИЧЕНИЕ ОБЪЕМА КРОВИ В ЖЕЛУДОЧКАХ ИНТЕНСИФИЦИРУЕТ ИХ СОКРАЩЕНИЕ.
ПРИ ПОСТУПЛЕНИИ ИЗБЫТОЧНОГО ОБЪЕМА КРОВИ ВОЛОКНА РАСТЯГИВАЮТСЯ И НИТИ АКТИНА И МИОЗИНА ЗАНИМАЮТ ОПТИМАЛЬНОЕ ДЛЯ РАЗВИТИЯ БОЛЬШЕЙ СИЛЫ СОКРАЩЕНИЯ ПОЛОЖЕНИЕ ДРУГ ОТНОСИТЕЛЬНО ДРУГА
ПРЕДНАГРУЗКА=ОБЪЕМ КРОВИ В ЖЕЛУДОЧКАХ К КОНЦУ ДИАСТОЛЫ/ОБЪЕМ КРОВИ, НАХОДЯЩИЙСЯ В ЖЕЛУДОЧККАХ ПРЯМО ПЕРЕД СОКРАЩЕНИЕМ.
ПОСТНАГРУЗКА – ДАВЛЕНИЕ, НЕОБХОДИМОЕ ДЛЯ ТОГО, ЧТОБЫ ПРЕОДОЛЕТЬ ДАВЛЕНИЕ КРОВИ В АОРТЕ. ИЛИ ДАВЛЕНИЕ, НЕОБХОДИМОЕ ДЛЯ ОТКРЫТИЯ АРТАЛЬНОГО КЛАПАНА.
ЗАКОН ФРАНКА-СТАРЛИНГА
1.ИЗМЕНЕНИЕ ОБЪЕМА ЦИРКУЛИРУЮЩЕЙ КРОВИ НА ФОНЕ ВОЗРАСТАНИЯ ВЕНОЗНОГО ПРИТОКА
2.МОБИЛИЗАЦИЯ РЕЗЕРВА ДЕПОНИРОВАННОЙ КРОВИ В УСЛОВИЯХ ФИЗИЧЕСКОЙ НАГРУЗКИ
3.ПРИ ПЕРЕХОДЕ ИЗ ГОРИЗОНТАЛЬНОГО ПОЛОЖЕНИЯ В ВЕРТИКАЛЬНОЕ И ОБРАТНО
4.ПОДДЕРЖАНИЕ СООТВЕТСТВИЯ ВЕЛИЧИНЫ СЕРДЕЧНОГО ВЫБРОСА ПРАВОГО И ЛЕВОГО ЖЕЛУДОЧКОВ СЕРДЦА
В интактной системе кровообращения изменения насосной функции сердца, обусловленные механизмом Франка-Старлинга, происходят в следующих условиях:
1)При изменениях венозного возврата в ответ на сдвиги объема циркулирующей крови (избыточное поступление жидкости или, напротив, ее потеря при усиленном потоотделении).
2)На фоне возрастания венозного притока при мобилизации резерва депонированной крови при физических нагрузках. В результате окклюзии вен окружающими скелетными мышцами, благодаря наличию клапанов в стенках последних, дополнительное количество крови проталкивается по направлению к сердцу.
3)При сдвигах венозного возврата крови к сердцу в условиях ортостатического и антиортостатического воздействий на систему кровообращения. Так, при переходе из горизонтального положения в вертикальное у человека в нижнюю половину тела, преимущественно в бассейн нижней полой вены, перемещается около 500 мл крови. Происходящее при этом снижение венозного притока к сердцу приводит к уменьшению силы сокращений и почти двукратному снижению величины ударного объема.
4)При увеличении тонуса вен под действием катехоламинов, например в условиях эмоционального напряжения, что приводит к увеличению центрального венозного давления, увеличению венозного притока и мобилизации дополнительного объема депонированной крови.
5)При поддержании соответствия величин сердечного выброса правого и левого желудочков сердца. При изменениях положения тела человека в пространстве, физических нагрузках приток крови по венам к правому сердцу может вначале не соответствовать притоку крови к левому сердцу в силу сдвигов легочной гемодинамики. Поэтому гетерометрический механизм ауторегуляции сердца участвует в согласовании величин венозного возврата к правому сердцу и кровотока в легочной артерии с величиной притока крови по венам малого круга и сердечного выброса левого желудочка, что предотвращает опасность развития отека легких.
6)При компенсации пороков сердца при дефектах клапанного аппарата.
Например, при пролапсе митрального клапана происходит выворачивание створок клапана в левое предсердие. Поэтому во время систолы желудочка часть крови перемещается в предсердие. Поскольку к обычному объему крови, поступающему из легочных вен, прибавляется часть крови, поступившая из желудочка, то кровенаполнение предсердия и давление в нем увеличивается. По механизму Франка-Старлинга сила сокращений миокарда левого предсердия возрастает. В результате во время диастолы из переполненного кровью предсердия в левый желудочек поступает больший, чем в норме, объем крови. Левый желудочек также переполняется, растягивается и по механизму Франка-Старлинга увеличивает свою работу. Усиленная работа левого желудоч ка длительно (до 20– 30 лет) компенсирует пролапс митрального клапана, то есть обеспечивает оптимальную величину сердечного выброса не только в покое, но и при физических нагрузках.
ЭФФЕКТ АНРЕПА (ГОМЕОМЕТРИЧЕСКАЯ РЕГУЛЯЦИЯ)
гомеометрическая – сила сердечных сокращений не зависит от исходной длины мышечных волокон
УВЕЛИЧЕНИЕ ДАВЛЕНИЯ В АОРТЕ ВЕДЕТ К УВЕЛИЧЕНИЮ СИЛЫ СЕРДЕЧНЫХ СОКРАЩЕНИЙ
1. ТРОФИКА МИОКАРДА ЧЕРЕЗ КОРОНАРНУЮ СИСТЕМУ – УВЕЛИЧЕНИЕ СИЛЫ СОКРАЩЕНИЯ
2. ПОВЫШЕНИЕ ДАВЛЕНИЕ В АОРТЕ - УВЕЛИЧЕНИЕ КСО ЛЖ. ОБЪЕМ ВЕНОЗНОГО ВОЗРАТА ПРИ ЭТОМ ПОСТОЯНЕН. КРОВЕНАПОЛНЕНИЕ СЕРДЦА К КОНЦУ ПОСЛЕДУЮЩЕЙ ДАСТОЛЫ ВОЗРАСТАЕТ. ДАЛЕЕ
– РЕАЛИЗАЦИЯ ЗАКОНА ФРАНКА-СТАРЛИНГА
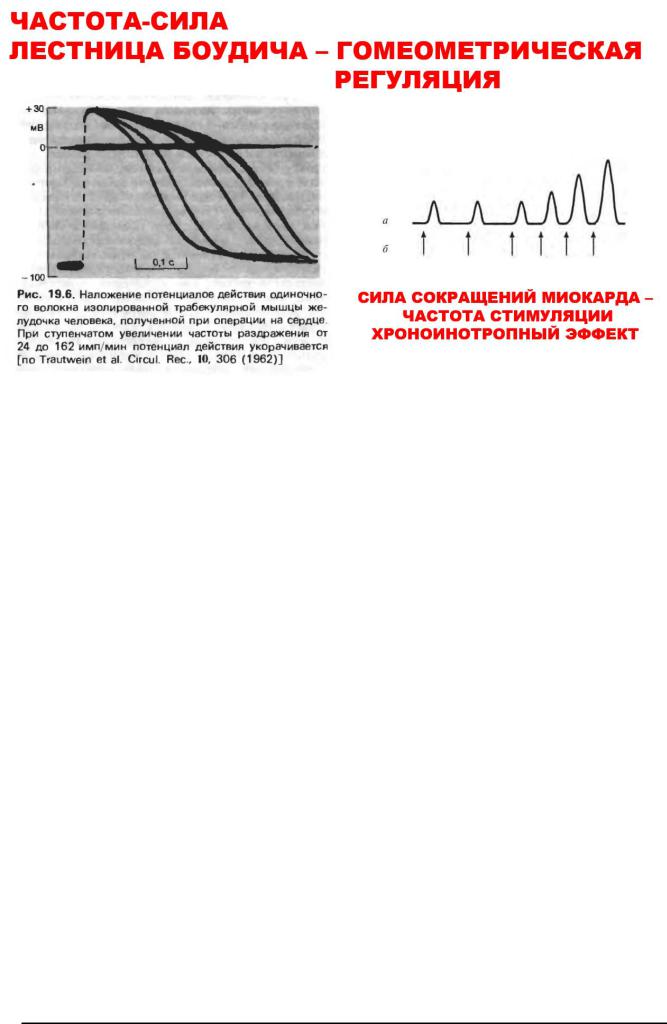
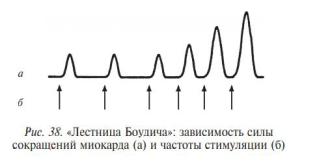
Разновидностью гомеометрической регуляции сердца следует, возможно, считать и так называемые хроноинотропные эффекты сердца в ответ на его электрическую стимуляцию в эксперименте, которые представляют собой зависимость силы сокращения сердца от частоты импульсов. В зависимости от условий лабораторного эксперимента при постоянной длине волокон миокарда повышение силы сердечных сокращений отмечено как при увеличении (восходящая «лестница Боудича»), так и при снижении (нисходящая «лестница Вудвортса») частоты стимуляции.
Кроме лестницы Боудича в физиологической литературе известен также феномен постэкстрасистолической потенциации, когда после экстрасистолы — внеочередного возбуждения и сокращения сердца — при последующем очередном сокращении его сила возрастает на фоне постоянной длины волокон миокарда. Механизм феномена постэкстрасистолической потенциации окончательно не установлен. Но нельзя исключить, что он обусловлен процессами перераспределения ионов кальция внутри кардиомиоцитов, а также повышением чувствительности сократительных белков к ионам кальция.
Таким образом, миогенные механизмы регуляции деятельности сердца могут обеспечивать изменения величины сердечного выброса и силы сокращений в зависимости от изменений пред- и постнагрузки. Существенное значение эти феномены приобрели в практической медицине в связи с проблемой трансплантации сердца. Так, у людей с пересаженным и лишенным нормальной иннервации сердцем в покое величина сердечного выброса соответствует нижней границе нормы. В условиях физических нагрузок имеет место двукратное увеличение сердечного выброса при возрастании ударного объема сердца более чем на 40 %. У собак после денервации сердца величина сердечного выброса в покое соответствует таковой у животных с интактным, иннервированным сердцем. При физической нагрузке величина сердечного выброса хотя и возрастает у них практически в такой же степени, как у интактных животных, но более медленно. Быстрые изменения деятельности сердца в ответ на функциональные нагрузки возможны только при участии нейрогенных механизмов ее регуляции. Однако нервные механизмы, хотя и исключительно важны для регуляции деятельности сердца, но являются модулирующими по отношению к миогенным механизмам.
Нейрогенные эффекты:
•ХРОНОТРОПНЫЙ – ИЗМЕНЕНИЕ ЧСС В РЕЗУЛЬТАТЕ ИЗМЕНЕНИЯ ЧАСТОТЫ ГЕНЕРАЦИИ ПД КЛЕТКАМИ ВОДИТЕЛЯМИ РИТМА СА (адресован водителям ритма)
•ИНОТРОПНЫЙ – ИЗМЕНЕНИЕ СИЛЫ СОКРАЩЕНИЯ СЕРДЦА/СОКРАТИМОСТИ МИОКАРДА (рабочим кардиомиоцитам)
•БАТМОТРОПНЫЙ – ИЗМЕНЕНИЕ ВОЗБУДИМОСТИ КАРДИОМИОЦИТОВ
•ДРОМОТРОПНЫЙ – ИЗМЕНЕНИЕ СКОРОСТИ ПРОВЕДЕНИЯ ЧЕРЕЗ АВ-УЗЕЛ/ИЗМЕНЕНИЕ СКОРОСТИ ПЕРЕДАЧИ ВОЗБУЖДЕНИЯ В МИОКАРДЕ/ИЗМЕНЕНИЕ ДЛИТЕЛЬНОСТИ ФАЗ СЕРДЕЧНОГО ЦИКЛА (элементы проводящей системы)
•ЛЮЗИТРОПНЫЙ – ИЗМЕНЕНИЕ СКОРОСТИ РАССЛАБЛЕНИЯ
•ТОНОТРОПНЫЙ – ИЗМЕНЕНИЕ СТЕПЕНИ НАПРЯЖЕНИЯ МИОКАРДА ПРИ ЕГО СОКРАЩЕНИИ/РАССЛАБЛЕНИИ
закон Франка-Старлинга - сила сокращения сердца в систолу пропорциональна его наполнению в диастолу, или сила сокращения волокон миокарда является функцией от их конечно-диастолической длины.
Механизм гетерометрической саморегуляции состоит в том, что при растяжении мышцы увеличивается количество свободных активных центров актина и улучшаются условия электромеханического сопряжения.
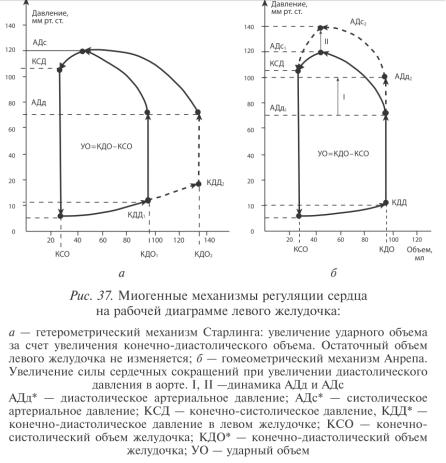
Анализ зависимости Франка—Старлинга удобно проводить по диаграмме в координатах «объем — давление». При возрастании конечно-диастолического объема и давления в левом желудочке повышается и ударный объем сердца. Принципиально важно, что при этом остаточный, или конечно-систолический, объем не уменьшается, что свидетельствует об отсутствии сдвигов инотропного состояния миокарда, то есть его сократимости. В то же время гетерометрический механизм обеспечивает равновесие сердечного выброса и венозного притока к сердцу, что является необходимым условием нормального кровообращения.
Гомеометрическая саморегуляция. При этом виде саморегуляции изменения силы сокращения сердца не связаны с изменением длины сердечной мышцы. Обеспечивает постоянство сердечного выброса при изменении давления в аорте. Экспериментальное повышение давления в аорте приводит к увеличению силы сокращения сердца (эффект Анрепа). Уменьшение давления приводит к обратному эффекту.
Объяснение эффекта Анрепа, предложенное в середине ХХ в. американским исследователем Дж. Сарновом, заключается в следующем: повышение давления в аорте сначала приводит к увеличению конечно-систолического объема левого желудочка. Поскольку венозный возврат остается постоянным, то кровенаполнение сердца к концу последующей диастолы (конечно-диастолический объем) на короткое время также возрастает. Следовательно, по механизму Франка—Старлинга увеличиваются сила сердечных сокращений, ударный объем сердца и сердечный выброс. Данное объяснение самоочевидно в гидродинамическом отношении и реализуется при увеличении сосудистого сопротивления в нормальных условиях.
Второе объяснение, предложенное непосредственно после открытия этого феномена, заключается в том, что увеличение системного артериального давления должно приводить к растяжению эластичных стенок коронарных сосудов, улучшению снабжения миокарда кислородом и, следовательно, увеличению силы сокращений. В норме реализации этого механизма препятствует гиперперфузия миокарда, благодаря которой даже выраженная на ЭКГ ишемическая болезнь сердца может не сопровождаться сердечной недостаточностью, в том числе при физических нагрузках. В этих условиях увеличение коронарного кровотока не сопровождается существенным повышением потребления кислорода кардиомиоцитами. Ситуация приобретает принципиально иной характер в условиях жесткой ишемии миокарда, приводящей к развитию сердечной недостаточности.
В этом случае повышение давления в аорте, вызывая пассивное растяжение коронарных артерий и увеличение коронарного кровотока, способствует нормализации метаболизма миокарда, его сократимости, что и обеспечивает преодоление повышенной постнагрузки. Этот механизм лежит в основе различных модификаций метода артериальной контрпульсации, которые применяются для нормализации насосной функции сердца при инфаркте миокарда, кардиогенном шоке и тяжелых формах стенокардии. Суть этого метода заключается в дозированном увеличении постнагрузки в режиме синхронизации с фазами сердечного цикла с целью принудительного увеличения коронарного кровотока.
При увеличении сократимости миокарда в ответ на увеличение постнагрузки сердца возрастает напряжение стенки левого желудочка, что приводит к ухудшению кровоснабжения субэндокардиальных слоев миокарда. На фоне хронически повышенного артериального давления развивается компенсаторная гипертрофия левого желудочка, которая, в отличие от рабочей гипертрофии миокарда при физических нагрузках, может сопровождаться даже уменьшением коронарного кровотока. Вот почему режим работы сердца против повышенного давления в физиологическом плане менее благоприятен, чем режим работы на фоне увеличенного притока. Особо
неблагоприятные условия для сократительной функции миокарда возникают при повышении давления в легочной артерии. Поскольку толщина миокарда правого желудочка составляет около 5–8 мм, то есть практически в два раза меньше, чем левого, правый желудочек не способен длительное время компенсировать свою работу в ответ на увеличение постнагрузки. В результате на фоне повышения давления в легочной артерии быстро развивается. Основы физиологии сердца декомпенсация деятельности правого сердца и сердечная недостаточность по правожелудочковому типу.
Примером этого вида саморегуляции является феномен, открытый Боудичем - лестница Боудича. При ритмической стимуляции остановившегося сердца сила сокращений в определенных пределах нарастает. В основе механизма лестницы Боудича лежит увеличение концентрации внутриклеточного кальция, и, соответственно, улучшение электромеханического сопряжения.
Кроме лестницы Боудича в физиологической литературе известен также феномен постэкстрасистолической потенциации, когда после экстрасистолы — внеочередного возбуждения и сокращения сердца — при последующем очередном сокращении его сила возрастает на фоне постоянной длины волокон миокарда. Механизм феномена постэкстрасистолической потенциации окончательно не установлен. Но нельзя исключить, что он обусловлен процессами перераспределения ионов кальция внутри кардиомиоцитов, а также повышением чувствительности сократительных белков к ионам кальция.
Таким образом, миогенные механизмы регуляции деятельности сердца могут обеспечивать изменения величины сердечного выброса и силы сокращений в зависимости от изменений пред- и постнагрузки. Существенное значение эти феномены приобрели в практической медицине в связи с проблемой трансплантации сердца. Так, у людей с пересаженным и лишенным нормальной иннервации сердцем в покое величина сердечного выброса соответствует нижней границе нормы. В условиях физических нагрузок имеет место двукратное увеличение сердечного выброса при возрастании ударного объема сердца более чем на 40 %. У собак после денервации сердца величина сердечного выброса в покое соответствует таковой у животных с интактным, иннервированным сердцем. При физической нагрузке величина сердечного выброса хотя и возрастает у них практически в такой же степени, как у интактных животных, но более медленно. Быстрые изменения деятельности сердца в ответ на функциональные нагрузки возможны только при участии нейрогенных механизмов ее регуляции. Однако нервные механизмы хотя и исключительно важны для регуляции деятельности сердца, но являются модулирующими по отношению к миогенным механизмам.

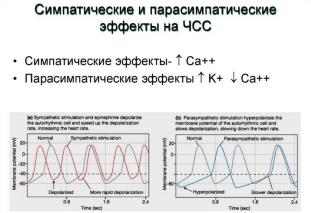
Вопрос 12. Симпатическая иннервация сердца. Медиаторы, рецепторы, эффекты и их механизмы.
oНачало – в интермедиолатеральных столбах Th(5-6) и C(6-7). Выходят из позв. столба в с-ве белых соединительных ветвей и входят в паравертебральные ганглионарные цепочки.
oПрерываются в шейно-грудном (звездчатом) или среднем шейном ганглии. В средостении постганглионарные волокна симпатических и преганглионарные волокна парасимпатических соединяются, образуя нервное
сплетение смешанных эфферентных нервов, идущих к сердцу.
oПостганглионарные волокна симп. нервов достигют основания сердца в составе адвентиции крупных сосудов. Дойдя до основания, распределяются по камерам, образуя нервное сплетение эпикарда, проходят вдоль коронарных сосудов сквозь миокард.
o Воздействие при стимуляции после прекращения стимула ослабевает постепенно.
oВо время стимуляции выделяется норадреналин, кот. захватывает нервные окончания (большую часть, остальное
– в общий кровоток)
oВ начале стимуляции влияние симпатики на сердце медленно достигает устойчивых максимальных значений, медленнее, чем наступает угнетение сердечной деятельности при стимуляции блуждающего.
oНачало ответа на стимул протекает медленно, т.к.:
→норадреналин вырабатывается медленно
→норадреналин оказывает влияние через аденилатциклазную систему вторичных посредников (Gs) o Симпатика изменяет ЧСС и проведение по АВ узлу медленнее по сравнению с блужд. нервом.
o регулирует работу сердца не осуществляет регуляцию при КАЖДОМ сокращенни в отличии от парасимп. (вагус)
Эфферентная иннервация сердца осуществляется симпатическими и парасимпатическими отделами вегетативной системы. Тела симпатических преганглионарных нейронов располагаются в боковых рогах I–V грудных сегментов спинного мозга.
Преганглионарные нервные волокна выходят из спинного мозга в составе передних корешков и в своем большинстве направляются к нейронам верхнего грудного (звездчатого) симпатического ганглия. Симпатические нейроны, участвующие в иннервации сердца, располагаются также в шейных ганглиях симпатической цепочки. Постганглионарные волокна симпатических нейронов в виде двух тонких нервов охватывают подключичную артерию (петля Виессения) и далее вместе с парасимпатическими волокнами блуждающего нерва образуют верхний, средний и нижний сердечные нервы. Справа симпатические нервы отходят от звездчатого ганглия к синоатриальному узлу, сопровождая верхнюю полую и непарную вены. Слева симпатические нервы проходят латеральнее аорты и легочной артерии, где в них вступают веточки от возвратного нерва, и обеспечивают иннервацию атриовентрикулярного узла. Большинство же эфферентных симпатических нервов, идущих к миокарду желудочков, отходят от подключичной петли Виессения, а также веточек, идущих от правого и левого звездчатых ганглиев.
Симпатические нервы распределены в миокарде желудочков в поверхностных слоях, главным образом вдоль коронарных артерий, и затем пронизывают миокард. Правые нервы иннервируют преимущественно передние
области желудочков, тогда как левые — задние. Таким образом, симпатические волокна распределены по всему мио карду и иннервируют как проводящую систему сердца, так и рабочий миокард предсердий и желудочков.
Симпатические нервы оказывают влияние на сердце посредством высвобождения нейромедиатора — норадреналина, который взаимодействует с адренорецепторами, расположенными на наружной мембране миокардиальных клеток. Наряду с норадреналином из симпатических нервных окончаний выделяются также и комедиаторы, преимущественно нейропептид Y (NPY). Последний является функциональным агонистом норадреналина.
В сердце млекопитающих и человека содержатся преимущественно β1-адренорецепторы и в меньшей степени β2- и α1-адренорецепторы. β-Адренергические рецепторы расположены на поверхности миокардиальных клеток, что делает их легко доступными как для норадреналина, высвобождающегося из симпатических нервных окончаний, так и для циркулирующего в крови адреналина. Количество β-адренорецепторов на поверхности миокардиальной клетки может изменяться в зависимости от многих факторов, в частности при повышении уровня активности симпатической нервной системы или концентрации катехоламинов в крови количество β-рецепторов уменьшается, тогда как в случае снижения симпатической активности их количество возрастает. Йодсодержащие гормоны щитовидной железы, особенно тироксин, а также гормон коры надпочечников кортизол увеличивают количество β- адренорецепторов в миокарде, что приводит к усилению эффектов катехоламинов на сердце (так называемый пермиссивный эффект). Исследованиями установлено, что клеточные механизмы, связанные с активацией как β1-, так и β2-адренорецепторов миокарда, практически одинаковы.
Катехоламины, взаимодействуя с β-рецепторами миокарда, вызывают активацию гуанилнуклеотид-связывающего протеина (Gs), который стимулирует фермент аденилатциклазу. Последняя переводит аденозинтрифосфорную кислоту (АТФ) в циклический аденозинмонофосфат (цАМФ). Повышение внутриклеточной концентрации цАМФ вызывает активацию цАМФ-зависимой протеинкиназы, которая катализирует фосфорилирование белков, в частности кальциевых каналов L-типа. Реакции фосфорилирования приводят к возрастанию входящего медленного кальциевого тока и к увеличению вследствие этого продолжительности фазы «плато» потенциала действия кардиомиоцита. В результате сократимость миокарда повышается. Важно подчеркнуть, что увеличение сократимости миокарда в ответ на возбуждение β-адренорецепторов сопровождается значительным увеличением потребления миокардом кислорода, что требует адекватного возрастания коронарного кровотока. Это обеспечивается вазодилатацией, опосредованной β2-адренорецепторами коронарных артерий. Поскольку накопление цАМФ в кардиомиоцитах вызывает увеличение входящего кальциевого тока, вследствие этого возрастает и скорость спонтанной диастолической деполяризации в клетках синусового узла, то есть увеличивается и частота сердечных сокращений. При этом уменьшается продолжительность диастолы сердца. Возбуждение β- адренорецепторов миокарда сопровождается увеличением скорости его расслабления (положительный люзитропный эффект). Поэтому на фоне тахикардии не происходит выраженного снижения кровенаполнения сердца.
Таким образом, возбуждение β-адренорецепторов сердца приводит к возрастанию частоты сокращений, сократимости миокарда, значительному увеличению потребления им кислорода и уменьшению продолжительности систолы. Для обеспечения возросших потребностей миокарда в кислороде необходимо адекватное увеличение коронарного кровотока.
Циклический аденозинмонофосфат разрушается ферментом фосфодиэстеразой. Ингибирование этого фермента некоторыми веществами, в частности кофеином, вызывает накопление цАМФ внутри кардиомиоцитов. Поэтому после приема кофе у человека возрастают частота сердечных сокращений и сократимость миокарда. Но положительные хроноинотропные эффекты сердца сопровождаются увеличением потребления миокардом кислорода. Поэтому неумеренный прием кофе (свыше 2–3 чашек в день), а особенно употребление напитковэнергетиков с высоким содержанием кофеина, вызывая тахикардию, может привести к развитию несоответствия потребностей миокарда в кислороде и величины коронарного кровотока, то есть ишемии миокарда. Поскольку возбуждение β-адренорецепторов сердца сопровождается увеличением потребности миокарда в кислороде, то в клинической кардиологии при лечении ишемической болезни сердца широко применяются β-блокаторы — препараты, блокирующие β-адренорецепторы. Селективными блокаторами β1-адренорецепторов являются, например, атенолол, метопролол, а неселективными, блокирующими как β1-, так и β2-рецепторы, — пропранолол и обзидан. Все они снижают частоту и силу сердечных сокращений, что способствует снижению артериального давления. Следует подчеркнуть, что неселективные β-блокаторы, вызывая блокаду β2-адренорецепторов бронхов, могут вызвать бронхоспазм. Кроме того, на фоне блокады β2-адренорецепторов коронарных артерий ухудшается коронарный кровоток и может развиться спазм коронарных сосудов. Поэтому в современной кардиологии неселективные β-блокаторы утратили ведущее клиническое значение. В то же время современные селективные β1блокаторы, например небилет, могут дополнительно вызывать сосудорасширяющий эффект, поскольку стимулируют синтез оксида азота эндотелиальными клетками.
Физиологические механизмы, связанные с активацией α-адренорецепторов миокарда, изучены в меньшей степе ни по сравнению с β-адренергическими. Возбуждение α1-адренорецепторов, например α-миметиком мезатоном (фенилэфрином), вызывает только увеличение сократимости миокарда, тогда как частота сердечных сокращений при этом не изменяется. Предполагается, что возбуждение α-рецепторов приводит к активации фосфолипазы-С. Этот мембранный фермент катализирует расщепление фосфолипидов сарколеммы с образованием вторичных посредников — инозитолтрифосфата и диацилглицерола, которые опосредуют внутриклеточные эффекты стимуляции α1-адренорецепторов. В частности, инозитолтрифосфат способствует выходу ионов Са2+ из саркоплазматического ретикулума, а диацилглицерол увеличивает чувствительность протеинкиназы-С к этим ионам. В свою очередь, протеинкиназа-С катализирует фосфорилирование тропонина, что повышает чувствительность миофибрилл к ионам Са2+. При этом не происходит увеличения входящего в кардиомиоцит кальциевого тока, а может, напротив, усиливаться выходящий калиевый ток, что приводит к уменьшению продолжительности фазы «плато» рабочих кардиомиоцитов. Эффекты, опосредованные α1-рецепторами миокарда, в наибольшей степени проявляются на фоне фармакологической β-адреноблокады.

Вопрос 13. Парасимпатическая иннервация сердца. Медиаторы, рецепторы, эффекты и их механизмы.
•парасимпатические волокна, инн. сердце – из дорсального ядра блуждающего нерва (продолговатый мозг) и nucleus ambiguus Х пары ЧН;
•эфферентные волокна блуждающего нерва – идут вниз по шее вблизи общих сонных артерий, через средостение, образуют синапсы с постганглионарными клетками (они либо на поверх. эпикарда, либо в толще стенок сердца)
– сердечные ганглии вблизи СА и АВ узлов.
•правый блуждающий нерв – влияние преимущественно на СА узел. Стимуляция = замедление возникновения процесса возбуждения СА-узла и может даже остановить его на несколько секунд.
•Левый – подавляет АВ-узел – предсердно-желудочкая блокада;
•эфф. волокна распределены среди различных структур и взаимно перекрываются, поэтому взаимное влияние (правый – АВ; левый – СА)
•в СА и АВ узлах большое содержание холинэстеразы, пожтому АХ из блужд. нервов быстро гидролизируется – воздействия нервов быстро прекращаются после остановки стимуляции
•АХ активирует АХ-регулируемые К+ каналы в клетках сердца. АХ действует на N-холинорецепторы.
•Сочетание короткого латентного периода блуждающего нерва и быстрого угазания ответа – регуляция при каждом сокращении;
•влияние в области СА-узла парасимпатической превосходит влияние симпатической
•активность блуждающего нерва регулирует работу сердца при каждом сердечном сокращении!
Парасимпатические нервы оказывают влияние на сердце посредством высвобождения ацетилхолина, который взаимодействует с мускариновыми холинорецепторами, расположенными на наружной мембране миокардиальных клеток. Наряду с ацетилхолином из окончаний блуждающего нерва выделяется также ряд пептидов-
комедиаторов, в частности вазоактивный интестинальный пептид (ВИП), а также соматостатин. Предполагается,
что ВИП оказывает выраженный дилатирующий эффект на коронарные артерии. На плазматической мембране кардиомиоцитов представлены в основном мускаринчувствительные (М-) холинорецепторы второго подтипа
(М2), которые могут быть заблокированы как селективным блокатором, обозначаемым в специальной литературе шифром АF-DХ 116, так и неселективным, например метацином или атропином. Плотность расположения мускариновых рецепторов в миокарде зависит от концентрации мускариновых агонистов в тканевой жидкости. Так, в присутствии М-холиномиметика карбахолина количество мускариновых рецепторов миокарда уменьшается.
Тироксин также вызывает уменьшение количества этих рецепторов в сердце. Физиологическими исследованиями доказано наличие в миокарде также и никотинчувствительных (N-) холинорецепторов, однако их значение в парасимпатической регуляции сердца остается малоизученным. Ацетилхолин, взаимодействуя с мускариновым рецептором, вызывает активацию ингибирующего гуанин-нуклеотида (Gi), который активирует фермент
гуанилатциклазу. Последняя переводит гуанозинтрифосфат (ГТФ) в циклический гуанозинмонофосфат (цГМФ).
Повышение внутриклеточной концентрации цГМФ приводит к активации ацетилхолинзависимых калиевых каналов и увеличению выходящего тока ионов калия (IK+, Ach). В результате усиления выходящего калиевого тока развивается гиперполяризация мембраны пейсмекерных клеток. Под влиянием ацетилхолина уменьшается также величина входящих кальциевых токов ICaT и Ist. В результате усиления выходящего калиевого тока и торможения входящего кальциевого тока скорость спонтанной диастолической деполяризации в пейсмекерных клетках уменьшается. Резкое усиление выходящего калиевого тока вызывает настолько выраженную гиперполяризацию мембраны, что может привести к прекращению спонтанной диастолической деполяризации пейсмекерных клеток синусового узла, то есть остановке сердца. Кроме того, под влиянием ацетилхолина возникает более ранняя реполяризация мембраны в ходе развития потенциала действия кардиомиоцита предсердия, что приводит к укорочению фазы «плато» потенциала действия и снижению сократимости миокарда предсердий. В то же время уменьшение длительности потенциала действия предсердных кардиомиоцитов приводит к уменьшению периода
рефрактерности, то есть увеличивает возбудимость предсердий. Следовательно, возбуждение мускариновых рецепторов, с одной стороны, тормозит активность пейсмекерных клеток синусового узла, а с другой — увеличивает возбудимость предсердных кардиомиоцитов. Эти два процесса могут привести к возникновению предсердных экстрасистол в случае повышения тонуса блуждающего нерва, например ночью во время сна. Таким образом, возбуждение М-холинорецепторов вызывает снижение частоты и силы сокращений предсердий, но повышает их возбудимость. Ацетилхолин угнетает проводимость в атриовентрикулярном узле. Это связано с тем, что под влиянием ацетилхолина возникает гиперполяризация клеток атриовентрикулярного узла вследствие усиления выходящего калиевого тока. Но в литературе имеются данные, согласно которым в ответ на стимуляцию блуждающего нерва может происходить парадоксальное увеличение скорости проведения возбуждения в атриовентрикулярном узле (феномен бреши). Механизмы этого явления мало изучены. Под влиянием ацетилхолина уменьшается также сократимость миокарда желудочков. Однако механизм действия ацетилхолина на миокард желудочков, по-видимому, иной, чем на миокард предсердий. Ацетилхолин способен и прямо влиять на медленный кальциевый ток, который в ответ на возбуждение М-холинорецепторов желудочков уменьшается, что приводит к снижению силы их сокращений. Под действием ацетилхолина увеличивается выходящий калиевый ток, что приводит к гиперполяризации мембраны кардиомиоцитов желудочков. Уменьшение кальциевого тока и гиперполяризация мембраны приводят к снижению возбудимости миокарда желудочков и скорости распространения возбуждения. При этом снижается частота сердечных сокращений, угнетается проводимость, сократимость миокарда, а также потребление миокардом кислорода. Возбудимость предсердий в ответ на применение ацетилхолина возрастает, тогда как возбудимость желудочков, напротив, уменьшается.
Симпато-парасимпатические взаимодействия в регуляции деятельности сердца
Основные механизмы усиления тормозных влияний блуждающих нервов на сердце при одновременном возбуждении симпатических и парасимпатических нервов: 1) постсинаптический, 2) пресинаптический, 3) интраганглионарный.
Постсинаптический механизм. Как отмечено выше, эффекты симпатических нервов на кардиомиоциты опосредованы активацией β-адренорецепторов, аденилатциклазы и накоплением цАМФ. Тормозные эффекты блуждающих нервов на сердце обусловлены активацией М-холинорецепторов, гуанилатциклазы и накоплением в кардиомиоцитах цГМФ. При одновременной стимуляции вегетативных нервов сердца в ответ на возбуждение М- холинорецепторов имеет место не только усиление активности гуанилатциклазы, но и торможение активности аденилатциклазы,что сопровождается снижением уровня цАМФ. В результате усиливаются тормозные влияния блуждающих нервов.
Пресинаптический механизм. На окончаниях симпатических нервов сердца имеются тормозные пресинаптические М-холинорецепторы, возбуждение которых тормозит выделение норадреналина. Поэтому при одновременной стимуляции эфферентных сердечных нервов ацетилхолин, высвобождающийся из окончаний блуждающего нерва, тормозит выделение норадреналина из терминалей симпатических нервов, что приводит к уменьшению симпатических влияний на сердце и усилению парасимпатических. В физиологической литературе имеются данные, согласно которым на парасимпатических терминалях располагаются тормозные α1-адренорецепторы, возбуждение которых уменьшает высвобождение ацетилхолина. Однако возбуждение норадреналином пресинаптических α2адренорецепторов, равно как и β2-адренорецепторов, расположенных на парасимпатических терминалях, напротив, усиливает выделение из последних ацетилхолина. Поэтому в условиях одновременной стимуляции парасимпатических и симпатических сердечных нервов тормозные влияния блуждающего нерва на сердце усиливаются.
Интраганглионарный механизм. Поскольку в сердце располагается большое количество (от 500 до 700) интрамуральных ганглиев, то норадреналин, выделяющийся из симпатических нервных окончаний, может активировать адренорецепторы ганглионарных нейронов. В условиях применения агониста М-холинорецепторов ацетилхолина на фоне агониста α-адренорецепторов мезатона происходит усиление отрицательных хроно- и инотропных эффектов ацетилхолина на сердце. Однако такое усиление отсутствует при одновременном применении ацетилхолина и мезатона в условиях блока ды N-холинорецепторов вегетативных ганглиев бензогексо нием. Следовательно, усиление тормозных влияний ацетилхолина на сердце при его применении одновременно с мезатоном может быть обусловлено усилением выхода эндогенного ацетилхолина в парасимпатических ганглиях сердца в результате возбуждения ганглионарных α-адренорецепторов. В случае одно временной стимуляции вегетативных нервов сердца нор адреналин, выделяющийся из симпатических нервных окон чаний, активирует α- адренорецепторы интракардиальных парасимпатических ганглиев. Это приводит к усилению выделения ацетилхолина из окончаний блуждающего нерва и, таким образом, к потенцированию его тормозных влияний на ритм сердца и сократимость миокарда. Физиологическое значение усиления тормозных влияний блуждающего нерва на сердце по мере повышения симпатической активности состоит в следующем. Во-первых, замедление частоты сердечных сокращений приводит к увеличению продолжительности диастолы и, следовательно, к большему периоду отдыха сердца. Во-вторых, удлинение диастолы вызывает увеличение кровенаполнения полостей сердца,то есть конечно-диастолического объема желудочков и по механизму Франка—Старлинга ударного объема сердца. В результате при одновременной стимуляции вегетативных нервов сердца на фоне резкого снижения частоты сердечных сокращений и сократимости миокарда величина сердечного выброса не имеет достоверных отличий от той, что наблюдается при раздельной стимуляции блуждающего нерва. При этом прирост ударного объема практически в два раза превышает его величину при стимуляции только блуждающего нерва. То есть на фоне одновременной стимуляции вегетативных нервов сердца, с одной стороны, возрастает конечно-диастолический объем желудочков, а с другой — уменьшается остаточный объем, что в результате приводит к резкому увеличению ударного объема сердца и, следовательно, эффективности его работы. Отмечено также, что активация блуждающего нерва на фоне возбуждения симпатической нервной системы уменьшает возбудимость миокарда желудочков и поэтому предотвращает развитие желудочковых экстрасистол, особенно в условиях ишемии миокарда. Одновременное влияние вегетативных нервов на сердце характеризуется преобладанием тормозных влияний блуждающего нерва, что способствует повышению эффективности работы сердца как насоса и его устойчивости к нарушениям возбудимости.

Вопрос 14. Рефлекторная регуляция деятельности сердца: собственные и сопряженные рефлексы, их значение.
Большинство рефлекторных дуг замыкаются на уровне продолговатого мозга – бульбарный сердечно-сосудистый центр – структуры ретикулярной формации в обл. комплекса блуждающего нерва:
•эффекторно-вегетативное дорзальное ядро вагуса
•эффекторно-анимальное обоюдное ядро
•чувствительное ядро одиночного пути – сходятся афферентные пути рефлексогенных зон сердечнососудистой системы
+ положительных и отрицательных хроно- и инотропных влияний на сердце со стороны:
•мезэнцефальных адренергических ядер (голубое пятно, черная субстанция)
•гипоталамуса (паравентрикулярное и супраоптическое ядра, мамиллярные тела, симпатическая и парасимпатическая области)
•лимбической системы.
•кортикальные условно-рефлекторные влияния
КАРДИАЛЬНЫЕ РЕФЛЕКСЫ
1) СОБСТВЕННЫЕ РЕФЛЕКСЫ, ВЫЗЫВАЕМЫЕ РАЗДРАЖЕНИЕМ РЕЦЕПТОРОВ СЕРДЕЧНОСОСУДИСТОЙ СИСТЕМЫ;
• Васкуло-кардиальные. Барорефлексы в ответ на изменение системного АД. Адекватность кровоснабжения организма требует соблюдения по крайней мере трех необходимых условий.
1.достаточная величина минутного объема кровообращения (3–6 л/мин с возможностью увеличения при нагрузках в 5–6 раз). Это условие обеспечивается миогенными, нейрогенными и гуморальными механизмами регуляции деятельности сердца.
2.является распределение минутного объема крови в соответствии с текущими потребностями организма. Данное условие обеспечивается местными миогенными и гуморально-метаболическими механизмами.
3.обеспечение оптимального градиента артериального давления. От этого показателя зависит линейная скорость тока эритроцитов в сосудах. Составляя в аорте 150 см/c, в капиллярном русле различных органов она снижается до 0,2–2,7 мм/c. В результате каждый эритроцит проводит в капилляре от 250 до 750 мс, что представляет собой отрезок времени, сравнимый с тем, который необходим для газообмена с окружающей тканью. Линейная скорость эритроцитов при функциональных нагрузках может быть увеличена без ущерба для газовой функции крови примерно в два раза. При дальнейшем увеличении линейной скорости крови возможно уменьшение артериовенозной разницы по кислороду, отражающее ухудшение качества кровоснабжения тканей.
Оптимальное снабжение кислородом при капиллярном давлении от 40 до 70 мм рт. ст. Для обеспечения
такого |
давления в капиллярах среднее системное артериальное давление также не должно выходить за |
рамки |
ограниченного физиологического диапазона. В результате при увеличении сердечного выброса |
в 5–6 |
раз среднее системное артериальное давление увеличивается в 1,5–1,8 раза. |
Уровень системного артериального давления зависит от интенсивности сердечной деятельности (сердечный компонент) и гидравлического сопротивления сосудистого русла (сосудистый компонент).
Закон Пуазейля (доп.):
применение закона ограничивается:
• турбулентность кровотока
• неньютоновские жидкостные свойства крови
• переменный диаметр сосудистого русла
• непостоянная вязкость крови)
Рефлекторный механизм регуляции артериального давления реализуется при участии системных артериальных баро- и хеморецепторов
У высших млекопитающих и человека основные барорецепторные зоны расположены в области дуги аорты, плечеголовной и сонной артерий (рис. 43, след стр).
Ведущую роль в обеспечении рефлекторного контроля кровообращения играют барорецепторы дуги аорты и синокаротидных зон (области разделения общих сонных артерий на внутренние и наружные). Подобные барорецепторы представляют собой медленно адаптирующиеся механорецепторы растяжения,
