
Нормальная физиология / КР5 по сердцу
.pdf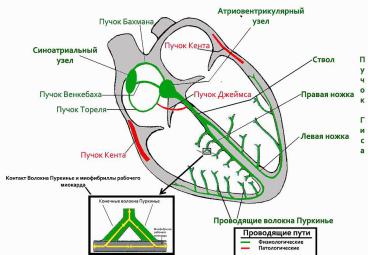
3.Предсердно-желудочковый пучок, или пучок Гиса в норме является единственным путем проведения возбуждения от предсердий к желудочкам. Он отходит от атриовентрикулярного узла общим стволом и проникает через фиброзную ткань, разделяющую предсердия и желудочки, в межжелудочковую перегородку. Здесь пучок Гиса разделяется на две ножки — правую и левую, идущие к соответствующим желудочкам, причем левая ножка делится на две ветви: передневерхнюю и задненижнюю. Эти разветвления пучка Гиса проходят под эндокардом, широко ветвятся и заканчиваются в желудочках сетью субэндокардиальных волокон Пуркинье. Основу проводящей системы желудочков (системы Гиса-Пуркинье) составляют клетки Пуркинье, связанные с сократительными кардиомиоцитами посредством Т-клеток.
Аномальные проводящие пути:
• пучок Джеймса – соединяет предсердия с нижней частью атриовентрикулярного соединения;
• пучки Кента – соединяют предсердия и желудочки
• пучок Махайма – соединяет нижние участки AN и правую ножку пучка Гиса.
Данные пути участвуют в возникновении некоторых нарушений сердечного ритма (напр., синдрома преждевременного возбуждения желудочков).
В норме возбуждение сердечной мышцы зарождается в синусовом узле, охватывает миокард предсердий и, пройдя атриовентрикулярное соединение, распространяется по ножкам пучка Гиса и волокнам Пуркинье на миокард желудочков.
Таким образом, нормальный ритм сердца определяется активностью группы Р-клеток синоатриального узла, который называют водителем ритма первого порядка, или истинным пейсмекером (pacemaker — отбивающий шаг). Такой ритм сердца называется синусовым.
Однако кроме клеток синусового узла автоматия присуща и другим структурам проводящей системы сердца. Водитель ритма второго порядка локализован в NН-зоне атриовентрикулярного соединения. Задаваемый им ритм называется идиовентрикулярным.
Водителями ритма третьего порядка являются клетки Пуркинье, входящие в состав проводящей системы желудочков. Кардиомиоциты клеток атриовентрикулярного узла и волокон Пуркинье в норме автоматию не проявляют.
Волокна проводящей системы называют субстратом автоматии сердца.
Опыт Станниуса – ритмические сокращения изолированного сердца лягушки, помещенного в раствор Рингера; сердце млекопитающих надо поместить в теплый, снабжаемый О2 р-р Рингера.
Свойства проводящей системы сердца обеспечивают:
1)автоматию сердца;
2)надежность работы сердца — при повреждении основного водителя ритма его в какой-то степени могут заменить другие отделы проводящей системы сердца, так как они тоже обладают автоматией;
3)последовательность сокращений предсердий и желудочков за счет атриовентрикулярной задержки;
4)синхронное сокращение всех отделов желудочков, что увеличивает их мощность.

Вопрос 3. Градиент автоматии. Водители ритма (пейсмейкеры) сердца.
**в литературе пейсмейкером называют либо синоатриальный узел, либо сами клетки, которые обрзуют проводящую систе, так что осторожнее!
Водители ритма распределены в сердце согласно «закону градиента автоматии»:
степень автоматии пейсмекера тем выше, чем ближе он расположен к синоатриальному узлу.
Градиент автоматии — это убывание частоты генерации возбуждения в проводящей системе сердца в направлении от предсердий к верхушке. Наличие градиента автоматии доказал Г. Станниус (1880) в опыте с накладыванием лигатур между различными отделами сердца лягушки и последующим подсчетом сокращений различных отделов сердца.
Водителем ритма сердца является синоатриальный узел. Находясь под влиянием экстракардиальных нервов, он определяет ЧСС 60—80 в 1 мин.
В случае повреждения синоатриального узла функцию водителя ритма выполняет атриовентрикулярный узел (40-50 в 1 мин), далее — пучок Гиса (30-40 в 1 мин) и волокна Пуркинье (20 в 1 мин). Активность всех нижележащих отделов проводящей системы сердца проявляется только в патологических случаях; в норме же они функционируют в ритме, навязанном им
синоатриальным узлом, поскольку частота возникающих в нем импульсов выше.
Пейсмейкеры обладают автоматией, т.е. способностью к возбуждению без воздействия раздражителя. Во время диастолы в пейсмейкерах происходит медленная спонтанная деполяризация
– повышение входящего тока Na+. (вопрос 4)
Клетки проводящей системы миокарда в желудочках характеризуются значительно меньшим количеством Т-трубочек, сократительных филаментов и митохондрий по сравнению с рабочими кардиомиоцитами, но содержат много гликогена и ферментов анаэробного энергетического обмена. Клетки проводящей системы в желудочках крупнее и больше по объему, чем рабочие кардиомиоциты, что способствует быстрому проведению возбуждения в этих структурах.
Так, собственная частота нормальной ритмической активности клеток синусового узла в покое составляет 60–80 имп./мин, атриовентрикулярного соединения — 40–60 имп./мин, системы ГисаПуркинье — 20–40 имп./мин, причем в дистальных отделах меньше, чем в проксимальных. Поэтому активность нижележащих водителей ритма в норме подавляется синоатриальным узлом. Иными словами, синусовый узел как бы навязывает свою частоту генерации импульсов водителям ритма второго и третьего порядков.
Следовательно, пейсмекерные клетки синусового узла обеспечивают синхронизацию распространения возбуждения по проводящей системе сердца к рабочему миокарду, поэтому водители ритма второго и третьего порядков называют латентными (или потенциальными) пейсмекерами. При снижении активности синусового узла или же нарушении проведения возбуждения к латентным пейсмекерам (как, например, в опыте Станниуса, СРС 2) частота возбуждений и сокращений сердца определяется активностью водителей ритма второго или третьего порядка. Кроме того, в патологических условиях электрические импульсы могут генерироваться не только клетками проводящей системы сердца, но и сократительными кардиомиоцитами.
Возникшее в синоатриальном узле возбуждение распространяется по миокарду предсердий, однако из-за асимметрии расположения синусового узла правое предсердие возбуждается раньше левого. Значение предсердных специализированных проводящих путей в этом процессе невелико, и их перерезка существенно не нарушает распространение возбуждения по миокарду, так как скорость проведения по этим путям (0,4–0,8 м/с) почти такая же, как и по сократительным кардиомиоцитам предсердий (0,1–0,2 м/с).
В атриовентрикулярном соединении (АN- и N-зоны) скорость проведения возбуждения составляет около 0,05 м/с, что является минимальной величиной по сравнению со скоростью проведения в других участках проводящей системы, а также рабочего миокарда. Поэтому при переходе
возбуждения от предсердий к желудочкам возникает задержка проведения импульса на 0,02–0,04 с. Атриовентрикулярная задержка, а также низкая скорость проведения возбуждения в предсердиях обеспечивают последовательное сокращениепредсердий и желудочков, которые начинают сокращаться только после систолы предсердий. Наличие атриовентрикулярной задержки может вызывать частичную блокаду проведения импульсов, следующих из предсердий к желудочкам с высокой частотой (более 300 в 1 мин), при мерцательной аритмии. В результате желудочки сокращаются с меньшей частотой (до 100–120 в 1 мин), что обеспечивает их удовлетворительное кровенаполнение во время диастолы.
Пройдя атриовентрикулярное соединение, электрическое возбуждение продолжает распространяться по проводящей системе желудочков и достигает их сократительных кардиомиоцитов. При этом скорость проведения возбуждения по проводящей системе и рабочему миокарду желудочков существенно различается: в пучке Гиса она составляет около 1 м/с, в волокнах Пуркинье — до 4 м/с, тогда как в сократительных кардиомиоцитах лишь около 0,5 м/с. Высокая скорость проведения импульсов по проводящей системе желудочков обеспечивает синхронное возбуждение и сокращение последних, что повышает эффективность выполнения насосной функции сердца. Особенности возбуждения рабочего миокарда желудочков состоят также в том, что сначала возбуждается межжелудочковая перегородка, далее — верхушка сердца и в конце цикла — базальные отделы желудочков. Папиллярные мышцы, образованные глубоким слоем миокарда, возбуждаются несколько раньше, чем средний и поверхностный слои миокарда желудочков, что имеет большое значение для нормальной работы атриовентрикулярных клапанов. Такие особенности распространения возбуждения в миокарде желудочков обусловлены взаиморасположением пучка Гиса и волокон Пуркинье. Общее время охвата миокарда желудочков возбуждением составляет около 5–10 мс. Нарушение распространения возбуждения по пучку Гиса, что может иметь место, например, при инфаркте миокарда, часто приводит к десинхронизации сократительных кардиомиоцитов и снижению скорости проведения возбуждения в рабочем миокарде. В результате резко (до 50 %) снижается сократимость миокарда и насосная функция сердца.

ВВЕДЕНИЕ В ВОПРОСЫ 4 и 5 (для повторения, не обязательно, но обратите внимание на желтое!)
повторить свойства ионных каналов, механизмы мембранного потенциала покоя (МПП), механизмы потенциала действия (ПД) и др. понятия КР1
Свойства миокарда:
возбудимость — способность отвечать на действие раздражителей возбуждением в виде электрических импульсов; проводимость — способность проводить возбуждение от клетки к клетке без затухания;
автоматия (автоматизм) — способность генерировать электрические импульсы в отсутствие внешних раздражителей, — обеспечиваются трансмембранны ми ионными токами, движущимися как внутрь клетки (входящие токи), так и из нее (выходящие токи); рефрактерность — неспособность к тетаническому сокращению, которая обеспечивает периодичность фаз сердечного цикла и пульсирующий характер кровотока.
NB: Методика точечной фиксации мембранного потенциала (МП) и регистрации тока через одиночные ионные каналы – patch clamp. Было установлено, что активация (открытие) и закрытие ионных каналов представляют собой вероятностный процесс, поскольку у каждого канала имеется свой порог открытия. Некоторые ионные каналы могут проводить токи как внутрь клетки, так и из нее, то есть в различных направлениях.
В кардиомиоцитах были обнаружены несколько подтипов калиевых и натриевых каналов, различные виды каналов для ионов кальция и хлора. Основные типы ионных каналов миокардиальных клеток:
I.Каналы для ионов К + :
a.Потенциалзависимые:
1.Каналы входящего прямого К + тока (inward rectifier — входящие выпрямляющие), IK+1, способны проводить ионы калия внутрь клетки при изменении потенциала мембраны. Однако в основном эти каналы обеспечивают выходящий ток, то есть движение ионов калия из клетки, в результате чего возникает мембранный потенциал покоя.
Блокируются ионами бария Ba 2+ и цезия Cs + .
2.Быстро инактивируемые каналы выходящего K + -тока (transient outward — быстро выводящие), Ito . Эти каналы по скорости прохождения через них ионов калия разделяются на два подвида: быстрые (fast), I to, f , и медленные (slow), I to, s .
3.Каналы задержанного выходящего тока (delayed rectifier — задержанные выпрямляющие), IK+ . Разделяют на три подвида:
•медленно активируемые (I KS )
•быстро активируемые (I KR )
•сверхбыстро активируемые (I KUR ).
4.Кальций-регулируемые калиевые каналы, I K+,Ca2+
b.Лиганд-активируемые калиевые каналы выходящего тока:
1.Ацетилхолин-зависимые, I K+, Ach .
2.АТФ-активируемые, I K+, ATP .
II.Каналы для ионов Nа + — потенциалзависимые. Эти каналы по скорости прохождения через них ионов натрия в клетку разделяются на два подвида:
1.Быстрые, блокируемые тетродотоксином, открытие которых формирует входящий ток I Na+.
2.Гиперполяризационно-активируемые смешанные Na + / K + - каналы, открытие которых формирует входящий ток I f (funny — смешной, забавный). Обнаружены в основном в
пейсмекерных клетках синусового узла. Особенностью этих каналов является их способность к проведению ионов как натрия, так и калия при гиперполяризации мембраны.
III. Каналы для ионов Са 2+ (входящего Са 2+ -тока) — потенциалзависимые:
1.Т-тип (transient — изменчивые, быстро инактивируемые), I CaT , открываются при величине мембранного потенциала –80… –60 мВ и блокируются ионами Mg 2+ . Эти каналы обнаружены, в частности, в пейсмекерных клетках синусового и атриовентрикулярного узлов, активируются во время диастолической деполяризации.
2.L-тип (long lasting — долгодействующие), медленно инактивируемые, I CaL , открываются при величине мембранного потенциала –60… –40 мВ и блокируются верапамилом. Эти каналы проницаемы в основном для ионов Са 2+ и лишь в минимальной степени Na + (в

соотношении примерно 1000 : 1). Обнаружены в клетках рабочего миокарда, а также пейсмекерных клетках, обеспечивают входящий ток кальция во время потенциала действия. Ток через эти каналы усиливается в присутствии агонистов β- адренорецепторов, например адреналина.
3.Поддерживающие каналы входящего Ca 2+ -тока (sustained inward current — поддерживающий входящий ток), I st , сходные по свойствам с каналами L-типа. Эти каналы также обнаружены в пейсмекерных клетках синусового и атриовентрикулярного узлов, активируются во время диастолической деполяризации, блокируются антагонистом кальция
никардипином.
4.DHPR-типа — дигидропиридиновые, блокируются дигидропиридинами, обнаружены в Т- трубочках мембран рабочих кардиомиоцитов, активируются во время фазы плато потенциала действия, обеспечивая усиление входа кальция.
5.RyaR-типа (рианодиновые), модулируются растительным алкалоидом рианодином, обнаружены в мембранах цистерн саркоплазматического ретикулума (СПР) рабочих кардиомиоцитов, обеспечивают выход кальция из СПР в цитоплазму при
электромеханическом сопряжении. IV. Каналы для ионов Сl:
—неспецифические хлорные каналы I Cl ;
—кальций-активируемые хлорные каналы I Ca2+,Cl.
V. Неспецифические ионные каналы (background), I bg , могут проводить различные виды
положительно заряженных ионов (К + , Na + ) внутрь клетки при изменениях мембранного потенциала в лабораторных условиях.
VI. Механически активируемые (stretch-activated ) каналы смешанного Ca 2+ /Na + -тока активируются, например, в ответ на растяжение волокон миокарда.

Вопрос 4. Ионные мезанизмы потенциалов действия пейсмейкерных клеток.
Мембранные потенциалы клеток-водителей ритма в течение диастолы нестабильны, поскольку наблюдается самопроизвольное отклонение мембранного потенциала от максимального отрицательного уровня в сторону деполяризации — так называемая спонтанная (медленная) диастолическая деполяризация. Поэтому для этих клеток термин «потенциал покоя» не применяется, а максимальное отрицательное значение мембранного потенциала (примерно –65… –50 мВ) называется максимальным диастолическим потенциалом.
Вклетках синоатриального узла медленную диастолическую деполяризацию опосредуют три ионных тока: входящий ток Na, I f , вызванный гиперполяризацией; входящий Ca 2+ -ток, I Ca ; и выходящий K + -ток, I K .
Ввозникновении спайка (ПД) в клетках-водителях ритма происходит по большей части за счет входящего тока ионов Ca2+. КУД достигается в результате спонтанной диастолической деполяризации. Поскольку ее скорость в пейсмекерах синоатриального узла выше, чем в кардиомиоцитах атриовентрикулярного соединения и проводящей системы желудочков, то в норме эти клетки возбуждаются не спонтанно, а лишь под влиянием импульсов, поступающих от синоатриального узла.
По скорости развития фазы деполяризации ПД (классификация Крейнфилда) пейсмейкеры SN и AN, др. специализированные клетки проводящей системы – клетки с медленным ответом. В

«медленных» клетках в возникновении, а также поддержании потенциала действия основное участие принимает входящий через кальциевые каналы L-типа медленный ток I Ca2+L . Медленный ПД.
Медленный ответ: характерны меньшая амплитуда потенциала действия и скорость его распространения по сравнению с «быстрыми» клетками. Фазы деполяризации и реполяризации потенциала действия «медленных» клеток протекают более плавно, чем в «быстрых» клетках (рис. 4).
Фаза быстрой деполяризации (0) характеризуется небольшой по сравнению с «быстрыми» клетками скоростью (до 20 В/с) нарастания и обеспечивается входящим током I Са2+L .
Пороговый потенциал, при котором активируется достаточное для обеспечения этого тока количество Са2+-каналов L-типа, составляет около –40 мВ. Во время этой фазы отрицательный мембранный потенциал медленных клеток уменьшается до нуля, а затем происходит перезарядка мембраны (реверсия потенциала) до положительных значений, примерно +5… +10 мВ.
Далее следует конечная реполяризация (3). По сравнению с «быстрыми» клетками в «медленных»
клетках начальная быстрая реполяризация и фаза плато отсутствуют, а вершина потенциала действия сглажена (см. рис. 4). Величина мембранного потенциала в фазу конечной реполяризации определяется соотношением между усиливающимися выходящими токами ионов калия (I KS , I KR и I KUR ) и уменьшающимся входящим током ионов кальция (I ) на фоне медленной инактивации Са2+ -каналов L-типа. Завершается реполяризация достижением мембраной уровня максимального диастолического потенциала (–65…–50 мВ).
В пейсмекерных клетках синусового узла в результате спонтанной диастолической деполяризации
(4) мембранный потенциал достигает порогового уровня и далее генерируется очередной потенциал действия. Следует подчеркнуть, что в пейсмекерах синоатриального узла скорость спонтанной
диастолической деполяризации больше, чем в аналогичных кардиомиоцитах атриовентрикулярного соединения. Поэтому в условиях работающего сердца в пейсмекерных
клетках атриовентрикулярного соединения эта фаза прерывается импульсом, приходящим от синоатриального узла, что и обусловливает возникновение в них потенциала действия. В изолированных клетках-водителях ритма атриовентрикулярного соединения спонтанная диастолическая деполяризация, развиваясь с меньшей скоростью, чем в синусовом узле, обеспечивает достижение критического уровня деполяри зации и генерацию потенциалов действия, однако с меньшей частотой (40–60 в 1 мин), чем в синусовом узле (70–80 в 1 мин).
Исследования, проведенные с использованием методики patch-clamp, позволили установить, что
возникновение спонтанной диастолической деполяризации в клетках-водителях ритма обусловлено сложным взаимодействием различных ионных токов в результате активации ионных каналов. Считается, что в пейсмекерных клетках синусового и атриовентрикулярного узлов уменьшение мембранного потенциала от его максимальн ого отрицательного значения до критического уровня деполяризации обусловлено взаимодействием по крайней мере трех токов:
1) времязависимая задержка калиевой проводимости в результате инактивации каналов задержанного выходящего K+ -тока, которая приводит к уменьшению выходящих калиевых токов
I KS и I KR ;
2)увеличение входящего натриевого тока I f через f-каналы;
3)усиление входящего тока ионов Ca2+ (I CaT ) через каналы T-типа и «поддерживающего» кальциевого тока I st .
Можно полагать, что эти события происходят последовательно: вначале уменьшаются выходящие калиевые токи I KS и I KR , которые ранее обеспечивали фазу 3 (конечной реполяризации) потенциала действия пейсмекерной клетки; затем увеличивается входящий натриевый ток I f , и на заключительном этапе спонтанной диастолической деполяризации усиливаются входящие кальциевые токи I Ca2+T и I st . В результате мембранный потенциал клетки достигает критического уровня деполяризации (около –40 мВ), что приводит к активации кальциевых каналов L-типа, усилению входящего тока I Ca2+L и развитию фазы 0 (быстрой деполяризации) потенциала действия.
Как блокада кальциевых каналов T-типа (препарат верапамил), так и селективная блокада I f - каналов (препарат ивабрадин) приводят к снижению частоты генерации импульсов синусовым узлом и, следовательно, частоты сердечных сокращений. На этом эффекте основано применение некоторых (не всех!) антагонистов кальция для лечения аритмий. К брадикардии приводит также
усиление |
выходящего калиевого тока, например, в ответ на применение агониста М- |
холинорецепторов — ацетилхолина. Более того, резкое усиление выходящего калиевого тока вызывает выраженную гиперполяризацию мембраны и может привести к прекращению спонтанной диастолической деполяризации в пейсмекерных клетках синусового узла, то есть остановке сердца.
Эти данные доказывают роль взаимодействия торможения выходящих калиевых токов и усиления входящих — натриевого и кальциевого — в возникновении спонтанной диастолической деполяризации в пейсмекерных клетках синусового и атриовентрикулярного узлов.
Трансмембранный потенциал в покоящейся клетке намного менее негативен у клеток синоатриального и атриовентрикулярного узлов, чем у предсердных или желудочковых кардиомиоцитов. В этих условиях по крайней мере три ионных тока опосредуют медленную диастолическую деполяризацию:
(1)входящий ток I f , вызванный гиперполяризацией;
(2)входящий Ca 2+ -ток I Ca ;
(3)выходящий K + -ток I K .
Входящий ток I f (funny) активируется ближе к концу фазы реполяризации. Этот «странный» ток обеспечивается главным образом ионами Na + через специфические каналы, которые отличаются от быстрых Na + -каналов. Ток назвали «странным», потому что ранее не предполагалось наличия входящего Na + тока в пейсмекерных клетках после завершения реполяризации. Этот ток активируется по мере того, как мембранный потенциал становится более негативным, чем приблизительно –50 mV. Чем более негативен мембранный потенциал, тем больше I f .
Второй ток, ответственный за диастолическую деполяризацию, — входящий Ca 2+ -ток I Ca . Он активируется к концу фазы медленной диастолической деполяризации по мере того, как трансмембранный потенциал достигает величины примерно –55 mV. Прогрессивной диастолической деполяризации, опосредованной двумя входящими токами I f и I Ca , противодействует выходящий калиевый ток задержанного аномального выпрямления. Эта утечка K+ способствует реполяризации после нарастания потенциала действия. K + продолжает выходить наружу в течение значительного времени после максимальной реполяризации, но этот выход уменьшается на всем протяжении фазы медленной диастолической деполяризации. По мере того как этот ток уменьшается, его противодействие деполяризующим влияниям двух входящих токов (I Ca и I f ) также постепенно уменьшается.
Ионные основы автоматии в пейсмекерных клетках атриовентрикулярного узла аналогичны таковым в клетках синоатриального узла и волокнах Пуркинье желудочков, за исключением того, что в последних не участвует Ca 2+ -ток. Частота разрядов пейсмекерных клеток может варьировать при изменении степени деполяризации клетки, величины негативного диастолического потенциала или величины порога возбуждения. Когда скорость медленной диастолической деполяризации увеличивается, величина критического потенциала достигается
раньше, и частота сердечных сокращений увеличивается. Повышение порога возбуждения задерживает начало фазы деполяризации, и частота сердечных сокращений соответственно уменьшается. Аналогично, если максимальный диастолический потенциал увеличен, требуется больше времени, чтобы достигнуть порога. Если при этом крутизна фазы медленной диастолической деполяризации остается неизменной, частота сердечных сокращений уменьшается.
Проводящие кардиомиоциты предсердий и волокна Пуркинье желудочков – клетки с быстрым ответом. Быстрый ПД. Подробнее быстрый ответ см. в вопросе 5.
В изолированных клетках волокон Пуркинье спонтанная диастолическая деполяризация обусловлена в основном уменьшением выходящих калиевых токов I KS и I KR в результате инактивации K + -каналов задержанного выходящего тока, а также усилением входящего тока ионов натрия (I f ). О роли изменений силы этих токов в возникновении спонтанной диастолической деполяризации в данных клетках свидетель ствуют опыты с применением агониста М- холинорецепторов ацетилхолина и блокатора натриевых каналов лидокаина.
Применение ацетилхолина, вызывая усиление выходящего калиевого тока и в результате гиперполяризацию мембраны, приводит к выраженному уменьшению скорости спонтанной диастолической деполяризации и даже ее прекращению.
Блокада натриевых каналов лидокаином также приводит к снижению скорости спонтанной диастолической деполяризации в изолированных клетках волокон Пуркинье.
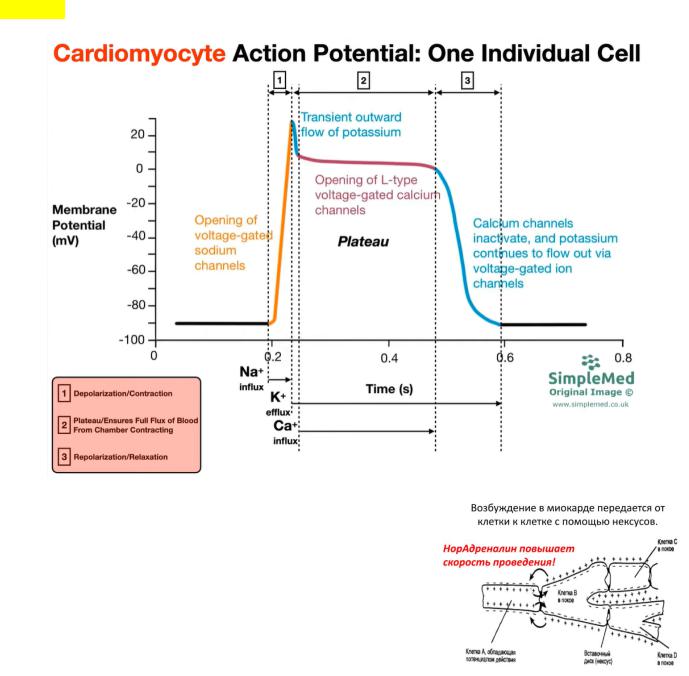
Вопрос 5. Ионные механизмы потенциалов действия рабочих кардиомиоцитов.
В сократительных кардиомиоцитах во время диастолы мембранный потенциал практически стабилен, и поэтому называется мембранным потенциалом покоя. Его происхождение в указанных клетках принципиально не отличается от генеза потенциала покоя в любых клетках как возбудимых, так и невозбудимых тканей, например эритроцитах.
МПП = –90 мВ (соответствует МПП по уравнению Нернста). Следовательно, во время диастолы именно выходящий
калиевый ток (I K+1 ) и является определяющим в формировании мембранного потенциала покоя сократительных кардиомиоцитов.
Ввозникновении спайка (ПД) происходит по большей части за счет входящего тока ионов Na+
Всократительных кардиомиоцитах в норме спонтанная диастолическая деполяризация отсутствует, и поэтому достижение критического уровня деполяризации возможно только после проведения к ним по проводящей системе импульсов от синусового узла. Однако пусковыми стимулами для возбуждения сократительных кардиомиоцитов могут явиться и внешние электрические импульсы, получаемые от искусственных водителей ритма (кардиостимуляторов), а также механическое раздражение, например сильный удар в область грудины при остановке сердца/непрямой массаж или же прямой его массаж при вскрытой грудной клетке в условиях клиники.
По Крейнфилду – клетки с быстрым ответом, быстрый ПД. В возникновении же потенциала действия клеток с быстрым ответом ведущая роль принадлежит входящему натриевому току I Na+ , протекающему через быстрые натриевые каналы. Однако для поддержания длительной (250–300 мс) деполяризации мембраны в клетках с быстрым ответом необходимы также активация кальциевых каналов L-типа и возникновение входящего тока I Ca2+L . Блокада указанных каналов приводит к
