
Нормальная физиология / КР5 по сердцу
.pdf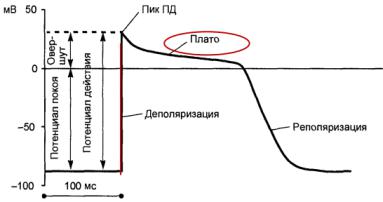
тому, что потенциал действия «быстрых» клеток становится коротким по продолжительности и сопоставим с таковым в скелетных мышцах (10–20 мс).
Быстрый ответ:
Потенциал действия возникает и нарастает, когда стимул выше порогового быстро деполяризует мембрану, активируя быстрые Na+ -каналы. Кроме высокой скорости деполяризации (до 1000 В/с) эти клетки характеризуются большой амплитудой потенциала действия, а также высокой скоростью проведения возбуждения. В потенциале действия этих клеток различают пять фаз (рис. 5).
Фаза 0 — быстрая деполяризация — обеспечивается вначале (при деполяризации мембраны до пороговой величины около –80… –70 мВ) входящим током ионов натрия (I Na+ ) в ответ на активацию «быстрых» Nа+ -каналов. Поэтому фаза быстрой деполяризации связана с входом Na+ в кардиомиоцит. Входящий Na+ -ток, осуществляемый через потенциалуправляемые Na+ -каналы, не только очень быстро активируется, но и также быстро инактивируется. Инактивация Na+ -каналов потенциалзависима и происходит, когда фаза деполяризации достигает значений от +25 до +30 мВ. Именно такая динамика входящего Na + -тока определяет практически вертикальную форму кривой фазы деполяризации потенциала действия.
Когда мембранный потенциал достигает примерно –65... –50 мВ, начинают открываться Са2+ - каналы L-типа, и к входящему натриевому току (I Na+ ) добавляется входящий кальциевый ток (ICa2+L). В результате отрицательный потенциал мембраны быстро уменьшается от –90 мВ до 0 и происходит перезарядка мембраны (реверсия потенциала) до положительных значений +20…+30 мВ. На протяжении всей фазы 0 регистрируется и выходящий ток ионов К+ (IK+L), однако сила этого тока мала по сравнению с натриевым и кальциевым токами, так как количество открытых каналов для ионов К+ в эту фазу значительно меньше, чем ионных каналов для Nа+ и Ca2+ .
Когда величина мембранного потенциала достигает примерно +20… +30 мВ, «быстрые» натриевые каналы инактивируются, и входящий Nа+ -ток практически прекращается. Входящий же ток ионов кальция (IСа2+L) при этом сохраняется, так как Са2+ -каналы L-типа инактивируются позже (в фазу 3). В результате реверсии мембранного потенциала открываются быстро инактивируемые калиевые каналы, что вызывает усиление выходящих токов ионов К+ (I to, f и I to, s ).
Фаза 1 — начальная быстрая реполяризация — происходит за счет выхода K+ через ионные каналы мембраны, проводящие транзиторный выходящий ток (Ito). Активация этих каналов вызывает кратковременный выход калия из клетки, потому что внутренняя часть клетки заряжена положительно, а внутренняя концентрация калия значительно превосходит внешнюю. В результате выхода положительно заряженных ионов клетка на короткое время частично реполяризуется. Усиление выходящих калиевых токов I to, f и I to, s на фоне меньшего по величине входящего тока ионов кальция (IСа2+L) приводит к уменьшению положительного заряда внутри клетки до +5... +10 мВ. В клетках волокон Пуркинье в эту фазу отмечена также кратковременная активация потенциалзависимых хлорных каналов, что вызывает формирование входящего тока ионов хлора (ICa2+,Cl), и поэтому начальная быстрая реполяризация происходит с большей скоростью, чем в сократительных кардиомиоцитах.
Фаза 2 — медленная реполяризация, или платó (plateau — плоскогорье). Развитие фазы плато связано с равновесием между входом в кардиомиоцит ионов Ca2+ через Ca2+-каналы и выходом ионов калия через K + -каналы нескольких видов. Фаза плато характеризуется динамическим
равновесием между входящим током ионов Са2+ (IСа2+L) и выходящими токами ионов К+ через каналы задержанного выходящего тока (IKS, IKR), что обеспечивает длительное (до 200 мс) время реверсии мембранного потенциала и продолжительность (до 300 мс) всего потенциала действия «быстрых» клеток. Особо значимой фаза 2 является для сократительных кардиомиоцитов, вкоторых входящий ток ионов кальция запускает процесс сопряжения возбуждения и сокращения. Поэтому максимальное сокращение кардиомиоцита примерно соответствует окончанию фазы плато. Кроме того, от длительности фазы плато зависит продолжительность рефрактерности рабочего миокарда.
Фаза 3 — конечная быстрая реполяризация — начинается в конце фазы плато, когда выход K+ из клетки сердца начинает превышать вход Ca2+ . Примерно через 200 мс после начала потенциала действия Са2+ -каналы L-типа практически полностью инактивируются, и входящий ионный ток IСа2+L прекращается. Сохраняющиеся же выходящие токи ионов К+ (IKS, IKR) обеспечивают возвращение мембранного потенциала к максимальному диастолическому уровню. В сократительных кардиомиоцитах левого желудочка в фазу конечной быстрой реполяризации имеет место и усиление выходящего калиевого тока (IK+, ATP) в результате активации АТФ-активируемых калиевых каналов. Таким образом, в названных клетках фаза 3 обеспечивается усилением по крайней мере трех типов выходящих калиевых токов: IKS, IKR и IK+, ATP.
Восстановление исходного состояния клетки происходит в следующем порядке. Избыток натрия, который входит в клетку в течение фазы быстрой деполяризации, удаляется Na + /K + -ATФ-азой. Этот фермент переносит 3Na+ в обмен на 2K+ , который вышел из клетки в ходе быстрой реполяризации и реполяризации. Аналогичным образом большая часть излишка кальция, который вошел в клетку в течение фазы плато, удаляется Na + /Ca 2+ -обменником, который обменивает
3Na+ на 1Ca2+ .
Фаза 4 — мембранный потенциал покоя (в сократительных кардиомиоцитах), или спонтанная диастолическая деполяризация (в изолированных клетках Пуркинье). Механизмы возникновения мембранного потенциала покоя рассмотрены выше, и в сократительных кардимиоцитах они обеспечиваются в основном выходящим током калия IK+1. В условиях патологии сердца сократительные кардиомиоциты могут также приобрести способность к спонтанной диастолической деполяризации и генерации потенциалов действия, что является одной из причин возникновения экстрасистолии и других нарушений сердечного ритма.
Потенциал действия рабочих кардиомиоцитов развивается быстро, длится до 300мс, так как имеет фазу «плато» - вход кальция уравновешен выходом калия.
Сокращение по длительности совпадает с потенциалом действия, это объясняется тем, что входящий в клетку кальций запускает сокращение.

ДОПОЛНИТЕЛЬНО:
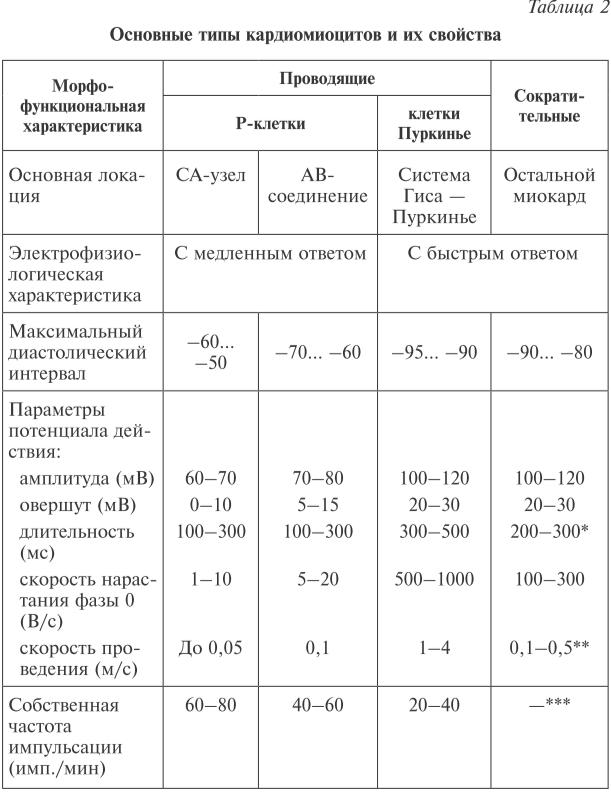
*Длительность потенциала действия в предсердиях — 100–300 мс.
**Скорость проведения в AN-зоне атриовентрикулярного соединения — около 0,05 м/с, в пучке Гиса
— меньше, чем в волокнах Пуркинье, а в сократительных миоцитах предсердий — меньше, чем в желудочках.
***Сократительные кардиомиоциты не обладают автоматией.
Вопрос 6. Внутриклеточные механизмы сопряжения возбуждения и сокращения миокарда.
Сократимость миокарда — способность мышечных волокон укорачиваться или увеличивать свое напряжение. В соответствии с теорией «скользящих нитей» (Хакскли), при сокращении миофибрилл происходит укорочение саркомера, то есть уменьшение его продольного размера вследствие активного перемещения актиновых нитей относительно миозиновых. При этом длина нитей не изменяется. Обеспечивает свойства миокарда – проводимость, возбудимость, автоматию
Актиновые нити скользят вдоль миозиновых благодаря «гребковым» движениям головок миозина. Головка прикрепляется к участку связывания на актине, потом наклоняется, вызывая укорочение саркомера, и отсоединяется от актина. Далее головка прикрепляется к следующему участку связывания на актиновой нити, и цикл повторяется. При этом сила сокращения определяется количеством связей (мостиков) между миозином и актином.
В расслабленном миокарде соединению миозина и актина препятствуют молекулы тропонина, «закрывающие» участки связывания на актиновой нити. Однако при повышении концентрации кальция в цитоплазме, что имеет место во время возбуждения кардиомиоцита, ионы кальция соединяются с тропонином С. Присоединение Са 2+ к этому белку приводит к конформационным изменениям тропонин-тропомиозинового комплекса. В результате молекулы тропомиозина смещаются, миозиновые и актиновые нити вступают во взаимодействие, и начинается процесс сокращения. Чем больше ионов Са 2+ поступит к миофибриллам при возбуждении, тем большее количество актомиозиновых мостиков будет образовываться, и тем сильнее, следовательно, будет сокращение. Таким образом, повышение концентрации ионов Са 2+ в цитоплазме кардиомиоцита является ключевым фактором, обеспечивающим электромеханическое сопряжение — связь между возбуждением и сокращением миокарда.
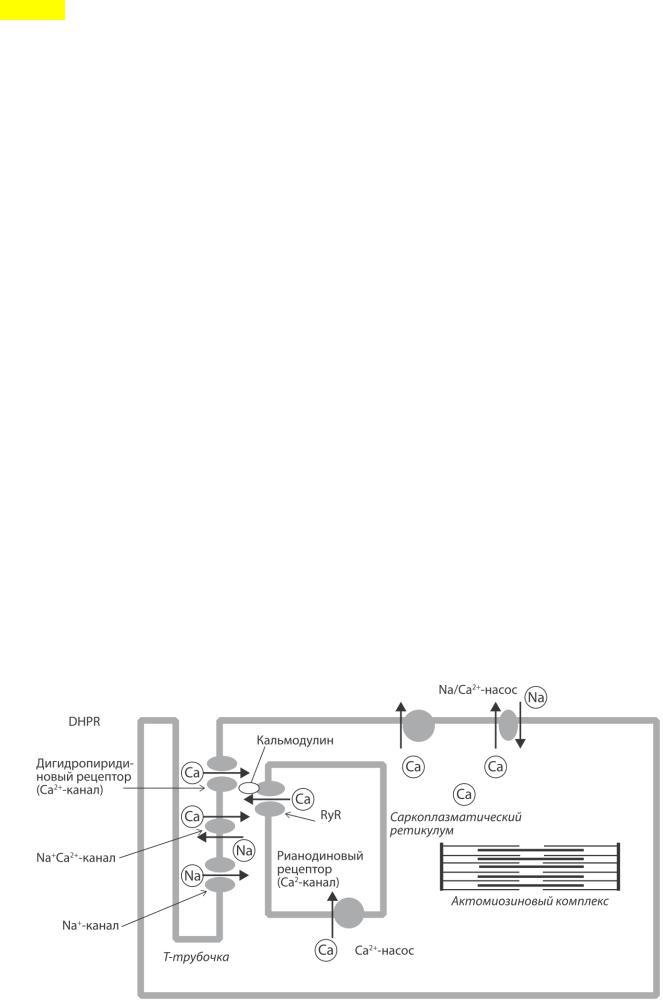
NB: структуры – ДИАДЫ! На мембране Т-трубочек поверхностной мембраны кардиомиоцитов имеется кальциевый потенциалзависимый канал, который блокируется препаратами из группы дигидропиридинов. Поэтому он получил название дигидропиридинового рецептора (DHPR). На мембране терминальных цистерн саркоплазматического ретикулума расположен другой потенциалзависимый кальциевый канал, проницаемость которого модулируется растительным алкалоидом рианодином, поэтому он получил название рианодинового рецептора (RyaR). Кроме того, с последним, возможно, связан белок кальмодулин, конформационные изменения которого могут приводить к активации рианодинового рецептора и выходу ионов кальция из цистерн саркоплазматического ретикулума. По другим данным, рианодиновые рецепторы непосредственно активируются ионами кальция.

Электромеханическое сопряжение в кардиомиоците начинается с возникновения фазы 0 потенциала действия на плазматической мембране. Когда мембранный потенциал достигает уровня –65 мВ, открываются потенциалзависимые Са2+-каналы L-типа, обеспечивающие формирование входящего ICa2+L тока, который ускоряет деполяризацию кардиомиоцитов. В результате активируются
потенциалзависимые кальциевые ионные каналы мембраны T-трубочек (дигидропиридиновый рецептор), через которые ионы кальция поступают внутрь кардиомиоцитов. «Внешние» ионы кальция взаимодействуют (прямо или через посредство кальмодулина) с
рианодиновыми рецепторами саркоплазматического ретикулума. Вследствие этого кальциевые ионные каналы саркоплазматического ретикулума открываются, и
кальций начинает поступать из мембранных цистерн в цитоплазму кардиомиоцита.
Резкое повышение концентрации ионов Са 2+ в саркоплазме устраняет тропомиозиновую блокаду взаимодействия актина и миозина и запускает процесс сокращения кардиомиоцитов.
Таким образом, поступление «внешних», или триггерных, ионов кальция вызывает высвобождение «внутренних» ионов кальция из саркоплазматического ретикулума. Такой процесс получил название кальций-индуцированного высвобождения кальция.
Чем больше поступает внешних ионов кальция, тем в большей степени будет возрастать количество ионов кальция, выходящих из саркоплазматического ретикулума. Поскольку
входящий кальциевый ток I Ca2+L достигает максимальной величины во время фазы 2 (плато) потенциала действия рабочего кардиомиоцита, длительность именно этой фазы в норме определяет силу сокращения миокарда.
Следовательно, сократимость сердечной мышцы непосредственно зависит от силы входящего кальциевого тока (I Ca2+L ), которая может возрастать, например, под влиянием катехоламинов, влияющих на степень открытия кальциевых каналов L-типа. Наряду с этим поступление в цитоплазму внешних ионов кальция восполняет запасы кальция в цистернах саркоплазматического ретикулума, что в итоге также влияет на сократимость миокарда.
Другой механизм поступления больших количеств ионов Са 2+ в цитоплазму рабочего кардиомиоцита при его возбуждении.
Он обеспечивается сопряженным транспортом ионов кальция и натрия через мембрану, то есть Са 2+ /Na + -обменом. Во время диастолы Са 2+ /Na + -насос активно удаляет из клетки ионы Са 2+ в обмен на ионы Na + . При возбуждении кардиомиоцита направление Са 2+ /Na + -обмена меняется на противоположное: ионы Са 2+ активно переносятся в клетку, тогда как ионы Na + , напротив, удаляются, и в результате концентрация ионов кальция в цитоплазме кардиомиоцита возрастает. Нарушение процесса электромеханического сопряжения при патологии сердца может привести к тому, что потенциалы действия, продолжая возникать в синусовом узле и распространяться по проводящей системе к рабочему миокарду, не вызывают его сокращения. Отсутствие
сократительной функции миокарда приводит к остановке кровообращения. Однако электрическая активность сердца может быть выявлена, например, с помощью регистрации электрокардиограммы. Такое состояние называется электромеханической диссоциацией и может явиться одной из непосредственных причин смерти, например при инфаркте миокарда.
Снижение сократимости миокарда является одной из основных причин развития сердечной недостаточности — состояния, при котором нарушаются гемодинамическая функция сердца и нормальное кровоснабжение органов и тканей. В клинической практике для лечения сердечной недостаточности применяют сердечные гликозиды — вещества, выделенные из таких растений, как наперстянка (дигиталис), строфант, ландыш и др. Как показали физиологические и фармакологические исследования, механизм действия этих препаратов обусловлен их способностью влиять на работу К + /Na + -насоса мембран кардиомиоцитов, а также метаболизм миокарда. В малых терапевтических дозах сердечные гликозиды усиливают работу К + /Na + -насоса, что отчасти увеличивает концентрацию ионов калия в клетках, вызывая увеличение сократимости миокарда. В
средних и высоких терапевтических дозах данные препараты, напротив, угнетают К + /Na + -насос мембраны кардиомиоцитов, что приводит к возрастанию внутриклеточной концентрации Na + и усилению поступления ионов Са 2+ в клетку по механизму Са 2+/ Na + -обмена (как в покое, так и при возбуждении). В результате увеличивается продолжительность фазы плато потенциала действия рабочего кардиомиоцита, а следовательно, еще больше возрастает сократимость миокарда.
Вопрос 7. Изменение возбудимости миокарда во время систолы и диастолы. Невозможность тетануса. Экстрасистола, компенсаторная пауза.
Возбуждение миокарда развивается циклически:
в систоле отсутствует возбудимость миокарда, а в диастоле возбудимость наиболее высокая.
Потенциал действия «задерживается» в АВ-узле, что дает возможность предсердиям сократиться раньше желудочков.
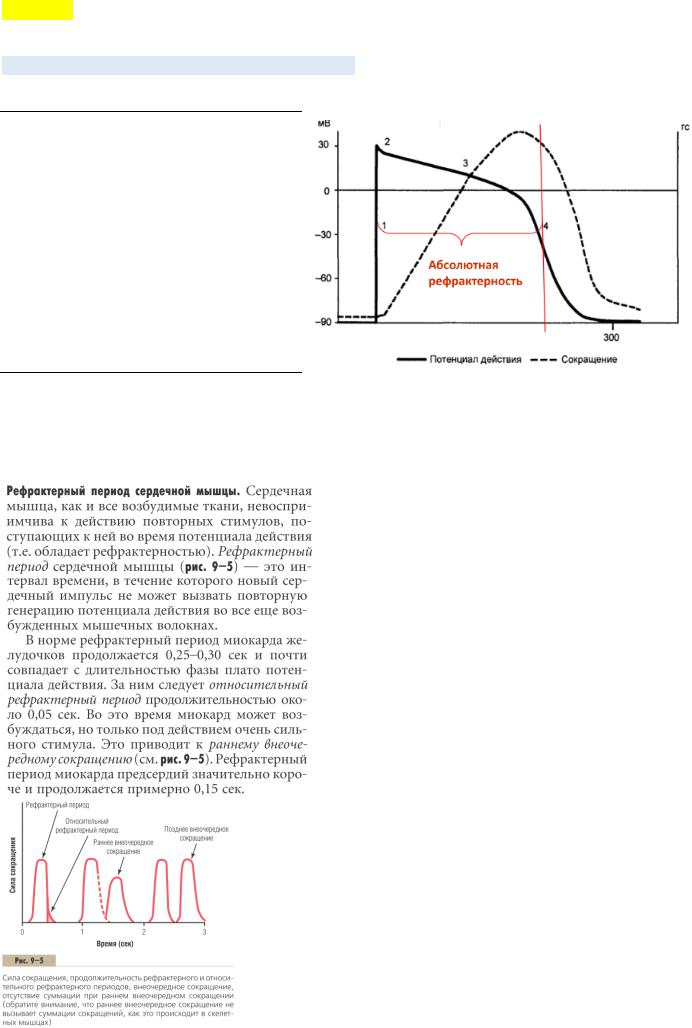
Период рефрактерности (отсутствия возбудимости) у кардиомиоцита равен по длительности систоле.
Миокард не отвечает на новый стимул пока не расслабится, поэтому невозможно длительное сокращение без расслабления - тетанус. (После систолы всегда есть диастола!)
С момента возникновения ПД и до конца его плато (см. рис. + вопрос 5) мембрана кардиомиоцитов становится невосприимчивой к действию др. раздражителей – абсолютная рефрактерность. Сокращение миокарда совпадает с длительностью ОБЩЕЙ рефрактерности (абсолютная + относительная).
Невозможность |
суммации |
сокращений |
|||
(тетануса) |
. Как |
указано выше, продолжительность |
|||
рефрактерного |
периода |
(абсолютного |
и |
||
относительного) |
рабочего |
миокарда примерно |
|||
соответствует времени всего потенциала действия (300 мс). Принципиально важно, что длительность потенциала действия рабочих кардиомиоцитов практически совпадает по времени с продолжительностью их сокращения. Поэтому последующий импульс может вызвать сокращение миокарда только после его расслабления, что соответствует окончанию предыдущего потенциала действия. В результате в миокарде невозможна суммация сокращений при увеличении частоты стимуляции, то есть развитие тетануса, как в скелетной мышце, что могло бы привести к
нарушению |
сокращения и остановке |
сердца. |
(Напомним, |
что продолжительность |
потенциала |
действия скелетной мышцы составляет около 5–10 мс, а длительность ее сокращения — 40–50 мс.) В скелетной мышце следующий импульс уже через 10 мс после первого может вызвать новое сокращение, когда мышца еще не расслабилась, что приводит к суммации сокращений. В миокарде этого не происходит в силу значительной продолжительности рефрактерного периода.

Экстрасистолы. Преждевременное возбуждение миокарда в результате возникновения внеочередного электрического импульса в проводящей системе сердца.
Экстрасистолы покоя имеют функциональный характер и обусловлены повышением тонуса парасимпатической системы.
Экстрасистолы напряжения возникают при повышении тонуса симпатической системы, но чаще отмечены у больных с органическими поражениями миокарда.
Основными причинами их возникновения являются нейрогенные механизмы, то есть экстракардиальные факторы. Субъективно экстрасистола может ощущаться как «замирание», «перебои», «остановка» сердца, однако иногда экстрасистолия вообще не замечается человеком и выявляется случайно, например при регистрации электрокардиограммы.
Если внеочередной импульс возникает в самом синусовом узле, то экстрасистола называется синусовой. Если электрический импульс возникает в проводящей системе предсердий, атриовентрикулярного соединения или желудочков, то экстрасистолы называются соответственно предсердными, узловыми и желудочковыми.
Синусовые экстрасистолы могут возникать у здорового человека при психоэмоциональном напряжении, когда повышена активность симпатической нервной системы, что приводит к повышению возбудимости клеток — водителей ритма синусового узла.
Предсердные экстрасистолы отмечены у практически здоровых людей, например во время сна, когда повышен тонус блуждающих нервов, что сопровождается снижением активности клеток синусового узла и частоты сердечных сокращений. На этом фоне возбудимость миокарда предсердий возрастает, что и приводит к возникновению предсердных экстрасистол покоя. К предсердным экстрасистолам напряжения может приводить также и усиление активности симпатической системы при физической нагрузке, эмоциональном напряжении, курении и употреблении алкоголя.
Внеочередной импульс, возникший в предсердиях, распространяется к рабочему миокарду желудочков и вызывает их возбуждение и сокращение. Этот импульс распространяется также ретроградно к синусовому узлу и вызывает его «разрядку» с последующим периодом рефрактерности. Для восстановления автоматии синусового узла необходимо некоторое время. Поэтому между предсердной экстрасистолой и последующим «очередным» возбуждением сердца существует временной интервал, который в клинической литературе получил название
компенсаторной паузы.
ДОПОЛНИТЕЛЬНО: Компенсаторная пауза может быть отмечена при определении пульса, то есть методом пальпации, например, лучевой артерии. Однако наиболее значимым для диагностики экстрасистолии в клинической практике является метод электрокардиографии.
На электрокардиограмме предсердная экстрасистола характеризуется преждевременным появлением зубца P и комплекса QRS после нормального цикла P–QRS возбуждения сердца. Следует отметить, что зубец P при предсердной экстрасистоле может быть деформированным, тогда как комплекс QRS — неизмененным (рис. 51). Расстояние от нормального комплекса QRS до экстрасистолы в клинической литературе получило название интервала сцепления. Длительность же компенсаторной паузы, то есть временного интервала между предсердной экстрасистолой и нормальным циклом P–QRS, чуть больше интервала между нормальными циклами P–QRS при синусовом ритме, но менее 2 R–R, и поэтому компенсаторная пауза называется неполной (рис. 51).
Желудочковые экстрасистолы возникают при органических изменениях в миокарде и чаще всего отмечаются у больных инфарктом миокарда (в 80 % случаев). Однако единичные желудочковые экстрасистолы могут возникать и у практически здоровых людей как в покое, во время сна, когда на фоне возрастания тонуса блуждающих нервов уменьшается частота импульсов синусового узла, так и в условиях повышения возбудимости миокарда желудочков, например в ответ на усиление активности симпатической системы.
В случае возникновения внеочередного импульса в проводящей системе желудочков он вызывает их возбуждение и сокращение с последующим развитием периода рефрактерности. Возбуждение, возникшее в желудочках, регистрируется на электрокардиограмме как деформированный комплекс QRS (рис. 51). Оно, как правило, не может распространиться ретроградно по проводящей системе к синусовому узлу, и поэтому он продолжает генерировать очередные импульсы. Однако нормальный импульс, распространяясь по проводящей системе сердца от синусового узла к желудочкам, не может вызывать их возбуждения, поскольку в это время они еще находятся в состоянии рефрактерности. В результате временной интервал между желудочковой экстрасистолой и последующим нормальным комплексом QRS (компенсаторная пауза) значительно больше, чем при предсердной экстрасистоле, и компенсаторная пауза называется полной. О полной компенсаторной паузе на электрокардиограмме свидетельствует длительность временного интервала между предшествующим желудочковой экстрасистоле нормальным комплексом QRS и следующим после нее нормальным комплексом QRS, которая равна удвоенному интервалу между нормальными комплексами QRS (см. рис. 51). Если же интервал между предшествующим экстрасистоле комплексом QRS и следующим после нее очередным комплексом QRS равен интервалу между двумя «нормальными» комплексами QRS, то в этом случае компенсаторная пауза отсутствует, а желудочковая экстрасистола называется вставочной, или интерполированной.
Единичные желудочковые экстрасистолы не вызывают изменений системной гемодинамики, и поэтому они не представляют угрозы для жизни человека. Однако множественные желудочковые экстрасистолы, приводя к недостаточному кровенаполнению желудочков во время короткого интервала между их внеочередными сокращениями, могут сопровождаться снижением сердечного выброса (на 25 %) и артериального давления, что может привести к уменьшению коронарного и мозгового кровотока. На фоне множественных желудочковых экстрасистол возможно развитие патологических нарушений ритма сердца, например желудочковой пароксизмальной тахикардии. При этом сердечный выброс и артериальное давление резко снижаются, что может привести к выраженному уменьшению коронарного и мозгового кровотока, то есть опасным для жизни человека последствиям. Таким образом, при возникновении множественных желудочковых экстрасистол у больного инфарктом миокарда необходимо в срочном порядке применять антиаритмические препараты и восстанавливать нормальный синусовый ритм. Желудочковая экстрасистолия у больных с органической патологией сердца может стать провоцирующим фактором более тяжелых нарушений сердечного ритма и коррелирует с частотой внезапной смерти.
