
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач

Термодинамическая система
в
зависимости от характера взаимодействия
с окружающей средой


изолированная
“неизолированная”

(система, которая не
взаимодействует с окру-жающей средой,
т.е. не обменивается со средой ни
энергией, ни веществом) U
= const
V
= const
закрытая
открытая


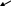

система, которая обме-нивается
с окружающей средой и энергией, и
веществом) (диффузия
вещества – флакон духов с открытой
пробкой) U
= var
V
= var
(система, которая обме-нивается
с окружающей средой только энергией) (охлаждение
куска горя-чего Ме) U
= var
V
= const


Состояние системы – совокупность ее физических и химических свойств.
Состояние системы характеризуется с помощью термодинамических параметров (Т, Р, V, С). (С – концентрация веществ, входящих в систему).
Математическое выражение, связывающее параметры состояния, называется уравнением состояния:
PV = νRT,
где ν – количество вещества.
Вполне естественно, что изменение хотя бы одного из этих параметров вызывает изменение состояния системы, то есть в системе осуществляется термодинамический процесс.
Термодинамический процесс – всякое изменение состояния системы, сопровождающееся изменением хотя бы одного из термодинамических параметров.
Процессы можно классифицировать по самым различным признакам, одним из которых является условие их протекания.
Процессы


изохорный (V =
const)
изобарный (P =
const)
изотермический (Т = const)


В основе термодинамики лежат основные начала (или законы), которые формулируются как постулаты, и являются обобщением практического опыта человечества.
Первое начало термодинамики ( I н т/д )
Первое начало термодинамики представляет собой закон сохранения и превращения энергии применительно к макросистема, т.е. энергия не исчезает и не появляется ниоткуда, а может только переходить из одного вида в другой.
С помощью первого начала термодинамики может быть проанализирована энергетика любых интересующих нас процессов.
Для химических процессов применяют следующую формулировку закона сохранения:
“Теплота, полученная системой извне, расходуется на увеличение внутренней энергии и работу, совершенную системой ”
Математическое выражение первого начал термодинамики принимает вид:
Q = Δ U + A (для открытых систем),
, где U – внутренняя энергия, А – работа, совершенная системой
При этом важное значение имеет понятие внутренней энергии. Каждая система характеризуется ее внутренней энергией.
Внутренняя энергия системы ( U ) представляет собой сумму кинетической и потенциальной энергии всех частиц, составляющих данную систему (без учета кинетической и потенциальной энергии системы в целом) .
“U” – сумма различных видов энергии:
U = Е (Е пост. + Е вр) + Е + Е + Е + Е + Е ….
Вращ.
элект-рона
Внутр.
ядра
Межмолекул.
взаимо-действия
Внутри-молекул.
движение
атомов
Кин.
движ. молекул




Как видно, “U” зависит от многих переменных, поэтому определение абсолютных значений “U” затруднено, из-за неопределенности точки начала отсчета, для которого бы U = 0. Поэтому на практике рассматривают изменение внутренней энергии, то есть величину ( ∆U ).
“U” системы изменяется при ее взаимодействии с окружающей средой. Обобщение опыта человечества показывает, что существует только два способа обмена энергией между системой и окружающей средой : либо в форме теплоты, либо в форме работы.
“Q” – форма передачи энергии путем хаотического движения частиц;
“А” – форма передачи энергии путем согласованного, упорядоченного движения частиц.
Q и А проявляются только при протекании процессов и являются лишь формами передачи энергии, и ни в коем случае не являются самой энергией. В отличие от U, понятия Q и А относятся не к системам, а к процессам.
