
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Количественный критерий процесса диссоциации
Степень диссоциации () – это отношение числа молекул, продиссоциированных на ионы (или распавшихся на ионы) к общему числу молекул, растворенного электролита.
выражается в долях единиц (0 – 1) или процентах (0 – 100 %).
Величина 
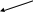
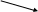
<<
1 (<<100% )
1 (100% )

Слабые электролиты
Сильные электролиты
1. Ряд кислот: H2CO3
, H2SO3
, H2S
, HCN,H2SiO3,HNO2,все
орга-нические
кислоты, CH3COOH. 2.
нераств. основания p- , d-
, f-элемен-тов: Al(OH)3
, Fe(OH)3,
3. NH4OH
–гидроксид аммония. 4.
Нерастворимые соли. 5.
некот. раств. соли (HgCl2,
Fe
(SCN)3) 6.
Вода – H2O.
1. Почти все растворимые
соли: (соли, растворимые в воде). 2.
Кислоты: HNO3
, H2SO4
, HCl , HBr, HJ , HClO4
. 3.
Гидроксиды щелочных и ще-лочноземельных
неметаллов: NaOH, KOH,
Ca(OH)2
, Ba(OH)2


Кроме того, можно выделить электролиты средней силы (α 3 – 30 %). Эти вещества являются сильными электролитами по первой ступени и слабыми по последней, следовательно, их соли гидролизуются ( см. далее). К ним относятся Н3РО4 (фосфорная, а точнее орто – фосфорная кислота), гидроксид магния Mg(OH)2 и др.
Величина зависит:
От природы электролита;
От концентрации электролита (с уменьшением концентрации, т.е. при разбавлении раствора, степень диссоциации всегда увеличивается, так как уменьшается вероятность столкновения катионов и анионов;
От температуры (с увеличением температуры степень диссоциации возрастает) .так как возрастает энергия движения всех частиц, поэтому облегчается разрыв молекул на ионы.
Особенности диссоциации электролитов
Сильные электролиты
Сильные электролиты диссоциируют на ионы нацело, т.е. процесс диссоциации является необратимым, и не ступенчато как слабые электролиты, т.е. в одну стадию.
HCl = H+ + Cl
H2SO4 = 2H+ + SO42
Следует отметить, что на практике степень диссоциации электролита определяют по электропроводности раствора. Если концентрация раствора сильного электролита велика, то каждый ион, оказывается окруженным целым роем противоположно заряженных ионов. Поэтому при пропускании постоянного электрического тока через раствор эта « ионная атмосфера» будет тормозить движение иона, и вычисленная степень диссоциации будет меньше. Это – «кажущаяся степень диссоциации». Поэтому в случае сильных элетролитов для расчетов используют не концентрацию, а величину, называемую активностью (а). Это эффективная условная концентрация, соответственно которой ион действует при химических реакциях.
a = f×С
где f – коэффициент активности, С – концентрация иона (г-ион/л). При разбавлении коэффициент активности стремится к 1. f можно найти в таблицах , он зависит от ионной силы раствора, которую рассчитывают по формуле , учитывающей заряды и концентрации всех ионов, получающихся при диссоциации
Iс = ½ ΣCиона ×z2иона
где Iс – ионная сила, Cиона –концентрация иона, z –заряд этого иона
Слабые электролиты
1. Слабые электролиты диссоциируют лишь частично, т.е. этот процесс является обратимым. Поэтому во времени устанавливается состояние химического равновесия:
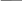 CH3COOH H+
+ CH3COO
CH3COOH H+
+ CH3COO
Состояние равновесия можно охарактеризовать с помощью константы равновесия
[CH3COO ] [ H+ ]
КД =
[CH3COOH ]
Константу равновесия для процесса диссоциации называют константой диссоциации, т.е. константа диссоциации – это константа равновесия процесса электролитической диссоциации..
Константа диссоциации зависит от:
природы растворителя;
природы электролита;
температуры , т.е. КД (С), и не зависит от концентрации электролита.
