
- •Лекция 11.
- •Часть 1. Гальванические элементы
- •Условная схема гальванического элемента
- •Аккумуляторы
- •Часть 2. Коррозия металлов. Способы защиты металлов от коррозии
- •Механизм электрохимической коррозии
- •Электрохимическая коррозия с водородной деполяризацией
- •Электрохимическая коррозия в кислородной деполяризацией
- •Способы защиты металлов от коррозии
- •4Электрохимическая защита.
- •Контрольная работа №11 (3 балла)
- •Лекция 13. Качественный анализ.
- •Типы реакций, применяемые в аналитической химии
- •Качественный анализ
- •Условия проведения реакций
- •Определение и регулирование рН в ходе анализа
- •Способы выполнения реакций
- •Реакции “сухим” способом
- •Реакции “мокрым” способом
- •Микрокристаллоскопический метод анализа
- •Методы определения качественного состава раствора
- •Дробный метод анализа.
- •Систематический метод анализа
- •Аналитические классификации ионов
- •Фильтрование
- •Центрифугирование
- •Осаждение ( седиментация)
- •Маскирование
- •5. Хроматографическое разделение
- •Экстракция
- •Электрохимические методы разделения
- •Флотация
- •Разделение и обнаружение газов
- •Реакции обнаружения анионов
- •Качественный анализ минерала (этот материал дополнительный, приведен для ознакомления)
- •Прямые методы анализа
- •Непрямые методы анализа
- •Аппаратура, химическая посуда, материалы
- •Подготовка образца к анализу
- •Выбор растворителя
- •Растворение в воде
- •Кислотное растворение
- •Растворение в разбавленной hCl
- •Растворение в концентрированной hCl
- •Растворение в азотной кислоте и смеси кислот
- •Бескислотное растворение
- •Контроьные задания
- •Задание №1,6,11,16
- •Задание №2,7,12,17
- •Задание №3,8,13,18
- •Задание №4,9,14,19
- •Задание №5,10,15,20
- •Лекция 14.Комплексные соединения
- •1.Понятие о комплексном соединении
- •2.Структура комплексных соединений
- •3.Номенклатура комплексных соединений
- •4.Классификация комплексных соединений
- •4.1.Комплексные соединения, содержащие
- •4.2.Комплексные соединения, содержащие ионные лиганды
- •4.3. Циклические комплексные соединения
- •4.4. Многоядерные комплексные соединения
- •5.Изомерия комплексных соединений
- •6.Равновесия в растворах комплексных соединений
- •7.Квантово-механические методы трактовки химической связи в комплексных соединениях
- •7.1. Метод валентных связей
- •7.2. Теория кристаллического поля
- •9. Применение комплексных соединений
- •Лекция 10. Окислительно-восстановительные реакции (овр)
- •Правила для определения степени окисления атомов:
- •Определение степени окисления атомов в сложных соединениях и ионах
- •Основные окислители и восстановители
- •Метод электронного баланса
- •2. Метод полуреакций или ионно-электронный метод
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций Электродные потенциалы
- •Сущность возникновения электродного потенциала
- •Ряд стандартных электродных потенциалов
- •Информация, заложенная в ряду стандартных электродных потенциалов:
- •Стандартные электродные потенциалы металлов
- •Определение направления протекания овр
- •Лекция № 8 Общие свойства растворов.
- •Основные способы выражения концентрации растворов:
- •Понижение давления насыщенного пара
- •Примеры решения задач
- •Повышение температуры кипения растворов
- •Примеры решения задач
- •Понижение температуры замерзания растворов
- •Осмотическое давление раствора
- •Лекция 9 Растворы электролитов
- •Механизм электролитической диссоциации
- •1. Диссоциация веществ с ионной связью
- •2. Диссоциация соединения с полярной ковалентной связью (полярные молекулы)
- •Количественный критерий процесса диссоциации
- •Слабые электролиты
- •Сильные электролиты
- •Взаимосвязь между кд и . Закон разбавления Оствальда
- •Диссоциация воды. Водородный показатель
- •Свойства кислот, оснований и солей в свете теории электролитической диссоциации
- •Реакции ионного обмена (рио)
- •Условия необратимого протекания реакций ионного обмена (рио)
- •Гидролиз солей
- •Произведение растворимости.
- •Лекция № 7 химическая кинетика и химическое равновесие
- •Факторы, влияющие на скорость реакции
- •Зависимость скорости реакции от концентрации реагирующих веществ
- •Особенности закона действия масс
- •Зависимость скорости реакции от температуры
- •Ограниченность правила Вант-Гоффа:
- •Катализаторы
- •Химическое равновесие
- •Механизмы химических реакций
- •Лекция 12. Электролиз
- •Электролиз водных растворов солей
- •Особенности катодных процессов в водных растворах
- •Примеры решения задач
- •Электролиз расплавов электролитов
- •Законы Фарадея
- •Практическое применение электролиза
- •Электрохимический ряд напряжений металлов
- •Стандартные электродные потенциалы металлов
- •Перенапряжение
- •Стандартные электродные потенциалы окислительно-восстановительных систем
- •Окислительно-восстановительные потенциалы некоторых систем (инертный электрод – платина)
- •Контрольная работа №12
- •Лекция № 6 основные положения химической термодинамики и основы термохимии
- •Термодинамическая система
- •Процессы
- •Первое начало термодинамики ( I н т/д )
- •Правила знаков в термодинамике
- •Основы термохимии (т/х) Закон Гесса. Термохимические расчеты
- •Второе начало термодинамики (II н т/д)
- •Свободная энергия Гиббса. Критерий направленности процесса в неизолированных системах
- •Одно из основных уравнений химической термодинамики
- •Термодинамические расчеты
- •Третье начало термодинамики
- •Приложение Примеры решения задач
Ограниченность правила Вант-Гоффа:
Его приближенность.
Работает в небольшом температурном интервале – для реакций, протекающих в интервале температур 0-3000 С.
Более точно температурная зависимость скорости химической реакции выражается уравнением Аррениуса.
k = k 0 · е –Еа / RT ,
где k – константа скорости реакции;
Еа – энергия активации;
R – универсальная газовая постоянная;
Т – температура , К .
С целью выяснения физического смысла Еа рассмотрим гипотетическую реакцию А2(г) + В2(г) = 2АВ(г)
Состояние этой системы можно охарактеризовать с помощью схемы:
А В А. . . . . . . . В А В
+ . . +
А В А. . . . . . . . В А В
начальное АВ* конечное состояние
состояние переходное состояние (продукты реакции)
(исх. реагенты) (активированный комплекс)
В данной схеме черточками обозначены ковалентные связи. В переходном состоянии одни связи в исходных продуктах ослабляются и начинают образовываться новые связи, что указано на схеме пунктиром. Данный процесс требует дополнительной энергии
Изменение энергии реагирующих веществ в ходе реакции можно представить в следующем виде:
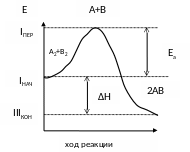
Уровень I - соответствует Еисх веществ. В ходе реакции Е сначала возрастает и достигает уровень II (п) , а затем снижается до уровня III(к) . При этом говорят, что в ходе реакции преодолевается энергетический барьер который отделяет исходные вещества от продуктов реакции.
Н – разность энергии начального и ход реакции конечного состояния.
Н = Е(III кон) - Е(I нач)
Величина этого барьера называется Еа .
Избыточная энергия по сравнению со средней энергией, которой должны обладать исходные вещества, чтобы произошла реакция.
1. Представление об энергетическом барьере предполагает, что не все молекулы могут вступать в реакцию, а лишь “активные”, которые способны преодолеть этот барьер.
2. “Активные” молекулы способны образовывать активированный комплекс, в котором объединены полуразрушенные молекулы А2 и В2 и полу-образовавшиеся молекулы АВ. Время жизни этого комплекса примерно 10 – 13 с . Далее он распадается с образованием молекул АВ.
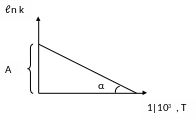
k = k 0 · е –Еа / RT
ln k = ln k0 Еа / RT
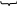
const = A
ln k = А Еа / RT (уравнение прямой
в координатах “ ln k 1 / T ”
tg = В = Еа / R
Энергия активации зависит от характеристик связи в реагирующих веществах и, соответственно, отражает природу реагирующих веществ. Кроме того, энергия активации – ценных источник знаний о механизме протекания данной реакции.
Катализаторы
Катализаторы – вещества , изменяющие скорость химических реакций.
В ходе реакции катализатор не расходуется и не входит в состав конечных продуктов.
Роль катализатора – уменьшение Еа реакции, т.е. снижение энергетического барьера.
 Типы
катализа:
Типы
катализа:
1) Гомогенный (реагирующие вещест-ва и катализатор находятся в одной фазе) пары воды
СО(г) + О2(г) СО2(г) + О(г)
Гетерогенный (реагирующие ве-щества и катализатор образуют систему из разных фаз).
Реакция происходит на границе раздела фаз.
Al2O3(т) 3500
С2Н5ОН(ж) === С2Н4 + Н2О
NO(г)
2SO2(г) + O2(г) === 2SO3(г) 3) Ферментативный
(катализатором служат сложные белковые образования)
Механизм действия катализатора – образование промежуточных соединений, что можно представить следующими уравнениями.
1) А + В = АВ (без катализатора) Еа – высокая !
К
2) А + В = АВ (с катализатором)
а) А + К = АК - непрочное соединение Еа – мала !
б) АК + В = АВ + К Еа – мала !
А + В = АВ
Действие катализатора избирательно . Во многих случаях (особенно в случае органических соединений) действие различных катализаторов меняет путь синтеза , что приводит к образованию различных продуктов. Например, нагрев этилового спирта над Al2O3 приводит к образованию зтилена и воды, если катализатором служит Cu, то образуется уксусный альдегид и водород.
Наиболее специфичными и эффективными катализаторами являются ферменты.
Роль катализаторов в химическом производстве велика: 90% всех продуктов получают в каталитических реакциях. Катализаторы изменяют скорость химической реакции, в том случае, когда они уменьшают скорость реакции, их называют ингибиторами.
Если каталитическое действие оказывают продукты реакции, то это называется автокатализом.
