
914
.pdfчебную практику, до сих пор используют антисептические препараты местного действия предназначенные для человека. Данные средства имеют ряд побочных, в том числе
итоксических, эффектов. К таким препаратам относятся 1% раствор бриллиантового зеленого («зеленка») и раствор Фукорцин.
Вклинической практике нам не раз доводилось наблюдать мокнущий дерматит, гиперемию, эксфолиативный кератолиз у животных с обработанным «зеленкой» послеоперационным швом. В случае применения фукорцина нами почти в каждом случае фиксировались помимо общих симптомов апатии, ано- и гипорексии также симптомы неврологических расстройств, в особенности у котят и щенков. В одном случае обработки кожи фукорцином нами выявлена внезапная слепота у 8 летней таксы.
На основании собственных наблюдений нами была поставлена цель экспериментального определения негативного влияния на животных топикальных антисептических препаратов бриллиантового зеленого и фукорцина.
Материалы и методы исследований. В качестве исследуемых топических антисептиков выбраны Фукорцин, согласно инструкции к применению препарата: Фармакология: фармакологическое действие - антисептик для наружного применения; Состав: ацетон, борная кислота, резорцинол; Вспомогательные вещества: фенол; Особые указания: не следует наносить препарат на большие участки кожи, т.к. фенол, входящий в состав раствора, проникает в кровь и может вызвать токсические явления (головокружение, слабость). Раствор бриллиантовой зелени, согласно инструкции к применению: Фармакология: фармакологическое действие - антисептическое наружное средство; Состав по компонентам: бриллиантовый зеленый, вода, этанол; Предостережения: не допускать попадания препарата на слизистую оболочку глаза.
Исследование проведено на 35 лабораторных мышах разных полов в возрасте 1 года, весом от 25 до 31 грамма. Животные содержались в виварии ФГБОУ ВО «Пермский ГАТУ» кафедры инфекционных болезней каждая особь в отдельной клетке, все клетки находились в одном и том же помещении при температуре воздуха от 21-25 градусов, с естественной вентиляцией, влажностью воздуха 55-63%, освещение комбинированное: естественное + искусственное, общее время освещения не превышало 12 часов. Кормление для всех особей однотипное с использованием готового промышленного рациона: гранулированный корм для лабораторных мышей и крыс Дельта Фидс Р-22 (состав: зерновые, молочные компоненты, высокобелковые компоненты (растительные
иживотные белки), масло растительное, аминокислоты, органические кислоты, вита- минно-минеральный комплекс). Суточная доза корма согласно инструкции по кормлению данным видом корма. Питьевой режим из полуавтоматических поилок, свободный круглосуточный доступ.
Для определения токсического действия на организм и негативного действия на кожу антисептического препарата Бриллиантовый зеленый были отобраны 10 мышей разного пола. Далее у отобранных мышей выстригали шерсть на небольшом участке кожи с правого и левого бока, далее с левой стороны сделали механическое повреждение кожи (экскориации) иглой от инсулинового шприца до появления капиллярной крови, после чего на обе выбритые стороны нанесли аппликацию исследуемого раствора. Нанесение раствора бриллиантового зеленого проводили ежедневно, один раз в день в течение 7 дней.
Для определения токсического действия на организм и негативного действия на кожу антисептического раствора Фукорцин были отобраны 15 мышей разного пола. Не
211
выстригая шерсть, нанесли с помощью ватной палочки раствор фукорцина на кожу животных, при этом у 5 мышей площадь нанесения не превышала 5% от площади тела, у 5 мышей 20-25% от площади тела и у оставшихся 5 мышей - 50% от площади тела. Площадь тела мышей определяли условно, разделив тело на 4 условных квадрата. Нанесение фукорцина запланировано наносить ежедневно один раз в день в течение 7 дней и оценивать результат на 8 день, а при наличии отклонений в здоровье мышей непосредственно в день их проявления.
Контрольная группа мышей состояла из 10 особей разного пола, которым не проводились никакие манипуляции и которые жили в тех же условиях, что и опытные группы.
Результаты исследований. Результаты осмотра мышей, на кожу которых наносился раствор бриллиантовой зелени. На второй день нанесения у 4 животных (40%) выявлены эрозии на месте применения препарата, как со стороны поврежденной, так и со стороны неповрежденной кожи. На третий и четвертый день нанесения препарата у 8 мышей (80%) полностью сошел верхний слой эпидермиса, а у 2 мышей (20%) выявлены язвы с петехиями на месте аппликации препарата. Данные патологические изменения на коже также были выявлены как со стороны предварительно поврежденной, так и со стороны неповрежденной кожи. На 6 день нанесения препарата у всех животных на месте аппликации образовался плотный струп. На 8 день при осмотре, образовавшийся струп был удален, под которым выявлены поражения до глубоких слоев дермы с петехиями и геморрагиями, эпидермис сухой, легко отделялся вместе с шерстью.
Ежедневно оценивая общее состояние мышей, нами не выявлено патологических общих симптомов, кроме как беспокойства при нанесении препарата на кожу.
Анализируя полученные результаты установлено, что уже при однократном применении препарата раствора бриллиантового зеленого высокая вероятность развития контактного дерматита. При последующих аппликациях возникает контактный дерматит (химический ожог), сопровождающийся глубокими поражениями эпидермиса и дермы без признаков регенерации, при этом патология развивается за пределы нанесения препарата. Также не установлено зависимости возникновения дерматита от наличия поверхностного повреждения кожи. При этом стоит отметить, что никаких общих нарушений в здоровье мышей нами не выявлено.
Опыт 2. Нанесение Фукорцина.
Во всех опытных подгруппах животного на местах обработки фукорцином на коже образовывались корки и струпья. На второй день состояние кожи в местах нанесения фукорцина изменилось. Кожа стала истончаться у всех мышей из всех опытных подгрупп. У двух мышей из подгруппы 2 с нанесением фукорцина на 20-25% площади кожи отмечена анорексия, а у оставшихся 3 гипорекися. В подгруппе животных, которым наносился фукорцин на 50% площади кожи у всех мышей выявлен блефароспазм, слепота без выраженного конъюнктивита, блефарита и кератита, а также анорексия. На третий день эксперимента у всех мышей из всех трех опытных подгрупп на месте нанесения препарата стала выпадать шерсть. У животных из первой подгруппы, у которых аппликация фукорцина не превышала 5% площади кожи, наблюдалась апатия, анорексия. У 2 мышей из второй подгруппы и всех мышей из третьей подгруппы выявлены неврологические признаки в виде непроизвольного подергивания передних конечностей. Анорексия выявлена у всех мышей из 2 подгруппы. На четвертый день был отмечен падеж всех 5 мышей третьей подгруппы. У животных из второй подгруппы выяв-
212
лены неврологические признаки в виде подергивания передних конечностей, летаргия, блефароспазм, слепота. У мышей из первой опытной подгруппы отмечена болезненность при пальпации кожи не только в области нанесения препарата, но и за его приделами. На пятый день выявлен падеж всех мышей 2 подгруппы и блефароспазм, слепота, летаргия у всех мышей 1 опытной подгруппы. На шестой день у всех животных первой подгруппы проявились неврологические признаки в виде подергивания передних конечностей, к вечеру 6 дня выявлен падеж 3 мышей и на утро 7 дня оставшиеся мыши первой опытной группы были обнаружены мертвыми.
Анализируя полученные данные, мы выявили закономерность и повторение основных симптомов, в том числе и системных, которые имели четкую зависимость от дозировки (площади нанесения) и длительности применения препарата. Эти данные для наглядности можно представить в виде таблицы.
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица |
||
Симптомы и патологии, выявленные у 100% мышей в зависимости |
|||||||||||||||
от дозы и экспозиции препарата |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 подгруппа |
|
2 подгруппа |
3 подгруппа |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Симптом, патологии |
|
|
|
Дни эксперимента |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Образование струпьев |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Атрофия кожи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алопеция |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Анорексия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Летаргия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Блефароспазм |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Слепота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Неврологические симпто- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
мы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Смерть |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Выводы и предложения. В ходе наших экспериментов установлено, что уже с первого применения исследуемых асептических растворов возникает контактный дерматит, при этом в независимости от первичного поражения кожи в эксперименте с нанесением раствора бриллиантового зеленого и в не зависимости от площади нанесения раствора фукорцин. Также нами установлено токсическое действие раствора фукорцина в прямой зависимости от площади нанесения. Наиболее токсическое действие на весь организм в целом и с проявлением неврологических симптомов выявлено при нанесении фукорцина на 50-55% площади кожи уже на 2-й день применения препарата. Высокое токсическое действие препарата фукорцин также подтверждается 100% летальностью опытных животных в течении 7 дней в зависимости от площади нанесения.
На основании проведенных экспериментальных исследований мы не рекомендуем к использованию в качестве топикального (местного) антисептика раствор бриллиантового зеленого, а препарат Фукорцин в виду выявленного токсического действия, считаем потенциально опасным для животных.
213
Список литературы
1.Адаменко, Г. В. Токсикологическая безопасность спиртосодержащих лекарственных средств для профилактической антисептики / Г. В. Адаменко, Н. И. Миклис, И. И. Бурак // Вестник Витебского государственного медицинского университета. – 2020. – Т. 19, № 1. – С.
86-93.
2.Герке, А. Н. Основные принципы местной антимикробной терапии в дерматологии
//VetPharma. – 2015. – №. 1 (23). – С. 66-75.
3.Грабарская, Е. А. Изучение ранозаживляющей активности новой многокомпонентной мази / Е. А. Грабарская, Н. В. Данилевская, А. А. Дельцов, А. А. Правда // Российский ветеринарный журнал. Мелкие домашние и дикие животные. – 2015. – № 3. – С. 48-50.
УДК 619.616.995.132.5:616-006.03
КЛИНИЧЕСКИЕ СЛУЧАИ ДИРОФИЛЯРИОЗА СОБАК
В.А. Иванов, Т.Н. Сивкова
ФГБОУ ВО Пермский ГАТУ, г. Пермь, Россия
E-mail: tatiana-sivkova@yandex.ru
Аннотация. Проведено клиническое обследование 4 собак, у которых в крови обнаружены микрофилярии. У всех животных было выявлено повышение уровня эозинофилов и щелочной фосфатазы, у двух из них - дерматит и у одной - комплексная аденомиоэпителиома.
Ключевые слова: дирофиляриоз, мастопатия, неоплазия, подкожная клетчатка.
Ведение. Дирофиляриоз – это опасное паразитарное заболевание животных и человека, вызываемое нематодами рода Dirofilaria. Данный нематодоз широко распространен по всему миру, в том числе встречается и в Пермском крае [1,2].
В зарубежной литературе отмечено, что на месте инвазии дирофиляриями формируются опухоли, что является весьма интересным, однако, малоизученным вопросом патогенеза [3]. Также в отечественной и зарубежной литературе присутствует недостаточно сведений о клиническом течении дирофиляриоза у собак, в связи с чем у практикующих ветеринарных врачей нет понимания необходимости назначения специальных паразитологических исследований.
Материалы и методы. Материалами нашего исследования послужили собаки, поступавшие с различными заболеваниями в одну из ветеринарных клиник города Перми, у которых в крови были обнаружены микрофилярии. Для выявления и оценки изменений тканей органов, крови и общего состояния были применены следующие методы: лабораторный, визуальный, гистологический, ультразвуковой. Для лабораторного метода применяли исследование крови на гематологическом анализаторе Abaxis VetScan HM5 v2.4, биохимическом анализаторе MNCHIP Pointcare V3. Кровь на наличие микрофилярий исследовали методом Ястреба на кафедре инфекционных болезней факультета ветеринарной медицины и зоотехнологий Пермского ГАТУ. Для установления вида микрофилярий использовали ПЦР в лаборатории VetUnion (г. Москва). При визуальном методе применялся физикальный осмотр и рентгенографическое исследование на аппарате Zoomed VX-400. Ультразвуковое исследование проводили на УЗ-
аппарате Mindray Vetus 7.
214
Результаты. За период с марта по август 2023 года было выявлено 4 случая обращения собак, у которых в результате лярвоскопического анализа периферической крови установлена микрофиляриемия.
Первый случай был зарегистрирован 21 марта, владелец 12 летней собаки обратился в клинику с жалобами на двусторонние свищи в щечной области. Содержание в квартире. Собака была направлена на прием к стоматологу с последующим лечением. Установлено повышение уровней количества палочкоядерных нейтрофилов до 5% (Норма 0-3%), эозинофилов - 8% (норма 2-5%), щелочной фосфатазы - 258,5 Ед/л (норма 18-70), остальные показатели крови в пределах референсных значений. Проведено ЭХОКГ, на момент исследования уз-признаков патологий не выявлено. Выполнена санация ротовой полости, удалены 108, 208, 105, 106 зубы.
Второй случай был выявлен 29 апреля, 12 летняя собака поступила в клинику с синдромом Горнера слева. Содержание во дворе, обработок от экто- и эндопаразитов не было, кормление натуральной пищей. При осмотре выявлены: Синдром Горнера слева, уши болезненны, визуально хронический наружный отит (ушная раковина без изменений, наружный слуховой проход - эритема, петрификация, сужение, воспаление серных желез). На передней лапе в области запястья - акральный дерматит. По результатам анализа крови выявлено повышение числа эозинофилов - 6% (норма 2-5%), общего белка - 77,2 г/литр (норма 59-76), мочевины - 15,8 ммоль/литр (норма 3,6-9,2), креатинина - 250,6 (норма 60-128), щелочной фосфатазы - 99 ед/литр (18-70). Назначена симптоматическая терапия.
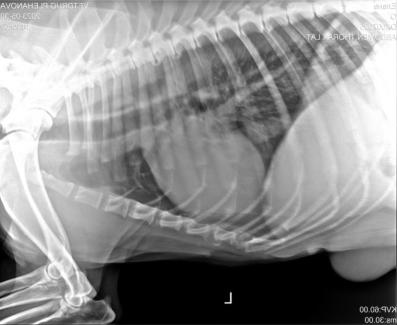
Третий случай 27 мая, немецкая овчарка (11 лет). На момент осмотра визуализируется объемное образование в среднем пакете молочных желез слева, образование объемное, есть место крепления к поверхностным мышцам брюшной стенки. Признаков изъязвления и эрозий нет, образование собаку не беспокоит. Признаков поражения сторожевых лимфатических узлов нет. В той же молочной железе и билатерально в правой железе есть множественные мелкие образования разного диаметра. По результатам ЭХОКГ на момент исследования уз-признаков патологий не выявлено. По УЗИ брюшной полости диагностированы диффузные изменения правой и левой почек, характерные для хронической нефропатии, пневматизация желудка и кишечника. По анализам крови выявлено повышение количества щелочной фосфатазы - 118,2 ед/литр (норма 18-70), эритропения - 5,3 млн (норма 5,5-8), эозинофилия - 19% (норма 2-5), лимфоцитопения - 8% (норма 13-32). По рентгенографическому исследованию признаков метастатического процесса не установлено (рис.).
Проведена унилатереальная мастектомия, новообразование было направлено на гистологическое исследование, по результатам которого был поставлен диагноз: комплексная аденомиоэпителиома, реактивная гиперплазия лимфатического узла. Назначено послеоперационное лечение.
Четвертый случай был выявлен 14 августа, алабай (8 лет), жалобы на хромоту и разлизывание лапы. На момент осмотра собака скованна в движениях, выражена хромота на правую тазовую конечность. Есть кожные поражения (акральный дерматит тазовых конечностей). При пальпации скакательные суставы без особенностей, при пальпации коленных суставов (экстензии) - испытывает дискомфорт. На флексию/экстензию тазобедренных суставов не реагирует. По результатам рентгенисследования есть признаки хронических изменений (спондилез/стеноз). По биохимическому анализу крови все показатели в пределах референсных значений. Проведено
215
ПЦР исследование на выявление ДНК дирофилярий, по результатам которого выявлена ДНК Dirofilaria repens. Назначена симптоматическая терапия.
Важно отметить, что все собаки - возрастные, систематических обработок от экто- и эндопаразитов не производилось, большинство уличного содержания.
Рисунок ‒ Рентгенографическое исследование и новообразование суки с подкожным дирофилариозом
Анализируя результаты крови, у большинства собак был повышен уровень эозинофилов, что может говорить о протекании аллергической реакции в организме, которая может быть вызвана дирофиляриозом. Повышение уровня щелочной фосфатазы может быть напрямую связано с неоплазией. Кроме того, неоплазия молочных желез без метастазов в кость или печень является причиной повышения активности ALP в сыворотке крови у собак. Сывороточное увеличение активности ALP может возникать при развитии как доброкачественных, так и злокачественных опухолей молочной железы, и, как правило, это повышение не сильное (менее чем в 8 раз).
Возникновение акрального дерматита у двух собак может напрямую быть связано с миграцией половозрелых особей дирофилярии, что вызывает местную воспалительную и токсическую реакцию.
Выводы. В описанных нами случаях у собак с обнаруженными микрофиляриями в крови было выявлено повышение уровня эозинофилов, щелочной фосфатазы, два случая акрального дерматита и онкологический процесс.
Изучая данные клинические случаи и рассматривая патогенез при тканевых нематодозах, можно предположить возможную взаимосвязь указанных изменений показателей крови и местной реакцией организма на поражение подкожными дирофиляриями.
Список литературы
1. Авдюхина, Т.И. Дирофиляриоз (D. repens) в Российской федерации и некоторых странах СНГ: ситуация и тенденция ее изменения / Т.И. Авдюхина, В.Ф. Постнова, Л.М. Абросимова, Л.В. Пленкина, В.Н. Тарасов // Медицинская паразитология и паразитарный болезни - 2003. - № 4. - С. 44-48.
216
2.Архипова, Д.Р. Зоогеография дирофиляриоза собак в России / Д.Р. Архипова, И.А. Архипов // Теория и практика борьбы с паразитарными болезнями: Материалы докладов научной конференции . – М, 2004. - С.42-44.
3.Neglected Agent Eminent Disease: Linking Human Helminthic Infection, Inflammation, and Malignancy// N. Arora, R. Kaur, F. Anjum [et al.] //Front Cell Infect Microbiol. – 2019. − № 9. – Р. 402. Published 2019 Dec 6. DOI:10.3389/fcimb.2019.00402.
УДК: 619:614.31
МОНИТОРИНГ МОЛОКА НА АНТИБИОТИКИ С МАЛЫХ ФОРМ. ХОЗЯЙСТВОВАНИЯ СОЛИКАМСКОГО ГОРОДСКОГО ОКРУГА
О.И. Лазарева
ФГБОУ ВО Пермский ГАТУ, г. Пермь, Россия
E-mail: ol.manina@yandex.ru
Аннотация. В статье приведен статистический анализ данных ветеринарносанитарной экспертизы молока на показатели безопасности выполняемые ГБУВК «Соликамской СББЖ» за 2021-2023 гг. При анализе установлено, что из 210 проб, 6 проб были положительные на антибиотики, в пяти пробах превышены УДС бета-лактамного типа, в одной стрептомицина.
Ключевые слова: молоко, контроль, иммуноферментный анализ, бета-лактамные антибиотики, стрептомицин.
Введение. Молоко может представлять риск попадания в пищу человека антибиотиков [2]. В современных условиях животноводства антибиотики используются не только для терапии, но и для профилактики и ускорения роста в качестве кормовой добавки [1; 7]. Возможны альтернативные пути поступления данных препаратов в организм животных: растения, почва, вода. Причинами контаминации молока остатками антибактериальных препаратов после терапии могут служить: завышенная доза, неконтролируемая фармакокинентика, невозможность определения пролеченного животного, оборудование для доения [1].
В области здравоохранения человека существует две глобальных проблемы. Первая, негативное влияния антибиотиков в молоке на организм, проявляющееся различными иммунологическими и токсикологическими реакциями, и вторая, формирование устойчивых бактерий [7]. В отношении молочной промышленности, актуальна проблема технологической переработки, заключающаяся в отрицательном влиянии остаточных количеств антибиотиков на микроорганизмы, включая заквасочные и химический состав молока. Например, в отношении пенициллина установлено, ухудшение качественных органолептических и микробиологических показателей [3].
Уровни допустимого содержания (УДС) антибиотиков в РФ регламентируются ТР ТС 021/2011 и ТР ТС 033/2013 ТР ТС. Для скрининга показателей безопасности существует множество методов исследований, из которых приоритетными являются экспресс [2; 4; 6]. Сегодня на государственном уровне реализуется программа контроля антимикробных препаратов (СКАМП) в продуктах животного происхождения на наличие более 90 антибиотиков [1].
217
Подтверждение безопасности молока проводится при помощи ветеринарносанитарной экспертизы, осуществляемой специалистами государственной ветеринарной службы на молокоперерабатывающих предприятиях, станциях по борьбе с болезнями животных (СББЖ) и на рынках. При выявлении несоответствий при ветеринарносанитарной экспертизе, производители привлекаются к ответственности [1].
Цель исследования: проанализировать статистические данные ветеринарносанитарной экспертизы молока, изучить частоту превышения показателей безопасности продукции с малых форм хозяйствования Соликамского городского округа.
Материалы и методы. Материалом исследований являлись данные журнала ветеринарной отчетности (Форма № 24-вет) за 2021-2023 гг. проводимые ГБУВК «Соликамской СББЖ». Метод исследования - статистический.
Результаты исследований. На СББЖ экспертиза молока проводится ветеринарными специалистами, ее результаты заносятся в «Журнал ветеринарно-санитарной экспертизы сырого молока, сырого обезжиренного молока, сырых сливок и молочных продуктов», а также в автоматизированную информационную систему «Меркурий». Лабораторный анализ выполняется согласно ГОСТ 32219–2013 с использованием иммунологического экспресс-теста по типу иммуноферментного анализа «Garant 4 Ultra Milk» (Китай) для одновременного определения антибиотиков бета-лактамного типа, тетрациклиновой группы, хлорамфеникола (левомицетина) и стрептомицина без термо- стата-инкубатора. Исследование на наличие соматических клеток осуществляют по ГОСТ 23453–2014 с помощью экспресс-диагностикума «Кенотест». При возникновении спорных случаев пробы молока направляются на повторное исследование в ГБУВК «Пермский ВДЦ».
Статистическому анализу подверглись сведения ветеринарной отчетности с крестьянско (фермерского) хозяйства (К(Ф)Х) и трех личных подсобных хозяйств (ЛПХ) располагающиеся на территории Соликамского городского округа от которых происследовано 210 проб молока.
По данным ВСЭ молока за указанный период превышение УДС установлено в шести пробах (три с КФХ, три с ЛПХ), что составляет 3 % от всех исследуемых проб. По литературным данным, молоко чаще всех продуктов животного происхождения контаминировано антибиотиками, чаще вследствие мастита, который является распространенным заболеванием среди лакирующих коров [5; 7]. При анализе статистических данных экспертизы молока на наличие соматических клеток за тот же период, количество положительных проб составило 20 (10%) от всех проанализированных. При этом 5 проб (2%) предоставлены КФХ, 15 проб (8%) произведены ЛПХ. Также установлено, что в молоке с КФХ частота обнаружения соматических клеток была в два раза выше, чем в продукции с ЛПХ.
В пяти пробах обнаружены антибиотики бета-лактамного типа, в одной пробе стрептомицин. Бета-лактамные антибиотики могут присутствовать в продукции животного происхождения ввиду широкого применения в ветеринарной практике [4; 8]. К бета-лактамным антибиотикам относится пенициллин. Его соли водорастворимы и применяются только внутримышечно. Они обладают широким спектром действия в отношении множества инфекций, в т.ч. стафилококковых и стрептококковых [1]. Проанализированные данные экспертизы на наличие соматических клеток в пробах подтверждают установленные исследователями пути контаминации молока данной группой антимикробных препаратов. Стрептомицин относится к аминогликозидам, обладает
218
активностью в отношении грамположительных и грамотрицательных микроорганизмов. Соли препарата назначаются парентерально и энтерально. Установлено, что пенициллины и стрептомицин разрушаются только на 20% при технологической переработке, что подчеркивает важность серьезного контроля молочного сырья [1].
Выводы и предложения.
1.Проблема присутствия антибиотиков в молоке актуальна для малых форм хозяйствования, не зависимо от вида деятельности и ответственности.
2.Наиболее часто нормативы ДУС в молоке превышали антибиотики беталактамного типа, предположительно вследствие лечебных или профилактических мероприятий.
Список литературы
1.Олсуфьева, Е. Н. Обзор рисков контаминации антибиотиками молочной продукции /Е. Н. Олсуфьева, В.С. Янковская, Н.И. Дунченко // Антибиотики и химиотерапия. – 2022. – том 6. №7-8. – С. 82-96.
2.Попов, П.А. Методы обнаружения остаточных концентраций антибиотиков в молоке
/П.А. Попов, М.П. Бутко, С.А. Лавина // Научный журнал КубГАУ, 2020. – №163. – С. 1-10.
3.Родионов, Г.В. Влияние антибиотиков на качество и безопасность молока и молочных продуктов / Г.В. Родионов, О.В. Селицкая, Н.М. Костомахин [и др.]// Известия ТСХА, 2019. – Вып.к 4. – С. 88-103.
4.Куприенко, О.С. Конъюгаты аминопенициллинов с белками: синтез, иммуногенные свойства, связывание с рецептором бета-лактамов и антителами / О.С. Куприенко, Т.С. Серченя, И.И. Вашкевич // Биоорганическая химия. – 2022. – том 48. – № 1. – С. 75-86.
5.Курак, А. Соматические клетки в молоке – показатель здоровья / А. Курак // Животноводство России. – 2019. – С. 51-53.
6.Чаплыгина, О.С. Методы оценки остаточного количества антибиотиков группы ам-
фениколы в молоке и молочной продукции / О.С. Чаплыгина, А.Ю. Просеков, А.Д. Веснина
//Техника и технология пищевых производств. – 2022. – Т. 52, № 1. – С. 79–88.
7.Чаплыгина, О.С. Оценка биологической безопасности молочных продуктов, содержащих антибиотики / О.С. Чаплыгина, О.В. Козлова, М.Ю. Жарко [и др.] // Техника и технология пищевых производств. − 2023. − Т. 53, № 1. − С. 192–201.
8.Menkem, Z.E. Antibiotic residues in food animals: Public health concern / Z.E. Menkem, B.L. Ngangom, S.S.A. Tamunjoh [et al.] // Acta Ecol. Sin. 2019. − Vol. 39. − P. 411–415.
УДК 619 : 636.2.034
МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ СТЕНКИ РУБЦА У КОРОВ С АЛКАЛОЗОМ
Н.Б. Никулина1, Е.В. Байдак2
1ФГБОУ ВО Пермский ГАТУ, г. Пермь, Россия 2Ветеринарная клиника доктора Чигаевой, г. Пермь, Россия
Аннотация. Исследование проводили на лактирующих коровах в первой фазе лактации (100 дней после отела) черно-пестрой породы живой массы 450-500 кг, в возрасте 3-6 лактации. Обнаружено, что у животных с алкалозом водородный показатель слюны, рубцового содержимого и мочи, а также резервная щелочность крови были выше физиологической нормы. Морфологическая картина характеризовалась отеком
219
собственной пластинки слизистой оболочки рубца, наличием воспалительного инфильтрата, псевдокист различного диаметра и полнокровием кровеносных сосудов с утолщенной стенкой, что свидетельствовало о хроническом воспалении.
Ключевые слова: крупный рогатый скот, алкалоз, рубец, морфология.
Болезни метаболического профиля широко распространены как в России, так и за рубежом и наносят значительный экономический ущерб молочному животноводству [1, 6, 8]. В отечественной и зарубежной литературе особе внимание уделялось вопросам гомеостаза при возникновении гепатоза, кетоза и ацидоза рубца, а также разработке терапии метаболических болезней [1-5, 7]. При этом патогенетические аспекты и морфофункциональные изменения у крупного рогатого скота при развитии алкалоза остаются малоизученным.
Цель работы – изучить морфологические изменения стенки рубца у лактирующих коров с алкалозом.
Материалы и методы. В одном из хозяйств Пермского края были образованы две группы лактирующих коров в первой фазе лактации (100 дней после отела) чернопестрой породы живой массы 450-500 кг, в возрасте 3-6 лактации. В контрольную группу вошли клинически здоровые животные. Опытную группу образовали коровы с клиническими признаками алкалоза.
Увсех животных использовалась круглогодовая стойловая система содержания.
Вхозяйстве применяли базовый рацион, состоящий из силоса, сенажа, комбикорма, жмыха подсолнечного и кормовой соли.
Клиническое обследование животных осуществляли по общепринятой схеме. Для постановки диагноза определяли рН слюны и рубцового содержимого портативным рН-метром. В камере Горяева подсчитывали количество инфузорий и оценивали подвижность микроорганизмов. На биохимическом анализаторе «StatFax 1904+» (США) определяли резервную щелочность сыворотки крови с использованием биохимических наборов («Ольвекс диагностикум», Россия). С помощью индикаторных тестполосок «Уриполиан-11А» (фирма «БИОС», Россия) выявляли рН мочи.
Морфологическое исследование стенки рубца осуществляли на кафедре биологии и гигиены животных ФГБОУ ВО Пермский ГАТУ. Кусочки органа были зафиксированы в 10 % растворе формалина сразу после убоя животных. Использовали стандартные морфологические методы.
Выполнена статистическая обработка полученного материала с вычислением значений критерия Стьюдента и степени вероятности.
Результаты исследований. Анализ состава рациона показал несоответствие его физиологическим потребностям коров. Установлен избыток сырого протеина, обменной энергии, кальция и недостаток сухого вещества, фосфора, сырого жира, сахара, сырой клетчатки.
Уклинически здоровых коров рН слюны и рубцового содержимого находились на уровне 8,7+ 0,1 и 7,3 +0,1 соответственно (при норме 8,1-8,8 и 6,5-7,2). У животных с алкалозом водородный показатель слюны незначительно превышал норму и составил 8,9 +0,01, а в рубцовом содержимом был выше физиологической нормы и достиг значений 7,5+0,1. При этом у коров контрольной группы в рубцовом содержимом преобладали крупные формы инфузорий, а у животных опытной группы регистрировали
220
