
Нормальная физиология / КР4 кровь + эндокринка
.pdf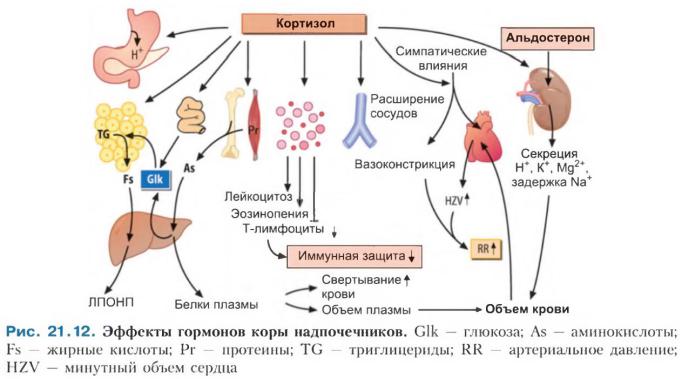
Действие на кровь, иммунную систему и заживление ран. Глюкокортикоиды повышают свертываемость крови. Они стимулируют образование нейтрофилов. Одновременно глюкокортикоиды ингибируют образование эозинофилов, базофилов, моноцитов и Т- лимфоцитов, а также синтез и секрецию воспалительных мсдаторов, например простагландинов, интерлейкинов, лимфокинов, гистамина и серотонина. Кроме того, они тормозят высвобождение лизосомных ферментов. Таким образом, глюкокортикостероиды подавляют иммунную систему, тормозят деление клеток и их рост, ингибируют синтез коллагена и в итоге нарушают процессы восстановления при повреждениях или воспалении.
Эти эффекты глюкокортикоидов отчасти опосредованы усилением экспрессии липокортина (аннексина 1), который ингибирует фосфолипазу А2** (см. конец – она необходима для синтеза эйкозаноидов).
Поскольку глюкокортикоиды подавляют иммунную систему, их вводят при состояниях, вызванных гиперактивностью иммунной системы, таких как аутоиммунные заболевания или отторжение трансплантированных органов.
Действие на минеральный обмен и кости. Глюкокортикоиды уменьшают экспрессию рецептора кальцитриола, который стимулирует всасывание необходимых для минерализации костей Са2+ и фосфата в кишечнике. При этом глюкокортикоиды снижают всасывание фосфата кальция в кишечнике. Они также ингибируют деятельность остеобластов и стимулируют деятельность остеокластов. Под влиянием глюкокортикоидов преобладает резорбция костей.
Действие на желудок. Глюкокортикоиды стимулируют секрецию соляной кислоты в желудке. Одновременно они тормозят образование слизи и синтез сосудорасширяющих простагландинов. Под влиянием глюкокортикоидов слизистая оболочка желудка оказывается незащищеной от агрессивного действия выделяемой соляной кислоты (нейрогенные язвы ЖКТ, т.е. язвы от стресса, тревожности).
Действие на кровообращение. Глюкокортикоиды сенсибилизируют к катехоламинам сердце и сосуды. С одной стороны, они увеличивают силу сердечных сокращений, а с

другой стороны — периферическое сопротивление сосудов, в результате чего повышается АД.
Действие на легкие. У плода глюкокортикоиды стимулируют развитие легких и своевременное образование сурфактанта.
Эффекты минералокортикоидов. Глюкокортикоиды активируют рецепторы минералокортикоидов и оказывают соответствующие эффекты, т. е. способствуют задержке натрия и экскреции калия почками. В то же время они тормозят секрецию вазопрессина (АДГ). Вызванная ими гиперволемия способствует повышению АД, которое усиливается из-за увеличенной чувствительности сердца и сосудов к катехоламинам. Однако в клетках-мишенях минералокортикоидов глюкокортикоиды быстро инактивируются 11β-гидроксистероиддегидрогеназой 2-го типа, превращаясь в кортизон. Хотя концентрация в плазме основного глюкокортикоида кортизола в свободной форме в 100 раз выше, чем концентрация основного минералокортикоида альдостерона, минералокортикоидный эффект кортизола обычно намного меньше выражен. Глюкокортикостероиды повышают секрецию атриального натрийуретического пептида и скорость клубочковой фильтрации в ночках.
Избыток глюкокортикоидов
Причинами избытка глюкокортикоидов служат повышенная автономная или АКТГиндуцированная секреция, ятрогенное введение гормона; последствия могут долгое время оставаться опасными для жизни.
Причины. Избыток глюкокортикоидов может быть следствием повышенной секреции АКТГ гипофизом (болезнь Кушинга) или дедифференцированной опухолью (например, мелкоклеточной бронхиальной карциномой). В то же время выработка глюкокортикоидов может быть повышена и без усиления секреции АКТГ при опухоли надпочечников (первичный гиперкортицизм, болезнь Кушинга). При этом секреция АКТГ снижена из-за отрицательной обратной связи.
Часто избыток глюкокортикоидов (например, кортизона) является следствием терапевтического лечения, проводимого врачом (ятрогенное введение). Глюкокортикоиды, как правило, вводят для подавления иммунной системы, но при этом нельзя не учитывать другие эффекты гормона. Часто бывает трудно оценить соотношение пользы и вреда при продолжительном лечении глюкокортикоидами.
Действие. Избыток глюкокортикоидов приводит к интенсивному расщеплению жиров и белков (прежде всего в мышцах, соединительной ткани, основном веществе кости) на периферии (преимущественно в конечностях). Гликолиз подавляется, глюконеогенез стимулируется. Возникающая гипергликемия обусловливает выделение инсулина, липогеиное действие которого преобладает над липолитическим эффектом глюкокортикоидов в туловище, но нс в конечностях. Поскольку липолитический эффект глюкокортикоидов особенно выражен на периферии, одновременная секреция стимулирующих липолиз глюкокортикоидов и тормозящего липолиз инсулина приводит к перераспределению жировой ткани и образованию отложений в области туловища и шеи (лунообразное лицо, центрипетальное ожирение, бычья шея). Глюкокортикоиды являются антагонистами инсулина, что вместе с их ингибирующим действием на секрецию инсулина может вызвать сахарный диабет (стероидный диабет). Повышение свободных жирных кислот способствует образованию ЛПОНП в печени.
Эффекты глюкокортикоидов на кровообращение приводят к повышению АД, на желудок — к повреждениям слизистой оболочки (язва желудка). В крови увеличивается концентрация нейтрофилов, однако активность иммунной системы подавлена из-за снижения количества ингибирования или лимфоцитов и нарушения синтеза воспали

тельных медиаторов.
Из-за подавления пролиферации клеток и синтеза коллагена осложнено заживление ран. Недостаток коллагеновых волокон ослабляет прочность соединительной ткани и в коже образуются стрии, или растяжки. У детей нарушен рост костей, у взрослых разрушение костей может привести к остеопорозу.
Повышенный минералокортикоидный эффект способствует развитию гипертонии, снижению концентрации К+ в плазме и развитию метаболического алкалоза.
Эффекты избытка кортизола иногда возникают без повышения его концентрации в плазме.
Вэтом случае наблюдается метаболический синдром.
•инсулинорезистерности с последующим развитием сахарного диабета.
Эти нарушения могут быть объяснены усилением эффектов глюкокортикоидов, однако при метаболическом синдроме их концентрация в плазме крови не увеличивается. Это можно объяснить повышением продукции кортизона в периферических тканях, увеличением
активности рецепторов глюкокортикоидов или глюкокортикоидзависимых генов. Одним из таких генов является киназа SGK1 (serum and glucocorticoid-related kinase 1), которая путем стимуляции эпителиальных натриевых каналов в почке приводит к задержке Na+ и гипертонии. Кроме того, она усиливает всасывание глюкозы в кишечнике, что вызывает увеличение концентрации глюкозы в плазме, секрецию инсулина, стимулируемый инсулином рост жировых отложений и в конечном итоге ожирение. Ожирение приводит к развитию инсулинорезистентности и сахарного диабета.
Дефицит глюкокортикоидов
Дефицит глюкокортикоидов является следствием недостатка влияния АКГТ или первичного нарушения продукции кортизола в коре надпочечников. Абсолютный недостаток глюкокортикоидов может привести к несовместимым с жизнью последствиям.
Причины дефицита глюкокортикоидов. Дефицит глюкокортикоидов может возникать изза снижения секреции АКТГ или нарушения синтеза глюкокортикоидов в коре надпочечников. Синтез АКТГ может снижаться при удалении кортизолили АКТГпродуцирующих опухолей или после резкой отмены глюкокортикоидной терапии.
■■■ При опухоли, клетки которой выделяют кортизол или АКТГ, или лечении глюкокортикоидами секреция АКТГ-РГ и АКТГ подавляется по механизму отрицательной обратной связи и ПОМК-клетки атрофируются. Внезапное снижение концентрации кортизола в плазме не может привести к соответствующей секреции АКТГ
При первичном нарушении коры надпочечников (например, при недостаточности надпочечников) секреция АКТГ увеличивается из-за отсутствия обратной связи.
Если синтез глюкокортикоидов ограничен генетическим дефектом фермента, то усиленная секреция АКТГ приводит к гипертрофии коры надпочечников и к повышенному образованию предшественников кортизола. Предшественники и особенно субстрат дефектного фермента накапливаются. Таким образом, в зависимости от дефекта фермента могут усиливаться или ослабляться эффекты активных минералокортикоидов или андрогенов (андрогенитальный синдром).

21.7. Адреногенитальный синдром
Некоторые дефекты ферментов синтеза гормонов коры надпочечников нарушают образование кортизола. Снижение концентрации кортизола стимулирует секрецию АКТГ, который усиливает синтез предшественников гормонов и их метаболитов.
При дефекте 21β-гидроксилазы происходит снижение уровня минералокортикоидов вместе с повышением уровня андрогенов, так как в случае дефекта гидроксилазы образование андрогенов преобладает над образованием минералокортикоидов (11дезоксикортикостерон). Поскольку повышенное образование АКТГ, несмотря на ограниченную активность ферментов, как правило, приводит к достаточному уровню синтеза кортизола, то на первый план выходит не недостаток глюкокортикоидов, а усиление продукции андрогенов и повышенное (дефект 11β-гидроксилазы) или пониженное (дефект 21β-гидроксилазы) образование минералокортикоидов. Усиление синтеза андрогенов индуцирует развитие ложных половых органов у девочек (вирилизация) и преждевременное половое созревание у мальчиков, при котором происходит изменение голоса, мужской тип оволосенения тела, рост полового члена и повышение полового влечения. Избыток минералокортикоидов прежде всего приводит к повышению АД (гипертонии), а их недостаток ведет к гипотонии.
Действие. Дефицит глюкокортикоидов приводит к гипогликемии из-за усиления захвата глюкозы мышцами, что активирует антагонистические регуляторные механизмы (например, через адреналин). Это косвенно вызывает усиление гликогенолиза, липолиза и расщепление белков, мышечную атрофию и потерю веса. Недостаток эффектов глюкокортикоидов на кровообращение приводит к опасному для жизни снижению АД, что усиливается из-за потери натрия и воды за счет уменьшения их минералокортикоидного действия. В крови уменьшается число нейтрофилов, а число лимфоцитов и эозинофильных гранулоцитов увеличивается. Секреция соляной кислоты в желудке нарушается. При первичном недостатке гормонов коры надпочечников из-за повышенной стимуляции ПОМК-клеток через АКТГ-РГ повышается секреция АКТГ и меланоцитстимулирующего гормона, действие последнего приводит к избыточной пигментации кожи (болезнь Аддисона).
Регуляция активности фосфолипазы А2
•Основными факторами, регулирующими активность цитозольной фосфолипазы, являются концентрация внутриклеточного Са2+ и активность митогенактивируемых протеинкиназ (MAPK) .
•В неактивированных клетках концентрация внутриклеточного Са2+ обычно колеблется в пределах 30-100 нмоль/л. При активации различных рецепторов концентрация ионов Са2+ может достигать 1-3 мкмоль/л. Увеличение активности цитозольной ФЛА2 происходит в диапазоне концентраций ионов Са2+ 150-800 нмоль/л. При увеличении
концентрации ионов Са2+ происходит миграция фосфолипазы к мембранам и её прикрепление к ним (подобно ПКС), после чего начинается гидролиз фосфолипидов. Основными субстратами ФЛА2 становятся фосфолипиды с арахидоновой кислотой в положении sn-2
•фосфорилирование митогенактивируемыми протеинкиназами (MAPK) по остатку серина приводит к значительному увеличению активности фосфолипазы А2.
Т. о., цитозольная ФЛА2 принимает участие как в регуляции синтеза эйкозаноидов при остром ответе клеток на различные провоспалительные стимулы, так и в ряде случаев при отложенном ответе
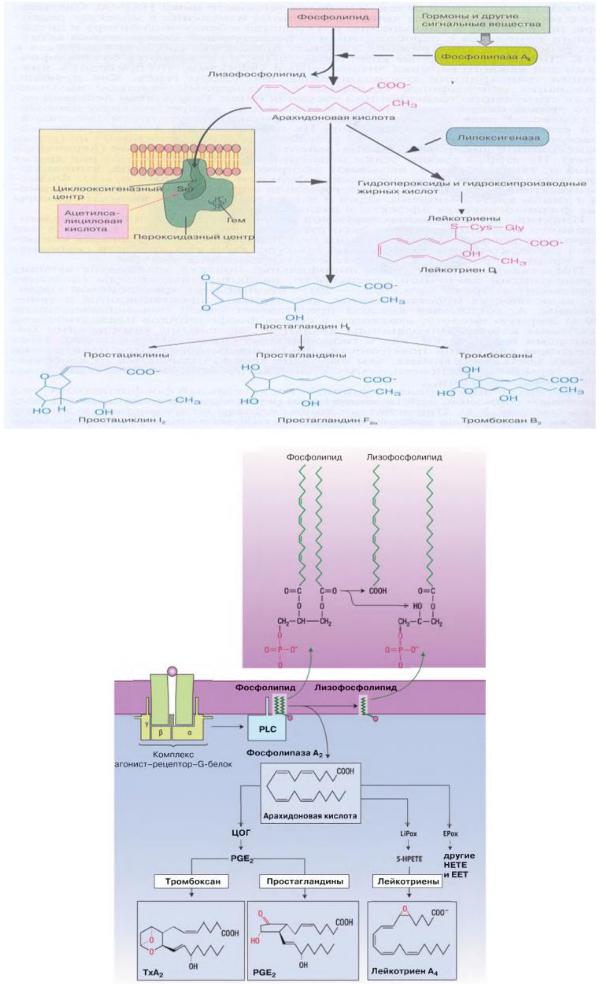
Роль ФЛА2 в синтезе эйкозаноидов
В результате активации фосфолипазы А2 (PLA2) из фосфолипидов клеточной мембраны обильно высвобождается ненасыщенная жирная кислота — арахидоновая кислота. При повышении концентрации внутриклеточных ионов Са2+ и наличии опухоли клетки PLA2 активируется. Многие медиаторы, вызывающие воспаление (в частности, гистамин, серотонин, брадикинин), стимулируют PLA2, а глюкокортикоиды, наоборот, замедляют ее образование.
Продукты циклооксигеназы. При участии ферментов циклооксигеназы и пероксидазы арахидоновая кислота может преобразовываться в простагландин Н2 (PGI12). Из PGH2 в других реакциях способны появляться простагландины (например, PGE2 и PGF2a) и тромбоксан. Простагландины, в частности, образуются клетками, которые недостаточно снабжены энергией или подвергаются вредному воздействию.
Циклооксигеназа ЦОГ1 экспрессируется убиквитарно (прежде всего в тромбоцитах, желудке, почках).
При воспалительных процессах в макрофагах, лейкоцитах и фибробластах усиленно выделяется индуцируемая циклооксигеназа (ЦОГ2) и обеспечивает повышенное образование простагландинов. Тромбоксан высвобождается в основном при активации тромбоцитов.
Продукты липоксигеназы. При воспалительных процессах прежде всего активируются липоксигеназы, образующие лейкотриены.
Эпоксигеназа. Наконец, в результате окисления из арахидоновой кислоты образуются гидроксиэйкозатетраеновые кислоты (ПЕТЕ) и эпоксиэйкозагетраеновые кислоты (ЕЕТ)
Эйкозаноиды
•Комплекс физиологически активных органических соединений, являющихся производными арахидоновой (С20) кислоты
•Эйкозаноиды служат вторичными мессенджерами гидрофильных гормонов, передающих сигналы при посредничестве G-белков
•Эйкозаноиды являются паракринными регуляторами
•Эффекты эйкозаноидов определяются свойствами клеток-мишеней
Лейкотриены
1)Активируют аллергические реакции
2)Активируют иммунные реакции
3)Активируют анафилактические реакции
4)Сокращение гладких мышц дыхательных путей
5)Сокращение гладких мышц пищеварительного тракта
6)Оказывают сосудосуживающие действие
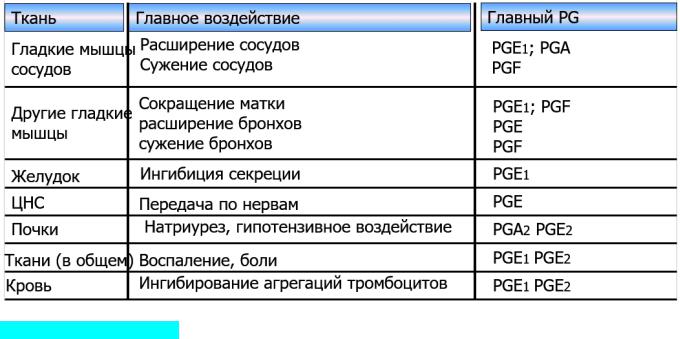
Эффекты простагландинов
Действие эйкозаноидов
Эйкозаноиды выступают как в роли внутриклеточных медиаторов, так и в роли сигнальных веществ для соседних клеток; они должны противодействовать перегрузке и повреждению клеток и тканей.
Простагландины. Действие простагландинов в первую очередь нацелено на защиту клетки, образующей простагландин. Оно ограничивает функции клетки (например, выделение соляной кислоты в желудке) и, расширяя сосуды, способствует обеспечению клетки кислородом и другими веществами. Особенно большое значение отводится простагландинам при воспалительных процессах. Они вызывают боль и повышение температуры тела, наряду с этим усиливая кровоснабжение и эластичность кровеносных сосудов, что облегчает проникновение антител в поврежденную ткань. Простагландины могут вызывать апоптоз инфицированных клеток, а при последующем фагоцитозе апоптотических клеток уничтожать возбудителей заболеваний.
Тромбоксан. Тромбоксан, образующийся прежде всего при активации тромбоцитов, в первую очередь служит для свертывания крови.
Блокаторы циклооксигеназы. К наиболее часто применяемым фармацевтическим препаратам относятся блокаторы ЦОГ. В процессе торможения синтеза простагландинов они снижают температуру тела, ослабляют боль и останавливают воспалительные процессы. Затормаживая процесс образования тромбоксана, блокаторы снижают свертываемость крови.
Действие лейкотриенов. Лейкотриены прежде всего принимают участие при воспалительных процессах. Вызывая сокращение мышц дыхательных путей, они способны затруднять дыхание.
Действие НЕТЕ и ЕЕТ. НЕТЕ и ЕЕТ стимулируют процесс высвобождения Са2+ и способствуют пролиферации клетки.

Вопрос 13. Йодсодержащие гормоны щитовидной железы: физиологическая роль, регуляция
секреции.
Тироидные гормоны.


Т3 и Т4 в последствии подвергаются дейодированию с участием йодотиронин-дегалогеназ клетокмишеней. Данные ферменты содержат в активном центре остаток селеноцистеина, принимающий участие в дейодировании гормонов. Йодотиронин-дегалогеназа 2-го типа (5’-дейодиназа) катализирует дейодирование наружного кольца битирозинов, превращая малоактивный Т4 в активный Т3. Фермент располагается в мембране ЭПС рядом с ядром, в итоге образовавшийся Т3 сразу же попадает в ядро, где оказывает свое действие.
Инактивация тиреоидных гормонов осуществляется путем дейодирования, с участием дегалогеназы 3- го типа (5-дейодиназы). Данный фермент катализирует дейодирование внутреннего кольца Т4 и Т3, что приводит к образованию лишенных биологической активности йодотиронинов, реверсивного Т3, rT3, (в отличие от активного Т3 у rT3 остаток йода отсутствует во внутреннем кольце) и дийодтиронина, Т2.
Поступившие в печень йодотиронины претерпевают гидрофилизацию путем сульфатирования, либо глюкуронирования по свободному фенольному гидроксилу, после чего удаляются в желчь.
