
897
.pdf
Ключевые слова: сельскохозяйственные посевные площади, валовый сбор, продовольственная безопасность, овощная продукция.
Всовременных динамично изменяющихся политических и экономических условиях, вызвавших значительные перемены во внешнеторговой политике и внутренней социально-экономической ситуации, одной из приоритетных задач является улучшение круглогодичного продовольственного обеспечения населения продуктами питания собственного производства, в частности овощной продукцией.
Пермский край располагается не в лучшем месте в России для сельского хозяйства, так как подвержен распространению дерново-подзолистых почв с низким плодородием, а особенности рельефа и обильные летом дожди способствуют коррозии. Из-за этого также происходит деградация редких черноземов (большинство из них находятся в Суксунском и Кунгурском районах). В целом, 40% площади земель в стране в той или иной степени подвержены деградации. Но рациональное внесение удобрений делают Пермский край пригодным для организации сельхоз работ.
ВПермском крае в 2021 год размеры сельхоз площадей, выделяемых под овощные культуры, достигли своего исторического минимума и составляют 4,4 тыс. га. С 2001 года площадь сельхоз угодий уменьшилась на 12,2 тыс. га, в процентном соотношении на 73,5% (Рис. 1). Из года в год нарастают тенденции неэффективного использования земельных ресурсов. Достаточно сказать, что из общего объёма пахотных земель высок процент земель, которые находятся в критическом состоянии, после чего их использование по продуктивности теряет смысл вообще: по уровню кислотности, по содержанию фософора, по уровню плодородия. Неопределенность и запутанность земельных отношений, неотработанность процедур движения земель в рамках земельного кодекса, бесхозяйственность, эрозия, снижения плодородия и безответственность органов власти к состоянию земельных ресурсов – такова общая картина землепользования в Пермском крае. В краевом фонде нераспределенных – бесхозных – земель к 2020 году числится около полумиллиона га. Если общая площадь пашни в крае составляет 4 068,8 тыс. га, то 1215% от общей площади пахотных земель до сих пор не определены, юридически не оформлены. По последним официальным данным Пермстата основная и большая часть посевных площадей сосредоточена в хозяйствах населения – 79,5% от общей площади под овощные культуры, 13,6% - в КФХ и ИП, и лишь 9% - в руках сельхоз организаций.
Рисунок 1. Посевные площади под овощные культуры в Пермском крае
181
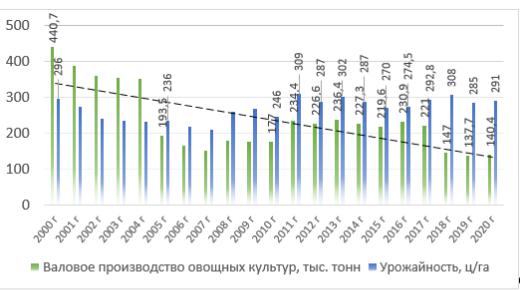
Валовые сборы овощной продукции также имеют тенденцию к сокращению. Темп роста говорит об отрицательной динамике валовых сборов в среднем на 4% в течении 20 лет (Рисунок 2). Это связано в первую очередь с сокращением посевных площадей, при этом нехватка специализированной техники, рабочих на уборке урожая, резко сокращает объемы убранной продукции, что влияет на экономические показатели и целесообразность производства культуры в хозяйстве. Потребность в овощах в 2020 году удовлетворена на 47,3%, при этом плановый показатель уровня продовольственной безопасности Пермского края в 2020 году выполнен ровно на 83% [2]. Снижение объёмов производства продуктов растениеводства в 2015 году обусловлено обильными осадками, а в 2016 году – засухой. Урожайность с.-х. культур является основным фактором, который определяет объём производства продукции. В Пермском крае происходит снижение урожайности в 2020 на 5 ц с га по сравнению с 2000 г.
Рисунок 2. Валовые сборы овощных культур в Пермском крае
Производство 45% от общего валового сбора овощей сосредоточено в 5 южных муниципальных районах: Пермском, Ординском , Нытвенском, Кишертском, Краснокамском.
Составлена упрощенная таблица баланса производства и потребления, проведена оценка уровня продовольственного обеспечения с учетом пороговых значений продовольственного самообеспечения на основе анализа современного состояния АПК региона по методике Троценко Вячеслава Михайловича, к. э. н., доцента кафедры бухгалтерского учета и финансов Пермского ГАТУ [1].
Уо = |
+− |
, |
|
||
|
|
|
где q – фактические объемы производства продукции в регионе; N – норма потребления продукта в год; n – численность населения региона; Ip – ввоз продукции, включая импорт; Ep – вывоз продукции, включая экспорт.
Также рассчитан уровень импортопотребления и импортозамещения в процентах.
182
Таблица 1 Динамика производства и потребления овощей 2000 - 2020 г., тыс. т
Наименование |
|
|
Овощные культуры |
|
|
|||
|
2000 |
2010 |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
|
|
|
|
|
|
|
|
|
Производство |
440,7 |
177 |
219,6 |
230,9 |
221 |
147 |
137,7 |
140,4 |
Ввоз - импорт |
30,2 |
134,5 |
128,5 |
111,3 |
112,9 |
120,7 |
104,7 |
104,3 |
Вывоз – экспорт |
0,1 |
0,1 |
15,6 |
11,7 |
16,7 |
12,3 |
11,8 |
6 |
Личное и произ-е потреб-е |
360,4 |
264,7 |
262,4 |
272,4 |
231,9 |
236,4 |
237,2 |
232,2 |
Потери |
19,6 |
7,5 |
7,9 |
8,4 |
7,5 |
7,6 |
9 |
5,9 |
Норма потреб-я, кг/г. |
|
|
|
140 |
|
|
|
|
Факт. потреб-е, кг/г. |
119 |
100 |
85 |
82 |
82 |
85 |
87 |
87 |
Уровень обеспечения,% |
116,8 |
84 |
90 |
89,6 |
86 |
69,5 |
63,1 |
65,3 |
Импортопотребление, |
7,9 |
49,4 |
47,5 |
39,6 |
47,1 |
49,4 |
42,5 |
43,8 |
% |
|
|
|
|
|
|
|
|
Импортозавсимость, % |
6,8 |
76 |
58,5 |
48,2 |
51 |
82,1 |
76 |
74,3 |
Исходя из полученных данных, можно сказать, что в 2000 году Пермская область полностью обеспечивала себя овощной продукцией в зависимости от нормы, рекомендованной к потреблению, но уже к 2020 году уровень обеспечения снизился более, чем на половину до 65,3%. Фактическое потребление овощей не соответствует нормам потребления на душу населения в год, в 2020 году этот показатель составил меньше на 53 кг/год. С уменьшением сельхозугодий, выделяемых под овощные культуры, в 3,5 раза уменьшилось производство овощей, что повлияло на увеличение зависимости региона от импорта, в том числе и ввоза продуктов овощеводства. К 2020 году этот показатель поднялся до 74,3% с 6,8% в 2000 годы.
Литература
1.Троценко, В. М. Вопросы продовольственного обеспечения Пермского края / В. М. Троценко // Московский экономический журнал. – 2019. – № 9. – С. 22. – DOI 10.24411/2413-046X- 2019-19030.
2.Доктрина продовольственной безопасности Российской Федерации: утв. Указом Президента Российской Федерации от 21 января 2020 г. № 20. URL: http://www.consultant.ru/document/cons_doc_LAW_343386
3.Министерство сельского хозяйства и продовольствия Пермского края: официальный сайт. – Пермь, 2022. – URL: https://agro.permkrai.ru/
4.Территориальный орган государственной статистики по Пермскому краю: официальный сайт. – Пермь, 2022. – URL: https://permstat.gks.ru/
5.Федеральная служба государственной статистики: официальный сайт. – Москва, 2022.
–URL: https://rosstat.gov.ru/
УДК 640.4
П.А. Богомякова – студентка; С.А. Семакова – научный руководитель, доцент, канд. фарм. наук,
ФГБОУ ВО Пермский ГАТУ, г. Пермь, Россия АНАЛИЗ ГИГИЕНИЧЕСКОЙ ОЦЕНКИ СТУДЕНЧЕСКОГО ПИТАНИЯ
Аннотация. Одной из самых актуальных проблем современного общества является проблема здорового питания. Полноценное питание предусматривает потребление необходимого количества белков, жиров, углеводов, витаминов, макро и микроэлементов для нормального функционирования организма. Проблема питания студентов стоит особенно остро. В связи с недостатком времени у студентов
183
нет возможности соблюдать правильный режим приемов пищи в количестве 3-4 раз в день. Нарушение режима дня и отдыха, хроническое недосыпание, характер питания и интенсивная информационная нагрузка могут привести к нервно-психи- ческому срыву. Для предотвращения негативной ситуации большое значение имеет правильно организованное рациональное питание. По данным ВОЗ, здоровье человека состоит из 15% уровня здравоохранения, 15% наследственности и 70% уровня жизни.
Ключевые слова: питание, рацион, обмен, сутки, питательные вещества.
Цель исследования. Анализ гигиенической оценки студенческого питания. Метод исследования. Для анализа питания была опрошена студентка 2
курса Пермского ГАТУ, проживающая в общежитии.
Результаты и их обсуждение. Для того, чтобы проанализировать питание, необходимо рассчитать норму потребления килокалорий, белков, жиров и углеводов, а также макро и микроэлементов в день. Расчет основного обмена по формуле Рида, результат которой составил 1824 ккал/сутки. Норма белков 74 г/сутки, жиров 63 г/сутки, углеводов 356 г/сутки. В качестве макроэлемента был взят кальций, норма которого составляет 1000мг/сутки, а норма микроэлемента цинк-12 мг/сутки. Так же было прведено анкетирование, которое содержало следующие вопросы:
1.Уделяете ли вы внимание своему питанию?
2.Используете ли вы диеты в своем питании?
3.Занимаетесь ли вы физической активностью?
4.Занимаетесь ли вы дополнительно умственной активностью?
Только на 2 вопрос был дан отрицательный ответ, это говорит о том, что у студента здоровое отношение к своему телу, здоровью.
Рассчитали индекс массы тела, который определили путем деления имеющийся массы тела (кг) на рост (м), возведенный в квадрат. Индекс массы тела составил 20,28, что является нормальной массой тела.
Для того, чтобы провести анализ питания студента, необходимо провести сравнение практического и теоретического основного обмена. Изучив рацион питания, были найдены следующие данные: потребление ккал/сутки 1745, белков 54 г/сутки, жиров 50 г/сутки, углеводов 350 г/сутки, кальция 501 мг/сутки и цинка 7 мг/сутки. Можно заметить, что ни один показатель не соответствует норме.
В рационе питания выявлен дефицит потребления рыбы и морепродуктов, продуктов животного происхождения, молочных и кисломолочных продуктов.
Причина этому может послужить нехватка времени для приема пищи, дорогие продукты, в которых большое содержание питательных веществ, а так же стресс, из-за которого может пропасть аппетит.
Последствия такого питания могут быть разные. В данном случае потребление килокалорий в день не совсем критичное, поэтому проблем с усталостью, нехваткой энергии быть не должно. Однако, из-за того, что выявлен дефицит потребления некоторых продуктов, развивается такое заболевание как железодефицитная анемия, которая иногда мешает привычному образу жизни. Наблюдается головокружение, судороги в ногах, нарушение сна и т.д.
184

Вывод. Полученные результаты показывают, что качество питания студента не соответствует принципам рационального питания, не сбалансировано, как по основным макронутриентам, так и по содержанию микроэлементов и витаминов.
Литература
1.Денисова В.А., Полезные и вредные пищевые продукты для учебной деятельности студентов // Рациональное питание, пищевые добавки и биостимуляторы. – 2016. – № 3. – С. 15-18.
2.https://cyberleninka.ru/article/n/pravilnoe-pitanie-v-formirovanii-zdorovogo-obraza- zhizni/viewer (Наука-2020. 2019. № 10(35) 39/155 УДК 796 ПРАВИЛЬНОЕ ПИТАНИЕ В ФОРМИРОВАНИИ ЗДОРОВОГО ОБРАЗА ЖИЗНИ)
3.Гигиена питания: учеб. для студ. высш. учеб. заведений/ Королев А.А. – М. : Издательский центр «Академия», 2016.
4.https://health-diet.ru/table_calorie/ https://vitamini.ru/vse-o-mineralakh/micro-i-macro/
УДК 631.46 : 631.427.4
А.И. Ботин, Ю.А. Коломина – студенты; М.А. Алёшин – научный руководитель, доцент кафедры агрохимии, канд. с.-х. наук,
ФГБОУ ВО Пермский ГАТУ, aleksejb3095@gmail.com
МИКРОБНЫЕ БИОПЛЕНКИ
Аннотация. Представлены данные о микробных биопленках и их строении, особенностях их формирования. Показано влияние биопленки на почву и рост растений. Экспериментальным путем обнаружены биопленки, образованные на соломе зерновых культур при её разложении в почве.
Ключевые слова: микробные биопленки, морфологическое строение, образование биоплёнок.
Актуальность. Поведение бактерий привлекает большое внимание исследователей во всем мире. Изучается связанное с субстратом сообщество микроорганизмов, состоящее из одного или нескольких видов – биопленка [1]. На сегодняшний день суть биопленок изучена еще не в полном объёме, следовательно, тема остается ещё актуальной.
Почва является одной из естественных сред обитания множества микроорганизмов. Среди них более 99% существуют в виде биопленки. С экологической точки зрения распространение биопленок в почве бесконечно. Они участвуют в биогеохимическом круговороте, разложении органического вещества, динамике питательных веществ, защите сельскохозяйственных культур [7].
Целью данной работы было изучение микробных биоплёнок, образующихся на поверхности соломы при её заделывании в почву. На основании чего, были поставлены следующие задачи: познакомиться с этапами формирования микробных биоплёнок, выяснить роль биоплёнок в жизнедеятельности почвенных и эпифитных микроорганизмов, опытным путём установить факт наличия биоплёнки на поверхности соломы злаковых культур при её внесении в почву.
Строение биопленок. Согласно современным представлениям живая полноценная биоплёнка представляет собой образование, сформированное микроколониями микроорганизмов в форме башен или грибов (15-20% объема) и экзополимерного матрикса (75-85% объема). Матрикс высоко гидратирован, по некоторым
185
оценочным данным на 97% состоит из связанной воды. По своей структуре он напоминает «губку», т.е. имеет пористую структуру, пропускающую низкомолекулярные соединения, но задерживающую крупные молекулы, белки и частицы среды. В том числе, в структуре биопленки нередко выделяют водные каналы, по которым растворенные в среде вещества поступают к нижележащим слоям клеток [3]. Наблюдения [4] показали, что матрикс бактериальных биоплёнок состоит из различных биополимеров – полисахаридов, белков и даже ДНК. Состав матрикса может сильно варьироваться в зависимости от условий среды и вида микроорганизмов.
Образование биопленок. Микробные биопленки образуются в результате прикрепления, роста и агрегация отдельных клеток на естественных или искусственных поверхностях [12]. Процесс формирования биопленки включает пять этапов:
Этап 1. Обратимое прикрепление к поверхности. Чаще всего микроорганизмы существуют в виде свободно плавающих масс или единичных (например, планктонных) колоний. Однако в нормальных условиях большинство микроорганизмов стремятся прикрепиться к поверхности и, в конечном счете, образовать биопленку.
Этап 2. Перманентное прилипание к поверхности. По мере размножения бактерий они более прочно прилипают к поверхности, дифференцируются, обмениваются генами, что обеспечивает их выживаемость.
Этап 3. Формирование слизистого защитного матрикса / биопленки. На этой стадии клетки активно делятся, а выделяемый матрикс удерживает вместе всю колонию.
Этап 4. Микроколонии сливаются и образуется зрелая биопленка, имеющая сложную трёхмерную структуру.
Этап 5. При низком содержании питательных веществ, клетки способны покидать биопленку и переходить в планктонную форму, что называется дисперсией (выброс бактерий). В результате дисперсии от биоплёнки периодически отрываются отдельные клетки, способные через некоторое время прикрепиться к поверхности и образовать новую колонию [9].
Влияние биопленки на почву и рост растений. Образование биоплёнок рассматривается в качестве процесса взаимодействия почвенных бактерий с субстратами, которое влияет на здоровье растений и почвы [14]. Существуют биопленки бактерий, стимулирующие рост растений (PGPB), улучшают потребление элементов питания корневой системой растений, улучшают рост растений, урожайность и качество сельскохозяйственных культур [13]. По сравнению с планктонными клетками, биопленки, прикрепленные к корням растений или расположенные в ризосфере, имеют возможность для потребления большего количества питательных веществ [6]. Биопленки, связанные с ризосферной областью растений, защищают их от патогенов и действуют как агенты биоконтроля. Они оказывают сильное влияние на рост за счет повышения иммунитета растений к стрессовым условиям [8], являются хорошей альтернативой использованию удобрений и пестицидов [10]. Выработка внеклеточных ферментов биопленками способствует разложению органического вещества почвы [10]. Благодаря своей стойкой природе, обусловленной
186

матрицей из полисахаридов, биопленки устойчивы к засолению [11], засухе [17] и тяжёлым металлам [16].
Существует несколько биопленок, способных к фиксации азота. Включение ризобиальных штаммов приводит к образованию грибково-ризобиальных биопленок (FBBS). Благодаря этому, грибковые ризобиальные биопленки могут выступать в качестве биопленочного инокулята для семян бобовых и других сельскохозяйственных культур [13].
Методика проведения исследования. Исследование по установлению скорости формирования микробных биоплёнок на поверхности соломы злаковых культур было проведено в качестве лабораторного модельного эксперимента. Предметом изучения были колонии микроорганизмов, интенсивное формирование которых на соломе происходит сразу после её внесения в почву. Инкубирование соломы
впочве проводилось на протяжении 10 дней. Отбор образцов производили на 3 и 5 день, а также по окончанию срока инкубирования. После извлечения соломы из почвы проводилось механическое удаление прилипших частичек с её поверхности. Оставшееся количество почвы смывали водой. В последующем солома помещалась
враствор красителя. О наличии микробных биоплёнок на поверхности соломы свидетельствует наличие окрашивания красного цвета.
Результаты исследования. По прошествии 3 суток с начала инкубирования соломы в почве, обнаружены небольшие окрашенные участки, составляющие около 10 % от всей площади поверхности соломы (табл. 1).
Таблица 1 Интенсивность формирования микробных биоплёнок на поверхности соломы
злаковых культур
Срок инку- |
|
Длительность окрашивания |
|
|||
бирования |
|
|
|
|
|
|
5 мин |
10 мин |
|
30 мин |
1 час |
2 часа |
|
|
|
|
|
|
|
|
3 суток |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 суток |
|
|
|
|
|
|
|
|
|
|
|
|
|
10 суток |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
187 |
|
|
|
На 5 и 10 сутки инкубации размеры окрашенных участков увеличились до 15 и 25% от всей площади поверхности соломы соответственно.
Экспериментальные лабораторные исследования В.К. Плакунова, С.В. Мартьянова (2015) показали, что планктонные бактерии (стафилококки, стрептококки, псевдомонады, кишечная палочка) обычно: 1) присоединяются друг к другу в течение нескольких минут; 2) образуют прочно присоединенные микроколонии в течение 2-4 часов; 3) вырабатывают внеклеточные полисахариды и становятся значительно более толерантными антибиотикам, антисептикам и дезинфектантам, в течение 6-12 часов; 4) вовлекаются в полноценные колонии биопленки, которые очень устойчивы к биоцидам и теряют планктонные бактерии в течение 2-4 дней в зависимости от видов бактерий и условий роста; 5) быстро восстанавливаются после механического разрушения и вновь формируют зрелую биопленку в течение 24 часов.
Выводы:
•Биопленка представляет собой образование, сформированное микроколониями микроорганизмов и экзополимерного матрикса. Основными компонентами матрикса являются полисахариды и белки;
•В процессе своего развития биопленка проходит 5 этапов: обратимая адгезия, необратимая адгезия, микроколония, зрелая биопленка, дисперсия;
•В результате инкубирования соломы в почве микробная биоплёнка на её поверхности была сформирована уже на 3 сутки. Окрашенные участки соломы составили 10%;
•На 5 сутки инкубирования соломы в почве, микробная биоплёнка сформировалась на 15% от всей площади поверхности соломы, на 10 сутки площадь бипленки составила 25%.
Микробные биопленки имеют важное значение для роста и развития растений, происходящих в почве микробиологических процессов. Поэтому необходимо их дальнейшее тщательное изучение.
Литература
1.Байматов Р.А., Нурузова З.А., Эргашева З.Н. Биопленка – как форма существования мик- роорганизмов//Re-health journal, 2019, №3, С. 58 – 68.
2.Плакунов В. К., Мартьянов С. В., Тетенева Н. А., Журина М. В. Управление формированием микробных биопленок: анти- и пробиопленочные агенты//Микробиология, 2017, Т. 86, № 4, С. 402 – 420.
3.Рахматулина М.Р., Нечаева И.А. Биопленки микроорганизмов и их роль в формировании резистентности к антибактериальным препаратам//Вестник дерматологии и венерологии, 2015, №2, С. 58 – 62.
4.Романова Ю.М., Гинцбург А.Л. Бактериальная биоплёнка как естественная форма существования бактерий в окружающей среде и организме хозяина//Микробиология, 2011, №3, С. 99 –
109.
5.Структурно-функциональная характеристика бактериальных биопленок / Т. А. Смирнова, Л. В. Диденко, Р. Р. Азизбекян и др.//Микробиология, 2010, Т. 79, № 4, С. 435 – 446.
6.Ahmad, I., Khan, M.S., Altaf, M.M., Qais, F.A., Ansari, F.A., Rumbaugh, K.P. Biofilms: an overview of their significance in plant and soil health. John Wiley & Sons, Ltd., Chichester, UK, 2017, Р. 1 – 25.
7.Balcazar, J.L., Subirats, J., Borrego, C.M. The role of biofilms as environmental reservoirs of antibiotic resistance. Front. Microbiol, 2015, № 6.
8. Burmolle, M., Kjoller, A., Sorensen, S.J. Biofilms in soil. In: Glinski, J., Horabik, J., Lipiec,
J.(Eds.), Encyclopedia of Earth Sciences Series. Springer, Dordrecht, Netherlands, 2011, Р. 70 – 75.
9.Cencetti C. Preparation and characterization of antimicrobial wound dressings based on silver, gellan, PVA and borax // Carbohydr. Polymers, 2012. V. 90, №3, P. 1362 – 1370.
188
10.Gupta, G., Snehi, S.K., Singh, V. Role of PGPR in biofilm formations and its importance in plant health. Biofilms in Plant and Soil Health. John Wiley & Sons, Ltd., Chichester, UK, 2017, Р. 27 – 42.
11.Paul, D., Lade, H. Plant-growth-promoting rhizobacteria to improve crop growth in saline soils: a review. Agron. Sustain, 2014, Dev. 34, Р. 737 – 752.
12.Rana, K.L., Kour, D., Yadav, A.N., Yadav, N., Saxena, A.K. Agriculturally important microbial biofilms: biodiversity, ecological significances, and biotechnological applications. New and Future Developments in Microbial Biotechnology and Bioengineering: Microbial Biofilms. Elsevier, 2020, Р. 221
–265.
13.Seneviratne, G., Zavahir, J.S., Bandara, W.M.M.S., Weerasekara, M.L.M.A.W. Fungalbacterial biofilms: their development for novel biotechnological applications.World J. Microbiol. Biotechnol, 2008, № 24, Р. 739 – 743.
14.Sun, X., Cai, P., Sorensen, S.J., Mortimer, M., Gao, C., Huang, Q., et al. Interspecific interactions in dual-species biofilms of soil bacteria: effects of fertilization practices. J. Soil Sediment,
2020, № 20, Р. 1494 – 1501.
15.Volk, E., Iden, S.C., Furman, A., Durner, W., Rosenzweig, R. Biofilm effect on soil hydraulic properties: esperimental investigation using soilgrown real biofilm. Water Resour, 2016, Res. 52, Р. 5813
–5828.
16.von Canstein, H., Li, Y., Leonha¨user, J., Haase, E., Felske, A., Deckwer, W. D., et al. Spatially oscillating activity and microbial succession of mercury-reducing biofilms in a technical-scale bioremediation system. Appl. Environ. Microbiol, 2002, №68, Р. 1938 – 1946.
17.Wang, D.C., Jiang, C.H., Zhang, L.N., Chen, L., Zhang, X.Y., Guo, J.H. Biofilms positively contribute to Bacillus amyloliquefaciens induced drought tolerance in tomato plants. Int. J. Mol. Sci, 2019, № 20, Р. 62 – 71.
УДК 543.554:635.071
Е.В. Буторина – магистрант; И.Д. Якимова – научный руководитель, доцент,
ФГБОУ ВО Пермский ГАТУ, г. Пермь, Россия
ИССЛЕДОВАНИЕ АНТИОКСИДАНТНЫХ СВОЙСТВ
ИСОДЕРЖАНИЯ НИТРАТОВ В КУКУРУЗЕ СОРТА «СТАНИЧНИК»
ИВ КОРМАХ ЖИВОТНОВОДСТВА
Аннотация. В статье представлены результаты исследования антиоксидантной активности с применением медиаторной системы K3[Fe(CN)6]/K4[Fe(CN)6] и содержания нитратов в растительных объектах потенциометрическим методом.
Ключевые слова: антиоксидантная активность (АОА), нитраты, потенциометрия, электроды, предельно-допустимые концентрации.
Целью данного исследования было определения суммарной антиоксидантной активности ряда пищевых продуктов животноводства и оценка содержания нитратов в этих объектах потенциометрическим методом с использованием ионселективного электрода.
Продукты на основе растительного сырья являются источниками биоантиоксидантов, для интегральной оценки всех присутствующих в сырье восстановителей органической природы используют величину – антиоксидантная активность (АОА) [7]. При определении АОА широко используют различные методы: химические, электрохимические, спектрофотометрические. Достаточно простым и информативным является потенциометрический метод с системой K3[Fe(CN)6]/ K4[Fe(CN)6], который адаптирован к анализу широкого круга объектов [4,5].
189
Антиоксидантная активность (АОА), это интегральный параметр, отражающий эффективную активность (концентрацию) функциональных групп соединений
– АО, присутствующих в том или ином объекте, выраженную в моль-экв/дм3 [2].
|
|
|
АОА = |
С − ∙ |
∙ |
р+ ал |
, |
(1) |
|
|
|
|
|
||||
|
|
|
|
1+ |
|
|
||
|
|
|
|
|
|
ал |
|
|
|
С |
( 2− 1)∙ ∙ |
|
|
|
|
|
|
где = |
∙ 10 2,303∙ ∙ |
; |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
Сox, Cred – концентрация окислителя и восстановителя в медиаторной системе, моль/дм3; Е1, Е2 – значения измеряемого потенциала в чистой медиаторной системе и в исследуемом объекте в среде медиаторной системы соответственно, В; n – число электронов; F – постоянная Фарадея (96500 Кл/моль); R – универсальная газовая постоянная (8,31 Дж/моль∙К); Т – температура, К; Vр – общий объём раствора, содержащего медиаторную систему в буфере, см3; Vал – аликвота исследуемого раствора, см3.
Для определения нитратов потенциометрическим методом используют мембранный NO3-– селективный электрод в паре с хлоридсеребрянным электродом сравнения. Экстракцию нитратов из растительного сырья производят 1%-ным раствором алюмокалиевых квасцов. Предварительно строят калибровочный график в координатах рNO3 – Е (мВ) [1].
По калибровочному графику находят величину рNO3, рассчитывают 3− по формуле (2):
|
− |
= 10−р 3 |
(2) |
||||||
3 |
|
|
|
|
|
|
|
||
Концентрацию нитратов в исследуемом объекте вычисляют по формуле (3). |
|
||||||||
|
|
С |
−∙ ∙ |
− |
|
мг |
|
|
|
Концентрация нитратов = |
|
|
3 |
3 |
∙ 1000 ( |
), |
(3) |
||
|
|
|
|
|
|
||||
|
|
|
|
|
|
кг |
|
||
где m - масса навески (5 г); V – объём раствора (50 мл), М – молярная масса нитратиона, г-моль (62 г/моль).
Экспериментальные исследования
1. Определение антиоксидантной активности
Определение АОА кормов и стеблей кукурузы проведено потенциометрическим методом [5], в качестве медиаторной системы использовали смесь 1 моль/дм3 гексацианоферрата (II) калия и 0,01 моль/дм3 гексацианоферрата (III) калия. Для исследования брали по 2 г исследуемого объекта, заливали 100 мл кипящей дистиллированной воды и настаивали 3 часа. Измерения проводили на приборе «Анион4100», используя платиновый и хлоридсеребряный электроды. Вначале в электрохимическую ячейку отбирали цилиндром 30 см3 фосфатного буфера (рН=7,2), добавляли 0,3 см3 раствора медиаторной системы, измеряли показание Е1, мВ. Далее вносили в этот раствор 0,6 см3 раствора исследуемого образца, измеряли показание Е2, мВ. Расчёт АОА проводили по формуле (1). Результаты исследований представлены в таблице 1,2.
2. Определение содержания нитратов
Определение нитратов проведено согласно методике [1], 1г мелкоизмельченного образца заливали 50 мл 1%-ного раствора алюмокалиевых квасцов, перемешивали 15 минут на магнитной мешалке и затем измеряли потенциал на приборе
190
