- •Общие вопросы
- •Цитофлавин при тотальной внутривенной анестезии
- •Ларингеальный масочный воздуховод является эффективным (и возможно безопасным) у отобранных здоровых беременных при плановом кесаревом сечении: проспективное исследование 1067 случаев
- •Результаты
- •Обсуждение
- •Влияние дроперидола на интервал qt
- •Предупреждение «в черной рамке»
- •Дроперидол
- •Удлиненный интервал qt, TdP и lqts
- •Влияние дроперидола на интервал qt
- •Практические рекомендации по использованию bis-монитора во время анестезии
- •Общий вид монитора.
- •Собственный опыт использования монитора глубины наркоза а – 2000x (Aspect Medical Systems, сша).
- •Причины, вызвавшие необходимость создания нового Организующего Приказа по анестезиолого-реанимационной службе рф.
- •Необходимые требования к новому Приказу.
- •2. Определение рамок компетенции (права и обязанности).
- •3. Организационно-штатная структура.
- •5. Желательные требования.
- •Материалы и методы Экспериментальная модель
- •Клинические исследования
- •Статистический анализ.
- •Результаты Жёсткая модель трахеи
- •Изучение трахеи свиньи
- •Исследование пациентов под наркозом
- •Критические пациенты с трахеостомическими трубками
- •Обсуждение
- •Приложение
- •Интубационная трубка lvlp
- •Материал и методы
- •Результаты
- •Обсуждение
- •Многокамерная фармакокинетическая модель как средство оптимизации режимов введения препаратов для внутривенной анестезии
- •Многокамерная фармакокинетическая модель как средство оптимизации режимов введения препаратов для внутривенной анестезии Введение
- •Объяснение контекстно-зависимого периода полувыведения
- •Анализ динамики концентрации фентанила при введении его согласно традиционным схемам
- •Цель проводимой работы
- •Разработка метода дозированного введения фентанила
- •Методика анестезии
- •Заключение
- •Профилактика гипотонии во время индукции анестезии диприваном у тяжелообожженных
- •Тотальная внутривенная анестезия на основе дипривана при многократных травматичных перевязках у больных с термическими поражениями
- •Терминология
- •Механизм интерплевральной аналгезии
- •Методика выполнения интерплевральной блокады
- •Клиническое применение интерплевральной аналгезии
- •Осложнения
- •Противопоказания
- •Заключение
- •Эффект обезболивания на выраженность операционного стресса
- •Психологическая подготовка
- •Фармакологическая подготовка
- •Седативные препараты, гипнотики и "большие" транквилизаторы
- •Опиоиды - наркотические аналгетики
- •Антихолинергические средства
- •Средства, влияющие на моторику желудка
- •Премедикация в амбулаторных условиях
- •Связывание с белками плазмы крови препаратов, наиболее часто применяемых в анестезиологии
- •Связывание с белками плазмы крови препаратов, наиболее часто применяемых в анестезиологии
- •Нормальная терморегуляция.
- •Влияние анестезии на нормальную терморегуляцию.
- •Тепловой балланс в операционной.
- •Физиологические и патофизиологические следствия гипотермии.
- •Больные повышенной группы риска по возникновению интраоперационной гипотермии.
- •Профилактика интраоперационной гипотермии.
- •Резюме.
- •Врожденные пороки сердца у взрослых: аспекты анестезии и интенсивной терапии послеоперационного периода
- •Альфа- 2 адреномиметики и анестезия
- •Факторы риска лёгочной аспирации, связанной с наркозом
- •Новые правила предоперационной подготовки натощак
- •Спорные вопросы темы будущих исследований
- •Введение
- •Гамк и глютамат как факторы раннего развития
- •Роль гамк и глютамата в нейронной дифференцировке и в формировании связей
- •Влияние анестетиков на развитие цнс
- •Кетамин
- •Пропофол
- •Мидазолам
- •Комбинированное использование анестетиков
- •Экстраполирование лабораторных результатов в клиническую практику
- •Самоконтроль
- •Ключевые моменты
- •Введение
- •Дыхательная система
- •Дыхательные пути
- •Вентиляция
- •Сердечно-сосудистая система
- •Жкт, эндокринная и другие системы
- •Лекарственные препараты и ожирение
- •Местное обезболивание
- •Хирургические и механические моменты
- •Ответы на вопросы самоконтроля
- •1. Введение
- •2. Материал и методы
- •2.1. Обследованные пациенты
- •2.2. Инструменты
- •2.2.1. Визуальная аналоговая шкала (ваш)
- •2.2.2. Шкала преодоления стресса Jalowiec (шпс)
- •2.3. Процедура
- •2.4. Анализ данных
- •3. Результаты
- •4. Обсуждение
- •История вопроса
- •Анализ опубликованных сообщений
- •Физиологический анализ
- •Клинические последствия и улучшение ведения больных
- •Информация в аннотации к препарату
- •Внутривенная анальгезия, контролируемая пациентом (вв акп)
- •Эпидуральная анальгезия, контролируемая пациентом (эакп)
- •Регионарная анестезия, контролируемая пациентом (ракп)
- •Интраназальная анальгезия, контролируемая пациентом (инакп)
- •Ионтофоретические трансдермальные системы для фентанила (итс)
- •Другие варианты акп
- •Заключение
- •Введение
- •Активность головного мозга во время анестезии, измеренная с помощью функционального нейроизображения
- •Изменения церебрального кровотока , церебрального метаболизма и оксигенации крови уровень-зависимым контрастом
- •Изменения функциональной комплексности во время анестезии
- •Активность мозга во время анестезии, оцененная электрофизиологическими методами
- •Активность мозга во время анестезии, оцененная по поведенческим тестам
- •Введение
- •Результаты
- •Заключение
- •Мониторинг температуры
- •Нормальная терморегуляция
- •Общепринятая модель терморегуляции
- •Номенклатура полиморфизмов
- •Фармакология и полиморфизм
- •Клинически значимые полиморфизмы
- •Заключение
- •Введение
- •Физиологические основы снабжения кислородом
- •Каковы способы оптимизации снабжения кислородом?
- •Конфликт интересов
Введение
В прошлом, методы для оценки эффектов анестезии на активность головного мозга были основаны только на измерении поведенческих исходов или на электрофизиологических данных, таких как запись электроэнцефалограмм ( EEG ) или вызванных потенциалов [1]. В прошлой декаде прогресс в нейро-научных методов расширил этот предел методов, включив позитронную эмиссионную томографию ( PET ) и функциональное изображение магнитного резонанса ( fMRI ) [2]. Эти методы определяют место гемодинамических и метаболических изменений, вызванных анестезия-индуцированными изменениями активности головного мозга, в то время как электрофизиологические методы отражают электрическую активность коры с высокой временной, но низкой пространственной разрешающей способностью.
В клиническом образце, текущие разработки нейромониторинга (например, биспектрального индекса ( BIS )) позволяют дать общую оценку нейронной активности во время операции [3]. Эти методы, однако, не прогнозируют движения или гемодинамические реакции на стимуляцию, но они не могут прогнозировать точно, когда отдельные пациенты будут восстанавливать сознание [4]. Отсюда, информированность (т.е. эксплицитная память) [5] и формирование имплицитной памяти наблюдается [6] даже при предположительно адекватной анестезии, руководствуясь нейромониторингом. Таким образом, важные аспекты церебральной функциональности во время анестезии остаются неизвестными [7]. С помощью дополнительных возможностей электрофизиологических методов и методов изображения мозга, этот пробел отчасти закрыт в современные годы при исследовании эффектов препаратов на нейронные связи, вовлекаемые в формирование внимания, процесс слуховой обработки данных, памяти и сознания. Более того, детальные исследования с четким контролем гипнотического состояния, адресованные бессознательному формированию памяти, уже выполнены. Таким образом, этот обзор суммирует современные данные, полученные различными методами исследования, и представляет систему взглядов, которая интегрирует текущую информацию.
Активность головного мозга во время анестезии, измеренная с помощью функционального нейроизображения
Функциональное нейроизображение - это в основном современные методы изображения головного мозга, такие как PET и fMRI . Оба метода успешно применяются в фармакологических исследованиях и при исследовании действия анестетиков в последнее десятилетие.
Изменения церебрального кровотока , церебрального метаболизма и оксигенации крови уровень-зависимым контрастом
Исследования PET и fMRI показывают изменения активности мозга вследствие действия анестетиков, при условии, что сохраняются нейроваскулярные связи при анестезии [8]. С помощью этих методов, доза-зависимое снижение церебрального кровотока ( CBF ), церебрального метаболизма глюкозы и оксигенации крови доза-зависимым ( BOLD ) сигналом показано примерно для всех анестетиков [9-14,15,16], за исключением кетамина [17,18] и закиси азота [19]. Эти действия указывают на общее снижение нейронной активности при углублении анестезии. Эффективность при снижении активности головного мозга предположительно одинакова для внутривенных и ингаляционных анестетиков, что оценивались относительно схожими снижениями церебрального метаболизма на сопоставимых уровнях анестезии севофлюраном и пропофолом [19]. Потеря сознания происходит при церебральном метаболизме глюкозы примерно 60-65% [20]. За исключением общего снижения нейронной активности, некоторые области головного мозга, расположенные в пределах ассоциативных полей коры головного мозга (например, теменная и лобная ассоциативная кора), таламусе и в среднем мозге, показывают заметно более выраженное снижение церебрального кровотока, церебрального метаболизма или сигнала BOLD при сравнении с общим снижением [9-14, 15, 16, 19, 21-24] (смотри таблицу 1). Эти действия показывают специфические эффекты анестетиков для создания бессознательного состояния, амнезии и нарушения внимания: существуют убедительные доказательства, что таламус играет ключевую роль при анестезия-индуцированном бессознательном состоянии [25, 26], так как относительное метаболическое снижение регионального метаболизма глюкозы [12, 25] и CBF [27] наблюдалось в этой области при адекватной анестезии. И наоборот, низкие концентрации анестетиков, как оказалось, не оказывают или оказывают только небольшой эффект на таламус [22] и области, вовлеченные в первичную обработку информации (рис. 1 и 2).
|
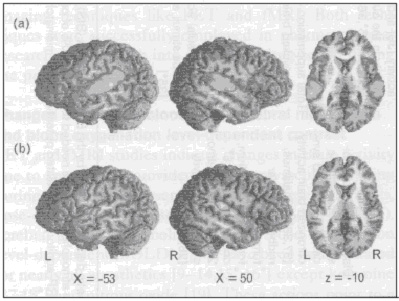
Рис 1. Активность мозга во время обработки лингвистической информации (бодрствование против седации). Функциональная активность головного мозга, вызванная слуховой обработкой данных, полученной во время бодрствования ( a ) и во время глубокой седации (т.е., когда индивидуумы отвечают на задачи языкового процесса) ( b ). Во время бодрствования, слуховая обработка данных вызывает активность мозга в височно-лобной связи. Глубокая седация (пропофол эффективная местная концентрация в пределах между 1,51 и 3,35 мкг/мл) ограничивает измеренную активность мозга в областях в и вокруг первичной слуховой коры в обоих полушариях. При эффективных местных концентрациях пропофола, превышающих 3,35 мкг/мл, не выявлена функциональная активация мозга, связанная со слуховой стимуляцией. Изменено с разрешения Heinke et al . [15]. |
|
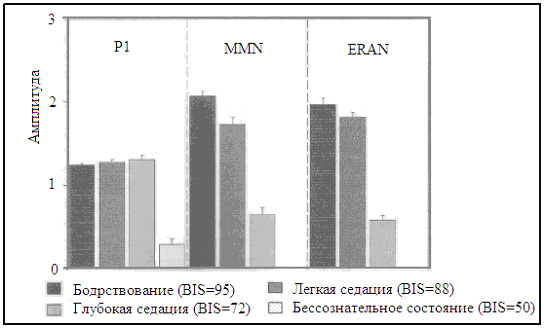
Рис 2. Эффект повышенной седации пропофолом на слуховые потенциалы. Отражает первичный процесс обработки слуховой информации ( P 1), слуховую сенсорную память (MMN) и музыкальный синтаксический процесс обработки данных (ERAN). Амплитуда (средняя величина ± среднеквадратическая ошибка) P1, MMN и ERAN во время различных уровней седации, урегулированная с целе-контролируемой инфузией пропофола: бодрствование (концентрация пропофола 0,0 мкг/мл, средний биспектральный индекс (BIS = 95), легкая седация (концентрация пропофола 0,5 мкг/мл, средний BIS = 89), глубокая седация (концентрация пропофола 1,5 мкг/мл, средний BIS = 72) и бессознательное состояние (концентрация пропофола 2,5-3,0 мкг/мл, средний BIS = 50). Амплитуда P 1 не изменялась при седации и заметно снижалась, но определялась, при бессознательном состоянии. И наоборот, амплитуда MMN и ERAN постепенно снижалась при повышении седации и исчезала при бессознательном состоянии. Это показывает характерные эффекты седации пропофолом на слуховую сенсорную память и музыкальный синтаксический процесс обработки данных при сравнении с первичным процессом звукового входа информации. Изменено с разрешения Heinke et al. [36] (смотри ссылки для получения дальнейших деталей). |
Низкие дозы препаратов, однако, как предполагается, вызывают амнезию либо посредством относительно неспецифической депрессии нейронной активности преимущественно в коре [28] или специфическими успокоительными эффектами на гипокамп [29], островковую долю большого мозга [22, 30], мозжечковую миндалину [31] и предлобную кору [30]. Эти действия анестетиков, как оказалось, поражают память путем нарушения кодирования новой информации в память (неспецифический эффект препарата вследствие седации) и путем нарушенного сохранения кодированного материла в долговременную память. Последний эффект, как, оказалось, является независимым от седации и вероятно отражает специфическое амнестическое действие анестетиков [32].
Хотя эти данные отчасти объясняют бессознательное состояние и амнезию, они не обеспечивают никакой информацией о нейронной активности, связанной с сенсорной стимуляцией во время анестезии. Исследования на животных предполагают, что спровоцированная активность коры может быть выявлена даже во время глубокой анестезии [33]. У человека, нейронная активность уже отмечалась с помощью функционального нейроизображения, вызванного другими стимуляторами [15, 30, 34], зрительным [13] или вредными стимулами [35] при поверхностной и адекватной стадиях анестезии (таблица 1). Например, мы наблюдали функциональную активность в обеих височных долях вызванную слуховым процессом обработки данных при эффективной местной концентрации пропофола выше 1,51 мкг/мл (рис. 1). Эта активация исчезала при концентрации, превышающей 3,35 мкг/мл. Подобным образом, севофлюран снижал слуховую спровоцированную функциональную активацию по доза-зависимому манеру. При сравнении с бодрствованием, остаточная активация была отмечена с двух сторон в верхней височной извилине, таламусе, стриатуме и левой лобной коре при 1% севофлюране, в то время как эта активность полностью подавлялась при 2% севофлюране [34]. В настоящее время, показано, что седативные дозы пропофода и тиопентала не изменяют повышения CBF , вызванного слуховыми стимулами, несмотря на 15% снижение общего CBF (gCBF) [41]. Даже при невосприимчивости (средний BIS = 66), реакция регионального CBF ( rCBF ) в левой височной доле была отмечена (хотя явно сниженная). В целом, эти данные предполагают, что слуховая стимуляция все еще вызывает активность коры, хотя и сниженную, во время поверхностных стадий анестезии.
Суммарно: анестезирующее действие на активность мозга в покое, спровоцированная активность мозга и когнитивные функции в зависимости от глубины анестезии. Глубина анестезии показана по BIS , эффекту местной концентрации пропофола и минимальной альвеолярной концентрации ( MAC - это минимальная альвеолярная концентрация ингаляционных анестетиков при давлении в одну атмосферу, необходимая для предотвращения движения в ответ на хирургический разрез кожи у 50% пациентов). gCBF – общий церебральный кровоток; gCMR glu – общая церебральная скорость метаболизма глюкозы; aERP – слуховой спровоцированный потенциал; MMN - неподходящая отрицательность; ERAN – ранняя правая передняя отрицательность .
Подобно слуховым стимулам, соматосенсорные стимулы могут также вызывать активность коры во время невосприимчивости, но это вероятно зависит от использованных стимулов. Вибротактильные стимулы не активируют кору и вызывают только активность таламуса при концентрации пропофола 1,5 мкг/мл [39]. И наоборот, вредные (жар) стимулы повышают CBF в соматосенсорной и средне-островковой коре даже при концентрации пропофола 3,5 мкг/мл (т.е., во время бессознательного состояния) [35]. Интересно, что передняя поясная кора – область, включающаяся в болевое восприятие [42], активируется жарой при более низких концентрациях пропофола. Таким образом, островковая доля большого мозга может быть активирована даже во время бессознательного состояния (хотя не вызывает болевого восприятия, а это скорее автономные реакции), в то время как другие структуры, отвечающие за болевое восприятие, оказались подавленными при концентрациях пропофола, вызывающих бессознательное состояние [35].
Эффекты кетамина на CBF [17] и церебральный метаболизм глюкозы [17, 18, 43] при активности мозга в покое ясно характеризуется для других анестетиках. Субанестезирующие дозы кетамина вызывают общее повышение rCBF , наиболее глубокие изменения в структурах головного мозга, связанных с процессом обработки боли [17]. Под вредной стимуляцией, однако, субанестезирующие дозы кетамина снижают болевые и стимулы, вызывающие активность мозга, с наибольшим снижением, наблюдаемым в таламусе и островковой доле большого мозга [44]. Помимо этих эффектов обезболивания, кетамин, как оказалось, в низких дозах влияет на активность головного мозга, связанную с «рабочей» памятью, в областях мозга, включающих лобную и теменную области коры и скорлупу [45], а также на активность, связанную с кодированием и восстановлением случайной информации в лобной и в гиппокампальной областях [46].