- •Общие вопросы
- •Цитофлавин при тотальной внутривенной анестезии
- •Ларингеальный масочный воздуховод является эффективным (и возможно безопасным) у отобранных здоровых беременных при плановом кесаревом сечении: проспективное исследование 1067 случаев
- •Результаты
- •Обсуждение
- •Влияние дроперидола на интервал qt
- •Предупреждение «в черной рамке»
- •Дроперидол
- •Удлиненный интервал qt, TdP и lqts
- •Влияние дроперидола на интервал qt
- •Практические рекомендации по использованию bis-монитора во время анестезии
- •Общий вид монитора.
- •Собственный опыт использования монитора глубины наркоза а – 2000x (Aspect Medical Systems, сша).
- •Причины, вызвавшие необходимость создания нового Организующего Приказа по анестезиолого-реанимационной службе рф.
- •Необходимые требования к новому Приказу.
- •2. Определение рамок компетенции (права и обязанности).
- •3. Организационно-штатная структура.
- •5. Желательные требования.
- •Материалы и методы Экспериментальная модель
- •Клинические исследования
- •Статистический анализ.
- •Результаты Жёсткая модель трахеи
- •Изучение трахеи свиньи
- •Исследование пациентов под наркозом
- •Критические пациенты с трахеостомическими трубками
- •Обсуждение
- •Приложение
- •Интубационная трубка lvlp
- •Материал и методы
- •Результаты
- •Обсуждение
- •Многокамерная фармакокинетическая модель как средство оптимизации режимов введения препаратов для внутривенной анестезии
- •Многокамерная фармакокинетическая модель как средство оптимизации режимов введения препаратов для внутривенной анестезии Введение
- •Объяснение контекстно-зависимого периода полувыведения
- •Анализ динамики концентрации фентанила при введении его согласно традиционным схемам
- •Цель проводимой работы
- •Разработка метода дозированного введения фентанила
- •Методика анестезии
- •Заключение
- •Профилактика гипотонии во время индукции анестезии диприваном у тяжелообожженных
- •Тотальная внутривенная анестезия на основе дипривана при многократных травматичных перевязках у больных с термическими поражениями
- •Терминология
- •Механизм интерплевральной аналгезии
- •Методика выполнения интерплевральной блокады
- •Клиническое применение интерплевральной аналгезии
- •Осложнения
- •Противопоказания
- •Заключение
- •Эффект обезболивания на выраженность операционного стресса
- •Психологическая подготовка
- •Фармакологическая подготовка
- •Седативные препараты, гипнотики и "большие" транквилизаторы
- •Опиоиды - наркотические аналгетики
- •Антихолинергические средства
- •Средства, влияющие на моторику желудка
- •Премедикация в амбулаторных условиях
- •Связывание с белками плазмы крови препаратов, наиболее часто применяемых в анестезиологии
- •Связывание с белками плазмы крови препаратов, наиболее часто применяемых в анестезиологии
- •Нормальная терморегуляция.
- •Влияние анестезии на нормальную терморегуляцию.
- •Тепловой балланс в операционной.
- •Физиологические и патофизиологические следствия гипотермии.
- •Больные повышенной группы риска по возникновению интраоперационной гипотермии.
- •Профилактика интраоперационной гипотермии.
- •Резюме.
- •Врожденные пороки сердца у взрослых: аспекты анестезии и интенсивной терапии послеоперационного периода
- •Альфа- 2 адреномиметики и анестезия
- •Факторы риска лёгочной аспирации, связанной с наркозом
- •Новые правила предоперационной подготовки натощак
- •Спорные вопросы темы будущих исследований
- •Введение
- •Гамк и глютамат как факторы раннего развития
- •Роль гамк и глютамата в нейронной дифференцировке и в формировании связей
- •Влияние анестетиков на развитие цнс
- •Кетамин
- •Пропофол
- •Мидазолам
- •Комбинированное использование анестетиков
- •Экстраполирование лабораторных результатов в клиническую практику
- •Самоконтроль
- •Ключевые моменты
- •Введение
- •Дыхательная система
- •Дыхательные пути
- •Вентиляция
- •Сердечно-сосудистая система
- •Жкт, эндокринная и другие системы
- •Лекарственные препараты и ожирение
- •Местное обезболивание
- •Хирургические и механические моменты
- •Ответы на вопросы самоконтроля
- •1. Введение
- •2. Материал и методы
- •2.1. Обследованные пациенты
- •2.2. Инструменты
- •2.2.1. Визуальная аналоговая шкала (ваш)
- •2.2.2. Шкала преодоления стресса Jalowiec (шпс)
- •2.3. Процедура
- •2.4. Анализ данных
- •3. Результаты
- •4. Обсуждение
- •История вопроса
- •Анализ опубликованных сообщений
- •Физиологический анализ
- •Клинические последствия и улучшение ведения больных
- •Информация в аннотации к препарату
- •Внутривенная анальгезия, контролируемая пациентом (вв акп)
- •Эпидуральная анальгезия, контролируемая пациентом (эакп)
- •Регионарная анестезия, контролируемая пациентом (ракп)
- •Интраназальная анальгезия, контролируемая пациентом (инакп)
- •Ионтофоретические трансдермальные системы для фентанила (итс)
- •Другие варианты акп
- •Заключение
- •Введение
- •Активность головного мозга во время анестезии, измеренная с помощью функционального нейроизображения
- •Изменения церебрального кровотока , церебрального метаболизма и оксигенации крови уровень-зависимым контрастом
- •Изменения функциональной комплексности во время анестезии
- •Активность мозга во время анестезии, оцененная электрофизиологическими методами
- •Активность мозга во время анестезии, оцененная по поведенческим тестам
- •Введение
- •Результаты
- •Заключение
- •Мониторинг температуры
- •Нормальная терморегуляция
- •Общепринятая модель терморегуляции
- •Номенклатура полиморфизмов
- •Фармакология и полиморфизм
- •Клинически значимые полиморфизмы
- •Заключение
- •Введение
- •Физиологические основы снабжения кислородом
- •Каковы способы оптимизации снабжения кислородом?
- •Конфликт интересов
История вопроса
Более 10 лет назад появилось небольшое число публикаций о «необъяснимых» и «неожиданных» случаях смерти у пациентов педиатрических отделений интенсивной терапии, которым проводилась седация пропофолом [1, 2]. Эти сообщения главным образом упоминали детей в возрасте младше 4 лет с инфекциями верхних дыхательных путей, получавших высокие и часто дополнительные дозы пропофола. У детей развивался «синдром», характеризующийся несколькими или всеми признаками, представленными в таблице 1.
Таблица 1. Признаки неблагоприятных эффектов в сообщениях.
Метаболический ацидоз |
Рефрактерная сердечная недостаточность |
Прогрессирующая и рефрактерная брадикардия |
Лихорадка |
Липемия |
Признаки мышечного повреждения: повышение креатин фосфокиназы (КФК), миоглобулинемия и/или миоглобинурия |
В 1992 году Управление по контролю за продуктами и лекарствами США ( FDA ) провело обзор этих сообщений и сделало вывод, что у детей пропофол имеет «не-идентифицируемую связь с неблагоприятными эффектами на сердце», но необходимо проведение дальнейших исследований [3], так как ограниченная информация в сообщениях по этим случаям не дает четкого понимания причинной связи. В 1994 году производитель добавил предупреждение в аннотацию к препарату DiprivanTM , которая заключалась в следующем:
«...несмотря на то, что причинное взаимоотношение не было установлено, серьезные неблагоприятные последствия (включая смертельные исходы) отмечались в эпизодических сообщениях нелицензированного ( ICU ) применения; эти случаи встречались более часто у детей с инфекциями дыхательных путей, получавшими дозы препарата, превышающие дозы, рекомендуемые для взрослых».
В 1998 году Bray провел анализ 18 случаев с несовместимым сочетанием клинических признаков, которые он рассматривал как «синдром». Он предложил название и выдвинул предположение, что мышечное повреждение следует считать критерием диагностики [4].
Позднее, Hatch предложил исследование пропофола для педиатрической седации в ICU , но сделал отступление, что «дети с текущим сепсисом или исходно с проблемами дыхания по возможности должны быть исключены» из таких исследований. Кроме того «скорости инфузии должны соответствовать скорости, используемой у взрослых, даже если другие препараты будут использованы для обеспечения адекватной седации» [5].
Серьезные неблагоприятные исходы были сообщены у больных с крупом и эпиглотитом; несмотря на то, что обсуждение применения DiprivanTM для седации у этих больных все еще продолжалось, был разработан протокол для исследования 0859 IL -0068. Дети с указанными патологическими состояниями были исключены из клинического исследования как «мера предосторожности». Таким образом, нет информации относительно безопасности DiprivanTM для седации у этих детей в ICU , а производитель впоследствии считал противопоказанием применение пропофола у больных в детских ICU , что было отмечено в аннотации к препарату:
« DiprivanTM противопоказан для проведения седации у детей всех возрастных групп с крупом и эпиглотитом, получающих интенсивную терапию».
В 2001 году Cremer с коллегами [6] опубликовали ретроспективное исследование семи взрослых пациентов с травмами головы со смертельными исходами после появления клинических признаков схожих с признаками, описанными Bray . Авторы представили критерии диагностики «синдрома инфузии пропофола взрослых» (показаны в таблице 2). С тех пор было опубликовано небольшое число сообщений, подобных сообщению Cremer с коллегами, о больных с тяжелыми травмами [7, 8]. Производитель регистрировал дополнительные сообщения подобных случаев в базе данных фармакологического надзора как часть продолжающегося фармакологического надзора за препаратом.
Таблица 2. Критерии, предложенные для диагностики «синдрома инфузии пропофола взрослых».
Прогрессирующая миокардиальная недостаточность с нарушениями ритма (сердечный выброс зависит от тахикардии) |
Два из следующих признака: метаболический ацидоз, гиперкалиемия и признаки разрушения мышечных клеток, не ограниченных только фазой реанимации |
Отсутствие известных причин миокардиальной недостаточности |
Нет доказательств в пользу сепсиса, полиорганной недостаточности, нет известных причин гиперкалиемии, метаболического ацидоза или рабдомиолиза |
Возраст 18-55 лет |
Пациентов, у которых был описан этот синдром, грубо можно разделить на три группы: ( i ) пациенты с тяжелыми множественными ранениями, ( ii ) пациенты, получающие лечение по поводу эпилептического статуса или получающие детоксикацию от опиатов, или ( iii ) критические больные с сепсисом.
Резюме – Сообщения представили историю случаев неблагоприятных последствий, произошедших у тяжелых больных на фоне седации пропофолом, часто в «высоких» дозах. В большинстве сообщений у детей сепсис (обычно респираторного генеза) был показанием для проведения терапии в условиях ICU . У взрослых и некоторых детей повышенное внутричерепное давление рефрактерное к лечению, или другие состояния (как описано выше), послужили причиной для проведения интенсивной терапии в ICU . Было описано ухудшение до метаболического ацидоза и органной недостаточности.
Исследования седации в детских ICU
В 2002 году Cornfield с коллегами сообщили об исследовании пропофола у 109 детей. Удовлетворительная седация была получена при применении доз до 50 мкг/кг/мин (3 мг/кг/час) плюс болюсные дозы 1 мг/кг не чаще чем через 1 час по потребности. Здесь не было выявлено метаболических или гемодинамических нарушений [9].
В ретроспективном исследовании Pepperman и Macrae у 106 больных, получавших пропофол, не было выявлено необъяснимого метаболического ацидоза и не было обнаружено различий в смертности. Авторы сделали вывод, что «пропофол сопоставим с другими седативными препаратами в положительном отношении». Интересно, что исследователи отметили, что 78% из всех наблюдаемых случаев метаболического ацидоза были диагностированы у детей младше 3 лет [10].
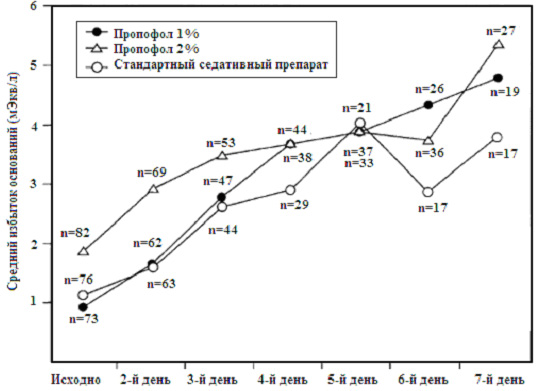
В 1999 году производитель выполнил исследование DiprivanTM при педиатрической седации в ICU у более чем 300 больных в США (исследование 08591 L -0068) в целях определения - вызывала ли ЭДТК ( EDTA ), включенная как микробиологический ингибитор роста, повышенное выделение цинка как у взрослых. Вторичные конечные результаты включали метаболический мониторинг, оценку безопасности и эффективности. Несмотря на то, что исследование не было разработано для определения различий в смертности, неожиданно была показана более высокая частота смертей в группе DiprivanTM в период назначения препарата и до 30 дней после прекращения введения препарата при сравнении со «стандартным седативным препаратом» (11% против 4%). Эта частота не была статистически значимой, а более детальное изучение данных показало, что признаки, описанные Cremer или Bray , не были выявлены у пациентов перед наступлением смерти. В течение первых 7 дней терапии в ICU была отмечена тенденция к повышению избытка оснований ( BE ) (рисунок 1). Если пропофол повреждал дыхательную цепь ферментов, то можно ожидать снижение BE и отклонение от группы «стандартного седативного препарата». Таким образом, не была подтверждена связь с развитием ацидоза зависимым от времени.
|
Рисунок 1. Исследование Astra Zeneca 0859 IL -0068: средний избыток оснований артериальной крови (мЭкв/л) по дням исследования. |
Распространенное лицензированное разрешение
В небольшом числе авторитетных источников было дано одобрение для широкого применения препарата при проведении седации в педиатрии в ICU , но FDA , которое рассматривало результаты исследования как возможный сигнал безопасности, инструктировало производителя в письме «Уважаемый врач» с указанием, что DiprivanTM не следует применять для седации в педиатрии в ICU в США. Позднее, распорядительные органы власти не одобрили, и даже аннулировали одобрение этого показания к применению препарата. «Предупреждение» изменилось на «противопоказание» в отношении седации в педиатрии в ICU . В тех педиатрических ICU , где все еще есть разрешение к применению, продолжающееся использование препарата не привело к дополнительным сообщениям о «синдроме инфузии пропофола».
Обзор безопасности
В 1999 году производитель завершил сравнительный обзор безопасности всех неблагоприятных эффектов у детей в ICU , получавших пропофол, и сообщил о базе данных, которая содержала все сообщения о неблагоприятных последствиях, связанных с назначением препарата или, возможно, связанных с применением пропофола. В базе данных проведен поиск отдельных случаев, описанных в сообщениях и синонимов этих случаев, все найденные сообщения были пересмотрены. Из нескольких сообщений, которые соответствовали критериям диагностики синдрома по данным Bray или Cremer , в большинстве сообщений имелись также значимые независимые факторы риска наблюдаемого ухудшения заболевания и развития отдельных симптомов. Шесть больных, у которых сообщалось о мышечном повреждении, имели факторы риска развития мышечного повреждения, включая рефрактерную эпилепсию, температуру 41,5° C (возможно вследствие злокачественной гипертермии), применение преднизолона, а у трех больных было отмечено сочетание сепсиса, гипоперфузии и гипоксемии. Случаи, имеющие место у шести детей, соответствовали, но оставались без удовлетворительного объяснения. В четырех из этих случаев, производитель получил только минимум информации, несмотря на дополнительный запрос. Так как все эти случаи произошли у больных младше 3 лет с тяжелыми вирусными инфекциями дыхательных путей, в аннотацию DiprivanTM было добавлено следующее превентивное противопоказание:
« DiprivanTM противопоказан для проведения седации у детей младше 3 лет с серьезными вирусными инфекциями дыхательных путей, получающих интенсивную терапию».