
- •1.01. Кинематика поступательного и вращательного движения формулы
- •Примеры решения задач
- •1.02. Динамика поступательного движения формулы
- •Примеры решения задач
- •1.03. Закон сохранения импульса тела. Столкновения частиц формулы
- •Примеры решения задач
- •1.04. Закон сохранения энергии формулы
- •Примеры решения задач
- •1.05. Динамика вращательного движения формулы
- •Примеры решения задач
- •1.06. Гармонические колебания формулы
- •Дополнительно. Волны в упругой среде. Акустика
- •Примеры решения задач
- •1.07. Уравнение состояния идеального газа. Молекулярно-кинетическая теория формулы
- •Примеры решения задач
- •1.08. Первое начало термодинамики формулы
- •Примеры решения задач
- •Список используемой литературы
- •Введение
- •Рекомендации по решению задач
- •Требования к оформлению
- •Критерии и шкала оценивания устной защиты решения задач
1.08. Первое начало термодинамики формулы
Связь между молярной (C) и удельной (c) теплоемкостями газа:
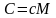 ,
,
здесь M – молярная масса;
Молярные теплоемкости при постоянном объеме и постоянном давлении, соответственно:
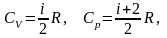
здесь i – число степеней свободы, R – универсальная газовая постоянная;
Удельные теплоемкости при постоянном объеме и постоянном давлении, соответственно:
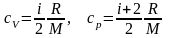 ;
;
Уравнение Майера:
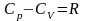 ;
;
Показатель адиабаты:
 ;
;
Внутренняя энергия идеального газа, изменение энергии идеального газа, соответственно:
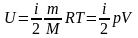 ,
,
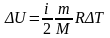 ,
,
здесь, m – масса газа, T – термодинамическая температура, p – давление газа, V – объём газа;
Работа газа при изобарном процессе (p = const):
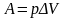 ;
;
Работа газа при изотермическом процессе (T = const):
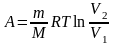 ;
;
Работа газа при адиабатном процессе:
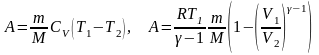 ;
;
здесь V1, V2 – начальный и конечный объемы газа, соответственно, T1, T2 – начальная и конечная температуры газа, соответственно;
Уравнение Пуассона (уравнение газового состояния при адиабатном процессе):
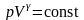 ;
;
Связь между начальным и конечным значениями параметров состояний газа при адиабатном процесс:
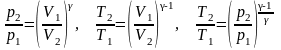 ;
;
Формула Больцмана:
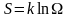 ,
,
здесь S – энтропия, Ω – статистический вес;
Энтропия и изменение энтропии, соответственно:
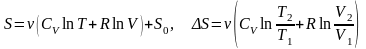 ,
,
здесь S0 – начальное значение энтропии, ν – количество вещества;
Первое начало термодинамики:
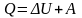 ,
,
здесь ΔU – изменение внутренней энергии идеального газа, Q – количество теплоты, A – работа газа;
1) Первое начало термодинамики для изотермического процесса:
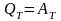 ,
ΔU=
0;
,
ΔU=
0;
2) Первое начало термодинамики для изобарического процесса:
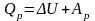 ,
где
,
где
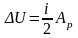 ;
;
 ;
;
3) Первое начало термодинамики для изохорического процесса:
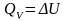 ,
A
= 0;
,
A
= 0;
4) Первое начало термодинамики для адиабатического процесса:
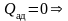
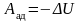 ;
;
Количество теплоты:
1) Теплота сгорания топлива:
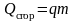 ;
;
2) Теплота нагревания:
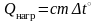 ;
;
3) Теплота плавления:
 ;
;
4) Теплота парообразования:
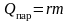 ,
,
здесь q – удельная теплота сгорания топлива, c – удельная теплоёмкость вещества, λ – удельная теплота плавления, r – удельная теплота парообразования;
Работа тепловой машины:
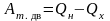 ,
,
здесь Aт.дв. – работа тепловой машины, Qн – количество теплоты, полученной тепловой машиной от нагревателя, Qх – количество теплоты, переданного от тепловой машины холодильнику;
Коэффициент полезного действия реальной тепловой машины:
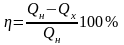 ;
;
Коэффициент полезного действия идеальной тепловой машины:
 ,
,
здесь Tн – температура нагревателя, Tх – температура холодильника.
Добавить смачивание и поверхностное натяжение
Примеры решения задач
1. Вычислите работу, совершаемую одним молем идеального газа при изобарном нагревании на 1 К.
Дано: p1 = p2 = p; ν = 1 моль; ΔT = 1 К; |
Решение: При изобарном нагревании идеального газа работа A, совершаемая газом, равна A = pΔV. Так как по условию задачи не даны значения давления р газа и изменения его объема ΔV, выразим эти величины через |
A – ? |
известное изменение ΔT температуры газа. Для этого воспользуемся уравнением состояния идеального газа
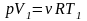 ,
,
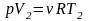 .
.
Из этих уравнений получаем
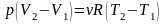 ,
или pΔV
= νRΔT.
,
или pΔV
= νRΔT.
Отсюда для работы газа при изобарном нагревании будем иметь
A = νRΔT;
А = 1 · 8,31 · 1 = 8,31 Дж.
Таким образом, молярная газовая постоянная R равна работе, совершаемой одним молем идеального газа при изобарном нагревании 1 К.
Ответ: A = 8,31 Дж.
2. Определите максимальный КПД тепловой машины, если температура нагревателя равна 227 ºС, а температура холодильника равна 27 ºС.
Дано: T1 = 500 К; T2 = 300 К; |
Решение: Максимальный КПД тепловой машины определяется выражением
|
ηmax – ? |
 .
.
Ответ: ηmax = 0,4.
3. Карбюраторный двигатель внутреннего сгорания работает по циклу, состоящему из четырех последовательно происходящих процессов: адиабатного сжатия из состояния А в состояние В, изохорного перехода из состояния В в состояние С в результате нагревания воздуха при сжигании горючей смеси, адиабатного расширения из состояния С в состояние D и изохорного перехода из состояния D в исходное состояние А (см. рис. 117). Вычислите КПД двигателя для случая, если бы воздух был идеальным одноатомным газом при значениях температуры в состояниях А, В, С и D соответственно ТА = 300 К, ТB = 524 К, ТC = 786 К и ТD = 450 К.

Решение:
Значение КПД теплового двигателя определяется уравнением
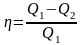
где Q1 – количество теплоты, переданное за цикл рабочему телу от нагревателя; Q2 – количество теплоты, полученное за цикл холодильником от рабочего тела.
Во время осуществления адиабатических процессов расширения и сжатия нет теплообмена рабочего тела ни с холодильником, ни с нагревателем. Следовательно, весь процесс теплоотдачи количества теплоты Q1 от нагревателя осуществляется при переходе газа из состояния В в состояние С, а процесс передачи количества теплоты Q2 холодильнику – при переходе газа из состояния D в состояние А. При изохорическом переходе газа из состояния В в состояние С работа внешних сил равна нулю: А = 0, так как поршень неподвижен. Из первого закона термодинамики для этого процесса следует
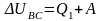 ,
A
= 0,
,
A
= 0,
 .
.
Мы получили, что количество теплоты, полученное газом от нагревателя за весь цикл, равно изменению внутренней энергии газа при переходе из состояния В в состояние С:
 .
.
Аналогично количество теплоты Q2, переданное холодильнику при изохорическом переходе газа из состояния D в состояние А, равно
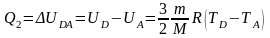 .
.
Подставляя полученные выражения для Q1 и Q2 в уравнение для определения КПД, получаем
 .
.
Найдем численное значение КПД:
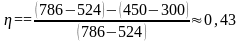 .
.
Ответ: η = 0,43.
4. В теплоизолированном сосуде находятся вода и лед при температуре 0 ºС. Массы воды и льда соответственно равны 0,5 кг и 60 г. В воду впускается водяной пар массой 10 г при температуре 100 ºС. Какой станет температура воды в сосуде после установления теплового равновесия? Теплоемкость сосуда в расчетах не учитывать.
Дано: m1 = 0,5 кг; m2 = 0,06 кг; m3 = 0,01 кг; T1 = 273 К; T2 = 373 К; r = 2,26·106 Дж/кг; λ = 3,3·105 Дж/кг; c = 4,23·103 Дж/(кг·К); |
Решение: Проверим сначала, достаточно ли выделяющегося при конденсации пара количества теплоты Q3 для плавления льда. При конденсации пара выделяется количество теплоты Q3:
Для плавления льда требуется количество теплоты Q2:
|
T3 – ? |
Сравнение количеств теплоты Q3 и Q2 показывает, что Q3 > Q2. Это означает, что лёд расплавится полностью, но значения количеств теплоты отличаются незначительно, следовательно, пар конденсируется полностью. Поэтому уравнение теплового баланса имеет вид:
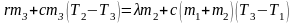 .
.
Теплота выделяется при конденсации пара массой m3 и остывании сконденсировавшейся воды от температуры Т2 до некоторого значения T3, а поглощается при плавлении льда массой m2 и нагревании воды массой (m1 + m2) от температуры Т1 до равновесного значения T3. Обозначив T3 – T1 = ΔТ, для разности T2 – T3 получим
T2 – T3 = T2 – T1 – ΔТ = 100 – ΔТ.
Уравнение теплового баланса приобретает вид
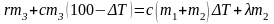 ;
;
 .
.
Откуда
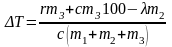 ;
;
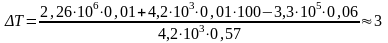 К.
К.
Тогда T2 = 273 К + 3 К = 276 К.
Ответ: T2 = 276 К.

 ;
;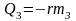 .
.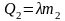 .
.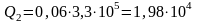 Дж.
Дж.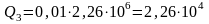 Дж.
Дж.