- •Ферменты
- •Методы разделения смесей белков. Значение хроматографического иэлектрофоретическогоисследованиябелковплазмыкрови.Белковыефракцииплазмыкрови,причиныих изменения.
- •Электрофорезбелков
- •Значение
- •5.Ферменты:строение,(рольвитаминовиминералов).Отличие
- •Составфермента
- •Механизмдействияфермента.
- •Теорияфермент-субстратногокомплекса.
- •Основныевидырегуляцииактивностиферментовмедленныйтипрегуляции
- •Быстрыйтипрегуляции
- •Аллостерия
- •Ковалентная,химическаямодификация
- •Ингибированиеиактивацияферментов,механизмы.Примерыингибиторовиактиваторов.Ограниченныйпротеолиз.
- •Какие ферменты необходимо определить в крови для контроля засостояниемздоровьялиц,контактирующихсокислителями,
- •Значение определения активности аминотрансфераз, принципыопределения.
- •Другиеиндикаторныеферментыплазмы:
- •Значениеопределенияизоферментногоспектравдиагностике
- •9.Использованиеферментативныхтестоввдиагностике.Принципидиагностическое значение определения активности холинэстераз.
- •Необратимого действия). Ингибиторы, как лекарственныепрепараты.
- •Дляизученияактивностихолинэстеразыиспользуютразличныеспособы:
- •Клинико-диагностическоезначение
- •Ингибиторыхолинэстераз.
- •Ингибиторыкаклекарственныесредства.
- •Значение определения активности дегидрогеназ в крови. Примерыспецифических ингибиторов дегидрогеназ и механизмы их действия.Принципметода определенияактивностидегидрогеназ.
- •Такжеиспользуетсядля:
- •ДляисследованияразличныхдегидрогеназиспользуютметодНахласавмодификациях, основанный на реакции восстановления солей тетразолия и выпаденияосадкадиформазанасинегоцветавместах активностиферментов.
- •Активность каких ферментов и белков плазмы крови следуетопределить для диагностики инфаркта миокарда? Значениеизмененияэтих показателейвдинамике.
- •Времяпослеинфаркта
- •ВитаминыгруппыВ:в1,в2,в6,рр(в3),биотин,пантотеноваякислота(в5),строение,биохимическаяфункциякаждого витамина.
- •ВитаминРр(никотиноваякислота,никотинамид,витаминB3)
- •Пантотеноваякислота(витаминB5)
- •ВитаминВ6(пиридоксин,пиридоксаль,пиридоксамин)
- •Биотин(витаминН)
- •ВитаминС,егоформы.БиохимическиефункциивитаминаС.Клиника авитаминоза.
- •Жирорастворимыевитамины,строение,биохимическиефункции.Жирорастворимыевитаминыкакантиоксиданты.
- •ВитаминыгруппыD(кальциферолы)
- •ВитаминыгруппыЕ(токоферолы)
- •Токоферолыпредставляютсобоймаслянистуюжидкость,хорошорастворимуюворганическихрастворителях.
- •ВитаминыК(нафтохиноны)
- •Примеры:
- •Вкачествепромежуточныхпереносчиковэлектроноввыступаютубихинон(коэнзимQ)ицитохромс.
- •Субстратное и окислительное фосфорилирование. Привестипримерыреакции,биологическаяроль.СинтезАтф.Рольмагниявпроцессах сучастиемАтф
- •Сахаразо-изомальтазныйкомплекс
- •Гликоамилазныйкомплекс
- •Совместноедействиевсехперечисленныхферментовзавершаетперевариваниепищевыхолиго-иполисахаридовсобразованиеммоносахаридов,основнойизкоторых
- •Формулысубстратов:
- •Мальтоза
- •18.Этапыаэробногодихотомическогоокислениеглюкозы.Характеристика и биологическая роль каждого процесса.Регуляцияаэробногодихотомическогоокисленияглюкозы.
- •Энергетическаяценностьаэробногоокисленияглюкозы:
- •19. Дихотомический анаэробный путь окисления углеводов, его этапы,биологическая роль. Написать соответствующие реакции. Механизмразвитияацидозапригипоксии.
- •Ацидозпригипоксии.
- •Путиобразованияииспользованияоксалоацетатавклетке.
- •Глюконеогенез.Напишитереакции.СвязьсгликолизомиЦтк.Биологическаяроль.Гормональнаярегуляцияпроцесса.
- •Распадгликогенадопирувата,биологическаяроль,регуляцияпроцесса.
- •Затемдальнейшеепревращениеглюкозывпируватидетвгидролизе.
- •Цикл трикарбоновых кислот, биохимические функции. Связь сорнитиновымциклом.Пластическая,энергетическаяфункцииЦтк.
- •ФункцииЦтк
- •25.Взаимосвязьуглеводногоибелковогообменов(наличиеобщихметаболитов,путиих превращения).
- •Апотомическоеокислениеглюкозы(написатьреакциидостадииобразованияпентоз).Биохимическаяфункция.Связьсантиоксидантнойидетоксицирующейсистемами.
- •Пентозофосфатныйпутьвыполняетворганизмедвеважнейшиеметаболическиефункции:
- •Какие биохимические изменения характерны для сахарного диабета?Биохимическиетесты,используемыедлядифференциальнойдиагностики инсулинзависимого и инсулиннезависимого сахарногодиабета.
- •Инсулинзависимыйсахарныйдиабет
- •Инсулинонезависимыйсахарныйдиабет
- •Диагностика:
- •Классификациялипидов.Строениеибиологическаярольфосфолипидов.Синтезфосфолипидов.Пищевыефакторы,необходимыедляполноценногосинтезафосфолипидоввклеткахорганизма.
- •Классификациялипидов
- •Состав.
- •Биороль:
- •Полиненасыщенные жирные кислоты, строение,- 6 и- 3 жирныекислоты,образованиеэйкозаноидов.Путибиотрансформацииарахидоновойкислотыи3-жирныхкислотворганизме,биологическаяроль.
- •Источники
- •Полиненасыщенныежирныекислотыобладаютвесьмаширокимифункциями:
- •Перевариваниеивсасываниелипидоввжелудочно-кишечномтракте. Роль желчных кислот. Ресинтез липидов в стенке кишечника.Транспортэндогенныхлипидов.
- •Эмульгированиежиров
- •Гормоны,активирующиеперевариваниежиров.
- •Желчныекислоты,образование,строение,рольворганизме.
- •Рольжелчи
- •Этапыокисленияжирныхкислот
- •Регуляциялипогенеза.
- •ЧелночныймеханизмпереносаАцетил-КоА.
- •Такимобразом,переносодноймолекулыацетилКоАизмитохондриив
- •Регуляциясинтеза
- •Ингибирование.
- •35.Липопротеиныплазмыкрови.Методыразделения.Классификация,строение,биологическаяроль.Апопротеины,ихроль.Обратный
- •Биосинтезтриацилглицериновифосфолипидов.
- •Перекисноеокислениелипидов,этапы.Рольактивныхформ
- •Стадииперекисногоокислениялипидов
- •Выясняется,чтоАфКпринимаютнепосредственноеучастиевформированииразнообразных физиологических ответов клеток на тот или иной молекулярный Рольактивныхформкислорода.
- •Переваривание белков в желудочно-кишечном тракте. Какимибиохимическимитестамиможнообнаружитьнарушенияперевариваниябелковвжелудочно-кишечномтракте? Перевариваниебелковвжелудке
- •Образованиеирольсолянойкислоты
- •Механизмактивациипепсина
- •Возрастныеособенностиперевариваниябелковвжелудке
- •Перевариваниебелковвкишечнике
- •Активацияпанкреатическихферментов
- •Специфичностьдействияпротеаз
- •Диагностиканарушенийпереваривания.
- •Аминокислотный фонд клетки, пути использования аминокислот вклетке.Реакцииметаболизмааминокислот,ихзначениеваминокислотномобмене.Роль витаминов.
- •Тканевойобменаминокислот
- •Метаболизмаминокислот.
- •Дезаминированиеаминокислот
- •Окислительноедезаминирование
- •Непрямоедезаминирование(трансдезаминирование)
- •Декарбоксилированиеаминокислотиихпроизводных
- •Балансаминокислотвклетке.Энергетическоеипластическое
- •Азотистыйбаланс
- •Трансаминирование
- •Дезаминированиеаминокислот
- •Окислительноедезаминирование
- •Непрямоедезаминирование(трансдезаминирование)
- •Декарбоксилированиеаминокислотиихпроизводных
- •Биосинтезмочевины.
- •ОрнитиновыйциклКребса
- •РольсвободныхАк
- •Образование других аминокислот также возможно при наличиисоответствующих α-кетокислот,
- •Гистамин
- •Физиологическиеэффекты
- •Серотонин
- •РеакциясинтезаГамк
- •Регуляциясинтезаисекреции
- •Небелковыеазотсодержащиекомпонентыкрови.Причиныихизменения.Диагностическое значение.
- •Клинико-диагностическоезначение определения креатина икреатининавкровиимоче.Характеризмененияпоказателейприразнойпатологии.
- •Взаимосвязь белкового и липидного обменов (примеры общихметаболитов,реакциипереходаотодноговидаметаболизмакдругому).
- •Днк,строение,рольвбиосинтезебелка.СистемаРнк-днк-белок. Биосинтезбелков
- •ТретичнаяструктураДнк(суперспирализацияДнк)
- •Химическиемеханизмывозникновениямутацийисистемаантимутагеннойзащиты.
- •Генныемутации.Последствиямутаций.Методывыявлениягенныхмутаций
- •Инициация
- •Элонгация
- •Терминация
- •ПосттранскрипционныепревращенияРнк.
- •Основныеэтапыбиосинтезабелкавклетке.Генетическийкод,его
- •Свойствагенетическогокода:
- •Элонгация
- •Терминация
- •Трансляция.
- •Инициация
- •Элонгация
- •Существуетдваглавныхспособапередачисигналавклетки-мишениотсигнальныхмолекулсмембранныммеханизмомдействия:
- •Аденилатциклазнаясистема.
- •Регуляциясинтезаисекреции
- •Механизмдействия.
- •Инсулин,строение,местосинтеза,строениеинсулиновогорецептора,биологическая роль инсулина(механизм действия). Микроэлементы,участвующиевметаболизмесучастиеминсулина.
- •Строение
- •Механизмдействия
- •Активацияинсрецептора
- •Микроэлементы
- •Глюкагон,строение,схемарецептора,молекулярныемеханизмы
- •Гормоныкорынадпочечников,строение,биологическаяроль,клиникагиперигипофункции.
- •Кортизол
- •Изменениесодержаниякортизолавкрови
- •Тестостерон
- •Альдостерон.
- •Функции
- •Гормоныщитовиднойжелезы:ихстроение,молекулярныемеханизмывлиянияна обменвеществ,Клиникагипо-игиперфункции.
- •Эндемическийзоб
- •Тиреотропин,лютеинизирующийгормонифолликулостимулирующийгормон
- •Кортикотропин
- •Гормонызаднейдолигипофиза
- •Гемоглобин,строение,физиологическиеипатологические
- •Гемоглоби́н — сложныйжелезосодержащийбелокживотных, обладающихкровообращением,способныйобратимосвязыватьсяскислородом,обеспечиваяегопереносвткани.
- •СтроениегемоглобинаА
- •Нормальныеформыгемоглобина
- •Патологическиеформыгемоглобина
- •Роль2,3-дифосфоглицерата
- •ИзменениерНсреды
- •Строениеисинтезгема
- •Регуляциясинтезагема
- •Лечение
- •Антиоксидантная система / аос /клетки. Ферменты аос.НизкомолекулярныеАо.Основныезвеньяантиоксидантнойсистемы.Природныеантиоксиданты(перечислитьклассы).
- •67. Как связано состояние антиоксидантной системы с углеводнымобменом?Какиебиохимическиетестыможноиспользоватьдляоценкиантиоксидантнойсистемыклетки?
- •Образованиеаммиакавнервнойткани
- •Энергетическийобменвнервнойткани
- •Гликолиз,гликогенолиз.
- •Преимущества.
- •Синтезкреатинаикреатинфосфата.
- •Компонентымежклеточногоматрикса.Строение,рольбелковколлагенаиэластина,протеогликановигликозамингликанов.
- •МежклеточныйматрикскостнойизубнойтканиНеорганическаячасть
- •Органическаячасть
- •Mежклеточныйматрикссуставногохряща
- •Mежклеточныйматрикскожнойткани
- •Коллаген.
- •Эластин
- •Минеральныекомпонентыпищи.Классификация.Биохимическаяфункция. Биоусвояемые формы. Биохимическая функция цинка,селенаихрома,меди,железа.
- •Железо.
- •Макро-имикроэлементы.Ролькальциявметаболизмеикостнойсистеме(обосноватьрольвитаминовидругихминералов).
- •Биогенныеэлементы
- •Кальций.
- •Стадии.
- •Микросомальноеокисление
- •Сульфотрансферазы
- •Глутатионтрансферазы
- •Ацетилтрансферазы,метилтрансферазы
- •Спомощьюкакихбиохимическихтестовможнооценитьфункциональноесостояниепечени?
- •Аланинаминотрансфераза(алт)
- •Аспартатаминотрансфераза(аст)
- •Щелочнаяфосфатаза(щф)
- •Гамма-глутамилтрансфераза(ггт)
- •Патологическиекомпонентымочи,ихпроисхождение.Диагностическое значение определения патологических компонентовмочи.
Трансаминирование
Трансаминирование-реакцияпереносаα-аминогруппысаминокислотынаα-кетокислоту,врезультатечегообразуютсяноваякетокислотаиноваяаминокислота.
Реакциикатализируютферментыаминотрансферазы,коферментомкоторыхслужитпиридоксальфосфат(ПФ)-производноевитаминаВ6
Вступатьвреакциитрансаминированиямогутпочтивсеаминокислоты,заисключениемлизина, треонинаипролина.
Реакцияпо типу«пинг-понг»
В таких реакциях первый продукт должен уйти из активного центра фермента до того,каквторойсубстратсможеткнемуприсоединиться.
Реакции трансаминирования играют большую роль в обмене аминокислот. Посколькуэтотпроцессобратим,ферментыаминотрансферазыфункционируюткаквпроцессахкатаболизма,так ибиосинтезааминокислот.
Дезаминированиеаминокислот
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, врезультатечегообразуетсясоответствующаяα-кетокислота(безазотистыйостаток)ивыделяетсямолекулааммиака.
Окислительноедезаминирование
 Наиболее
активно в тканях происходит дезаминирование
глутаминовой кислоты. Реакциюкатализируетфермент
глутаматдегидрогеназа, коферментом
глутаматдегидрогеназы являетсяNAD+.
Наиболее
активно в тканях происходит дезаминирование
глутаминовой кислоты. Реакциюкатализируетфермент
глутаматдегидрогеназа, коферментом
глутаматдегидрогеназы являетсяNAD+.
Непрямоедезаминирование(трансдезаминирование)
Большинствоаминокислотнеспособнодезаминироватьсяводнустадию,подобноГлу.Аминогруппытакихаминокислотврезультатетрансаминированияпереносятсянаα-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямомуокислительномудезаминированию.
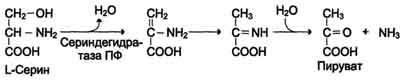
Неокислительноедезаминированиесеринакатализируетсериндегидратаза.
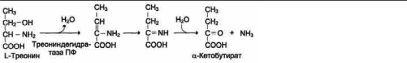
Неокислительноедезаминированиетреонинакатализируетферменттреониндегидратаза.
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затемпроисходитнеферментативнаяперестройкамолекулы,врезультатекоторойобразуетсяиминогруппа,слабосвязаннаяса-углеродныматомом.Далееврезультатенеферментативногогидролизаотщепляетсямолекулааммиакаиобразуетсяпируват.
Декарбоксилированиеаминокислотиихпроизводных
Некоторыеаминокислотыиихпроизводныемогутподвергатьсядекарбоксилированию-отщеплениюос-карбоксильной группы.
Реакции декарбоксилирования необратимы и катализируются ферментами
 Продуктами
реакции являются СО2и амины,
которые оказывают выраженное
биологическоедействиенаорганизм(биогенныеамины):
Продуктами
реакции являются СО2и амины,
которые оказывают выраженное
биологическоедействиенаорганизм(биогенныеамины):
декарбоксилазами.
Гниениебелковвкишечнике(схемараспадааминокислот)иобезвреживаниепродуктовгниения.
Многочисленные превращения аминокислот, вызванные деятельностью микроорганизмовкишечника, получили общее название «гниение белков в кишечнике». Так, в процессераспадасеросодержащихаминокислот(цистин,цистеин,метионин)вкишечникеобразуютсясероводород H2S и метил-меркаптанCH3SH.
Диаминокислоты–орнитинилизин–подвергаютсяпроцессудекарбоксилированиясобразованиемтоксичных аминов–путресцинаикадаверина.
Из ароматических аминокислот: фенилаланин, тирозин и триптофан – при аналогичномбактериальномдекарбоксилированииобразуютсясоответствующиеамины:фенилэтиламин,параоксифенилэтиламини индолилэтиламин(триптамин).
Крометого,микробныеферментыкишечникавызываютпостепенноеразрушениебоковыхцепей циклических аминокислот, в частности тирозина и триптофана, с образованиемядовитыхпродуктовобмена–соответственнокрезолаифенола,скатолаииндола.
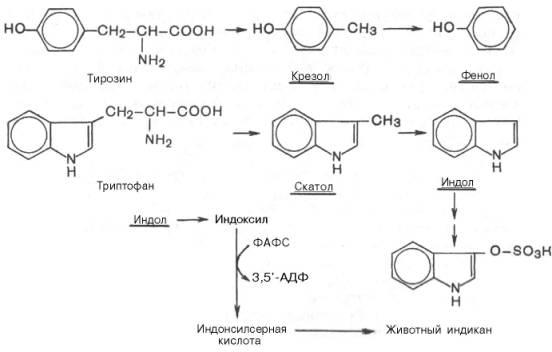
Послевсасыванияэтипродуктычерезворотнуювенупопадаютвпечень,гдеподвергаютсяобезвреживаниюпутемхимическогосвязыванияссернойилиглюкуроновойкислотой
с образованием нетоксичных, так называемых парных, кислот (например,фенолсернаякислотаилиска-токсилсернаякислота).Последниевыделяютсясмочой.Механизмобезвреживанияэтихпродуктовизучендетально.
Впеченисодержатсяспецифическиеферменты–арилсульфотрансферазаиУДФ-глюкоронилтран-сфераза,катализирующиесоответственнопереносостаткасернойкислоты из ее связанной формы – 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) иостатка глюкуроновой кислоты также из ее связанной формы – уридил-дифосфоглюкуроновойкислоты(УДФГК)налюбойизуказанныхпродуктов.
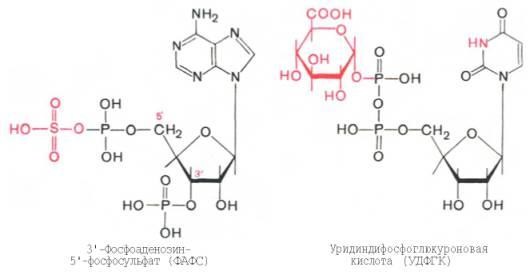
Индол(какискатол)предварительноподвергаетсяокислениювиндоксил(соответственно
скатоксил), который взаимодействует непосредственно в ферментативной реакции сФАФСилисУДФГК.Так,индолсвязываетсяввидеэфиросернойкислоты.Калиеваясоль этой кислоты получила название животного индикана, который выводится смочой.
Поколичествуиндиканавмочечеловекаможносудитьнетолькооскоростипроцессагниениябелковвкишечнике,ноиофункциональномсостояниипечени.
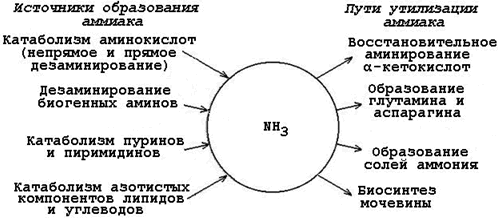
Источникиаммиакаворганизме(написатьреакции).Рольсвободныхаминокислот вобезвреживанииаммиака.
Катаболизм аминокислот в тканях происходит постоянно со скоростью∼100г/сут.Приэтомврезультатедезаминированияаминокислотосвобождаетсябольшоеколичествоаммиака.
476
 СхемаA
СхемаA
 СхемаБ
СхемаБ
СхемаВ
Значительноменьшиеколичестваегообразуютсяпридезаминированиибиогенныхаминов и нуклеотидов. Основные источники аммиака в клетках представлены втабл.9-3.
Часть аммиака образуется в кишечникев результате действия бактерий напищевыебелки(гниениебелковвкишечнике)ипоступаетвкровьворотнойвены.В печени задерживается большое количество аммиака, что поддерживаетнизкое содержание его в крови.В крови и цитозоле клеток при физиологическихзначенияхрН аммиакпереходитвионаммония-NH4+
![]()
Аммиак-токсичноесоединение.Даженебольшоеповышениеегоконцентрацииоказываетнеблагоприятноедействиенаорганизм,ипреждевсегонаЦНС.К симптомам гипераммониемии относят тремор, нечленораздельную речь,тошноту,рвоту,головокружение,судорожныеприпадки,потерюсознания.Втяжѐлыхслучаяхразвиваетсякомаслетальным исходом.
Механизмтоксическогодействияаммиаканамозгиорганизмвцелом,очевидно,связансдействиемегонанесколькофункциональныхсистем.
Аммиак легко проникает через мембраны в клетки и в митохондрияхсдвигаетреакцию,катализируемуюглутаматдегидрогеназой,всторонуобразованияглугамата:
α-Кетоглутарат+NADH+Н++NH3→Глутамат+NAD+.
Уменьшениеконцентрацииα-кетоглутаратавызывает:
угнетениеобмена аминокислот (реакции транса-минирования) и,следовательно,синтезаизнихнейромедиаторов(ацетилхолина,дофаминаидр.);
гипоэнергетическоесостояниеврезультатесниженияскоростиЦТК.
477
Таблица9-3.Основныеисточникиаммиака
Источник Процесс Ферменты Локализацияпроцесса
Аминокислоты
Непрямоедезаминирование(основнойпуть
дезаминированияаминокислот)
Окислительное
дезаминированиеглутамата
Неокислительное
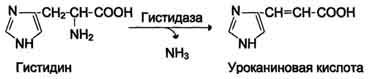
дезаминированиеГис,Сер,Тре
Окислительноедезаминированиеаминокислот
(малозначимыйпутьдезаминирования)
Аминотрансферазы,ПФГлутаматдегидрогеназа,NAD+
Глутаматдегидрогеназа,NAD+
Гистидаза-Серин,треониндегидратазы,ПФ
ОксидазаL-аминокислот,FMN
Всеткани
Всеткани
Преимущественнопечень
Печеньипочки
Биогенныеамины
Окислительное
дезаминирование (путьинактивациибиогенныхаминов)
Аминооксидазы,FAD Всеткани
АМФ Гидролитическоедезаминирование
АМФ-дезаминаза Интенсивноработающаямышца
Свободные аминокислоты всасываются и после транспорта кровьювключаютсявклеткахвразличныепутииспользования,главнымизкоторыхявляетсясинтезсобственныхбелков.Крометого,аминокислоты
используются для синтеза других азотсодержащих соединений, напримертаких, как тироксин, адреналин, гистамин, выполняющих специфическиефункции. Аминокислоты используются также как источники энергии,включаясьвпуть катаболизма.
Пути образования и обезвреживания аммиака. Первичное иокончательноеобезвреживаниеаммиака.Глюкозо-аланиновыйцикл.
ОрнитиновыйциклКребса.СвязьсЦТК.Рольсвободныхаминокислотвпроцессеобезвреживанияаммиака.
Аммиак(NН3)–продуктобменабольшинствасоединений,содержащихамино-и
амидогруппы.Главнымпутѐмобразованияаммиакаслужитокислительноедезаминирование.Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологическихзначениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способенпроникатьчерезбиологическиемембраныизадерживаетсявклетке.Накопление
NН4+ вызывает торможение заключительных этапов цикла трикарбоновых кислот иснижениепродукцииАТФ.Поэтомуворганизмесуществуетрядмеханизмовсвязывания(обезвреживания)аммиака