
Рябов Г.А. - Синдромы критических состояний - 1994
.pdf* См. также рис. 6.1.
АЧТВ максимально отражает более ранние стадии образования сгустка, т. е. те, на которых начинается действие факторов внутреннего механизма — XII, XI, IX, наконец, VIII. Наоборот, сдвиги ПВ в большей степени отражают более поздние этапы коагуляции крови — образование фактора Ха, дефицит фактора V (акселератор), недостаток протромбина или дефицит (избыток) фибриногена.
Если обнаружено удлинение АЧТВ, подтверждающееся при повторных постановках теста с использованием 50% смеси плазмы больного и нормальной плазмы, то это может свидетельствовать о дефиците какого-либо из названных факторов или их ингибиции, например иммуноглобулином G, который инактивирует один из коагуляционных белков. Дефицит плазменных факторов можно корригировать инфузией нормальной плазмы, тогда как ингибирующее влияние иммуноглобулина корригировать трансфузией плазмы нельзя и удлинение АЧТВ останется прежним.
Причины дефицита коагуляционных факторов различны. Он может быть связан с нарушением или полным прекращением синтеза коагуляционных протеинов в печени, качественными нарушениями молекул белков, из которых образуется коагуляционный протеин, или, наконец, с дефицитом ферментов, необходимых для синтеза. Дефицит коагулирующих факторов нередко связан с повышенным потреблением фактора в коагуляционном процессе, в частности при ДВС-синдроме, наконец, при инактивации факторов циркулирующими в крови патогенными антителами или ингибиторами [,Machin S. J., 1983].
Все факторы коагуляции крови, кроме VIII (антигемофильный глобулин), синтезируются в печени. Фактор VIII образуется в эндотелиальных клетках как антиген и приобретает коа-гуляционную активность уже в кровотоке. Точная последовательность этого процесса неизвестна, однако предполагается, что происходит образование комплекса с какими-то низкомолекулярными субстанциями [Machin S. J., 1983].
Врожденные расстройства коагуляции. Описаны различные состояния, связанные с дефицитами коагуляци-онных факторов, но все они весьма редки, за исключением гемофилии, болезни Кристмаса (гемофилия В) и болезни Вил-лебранда. Гемофилия и болезнь Кристмаса передаются как сцепленный с полом рецессивный признак. Болезнь Виллебранда обычно обусловлена передачей аутосомного доминантного признака. Все остальные врожденные болезни коагуляции крови являются, как считают, аутосомными рецессивными.
Классическая гемофилия является результатом синтеза патологической молекулы фактора VIII, не проявляющей специфической биологической активности, но повышающей уровень иммунологически активных веществ (антиген). Содержание тромбоцитов в крови обычно нормальное, так же как их функция [Bloom A. L., 1977]. Клинически тяжесть заболевания обычно тесно коррелирует с дефицитом нормального фактора VIII. При дефиците его
менее 50% признаки болезни, как правило, отсутствуют. При наличии его менее 5% нормы развиваются продолжительные эпизоды кровотечения, которые трудно контролируются. Характерны гемартрозы. При полном отсутствии фактора VIII, если не проводится специальная терапия, очень часты тяжелые спонтанные кровотечения после незначительных повреждений. Иногда возможен смертельный исход.
Основой терапии гемофилии (гемофилических кровотечений) является возмещение дефицита фактора VIII донорским препаратом. Благодаря такой профилактической терапии стала возможной нормальная жизнь тяжелобольных. Поскольку продолжительность жизни донорского фактора VIII в крови больного невелика и через 10—14 ч остается половина перелитой дозы, для уверенного контроля в случаях острого кровотечения необходимо двукратное в течение суток введение донорского препарата.
Криопреципитат готовят из свежей крови, лиофилизируют и многократно фракционируют для получения концентрата. Приготовленные концентраты чисты, имеют дозированную активность фактора VIII в малом объеме и могут быть легко введены самостоятельно в домашних условиях. Однако при введении антигемофильных препаратов высок риск заболевания вирусным гепатитом, хроническим заболеванием печени, приобретения аллоантител к эритроцитам, тромбоцитам, HLA и плазменным белковым антигенам [McVerry В. A., Machin S. J., 1979].
В последние годы лечение и поддержание больных с гемофилией осложняет проблема СПИДа. Приблизительно у 5—10% больных гемофилией постепенно увеличивается количество ингибиторов фактора VIII, развивается резистентность к лечению криопреципитатами и лиофилизированными концентратами. Эпизоды кровотечений становятся чаще и в конце концов возникает необходимость применения стероидных препаратов, иммуносупрессоров, интенсивного плазмообмена, применения бычьего или свиного фактора VIII или очень высоких доз человеческого фактора VIII [Penner J. A., Kelly P. E., 1975].
Весьма сходна с истинной гемофилией ситуация при болезни Кристмаса (дефицит фактора IX — антигемофильного фактора В), при которой также наблюдается тенденция к спонтанным кровотечениям. Период полураспада фактора IX в циркулирующей крови довольно короткий (до 24 ч), поэтому лечение болезни Кристмаса предпочтительнее проводить с использованием свежезамороженной плазмы и концентратов фактора IX.
Болезнь Виллебранда характеризуется продолжительным временем кровотечения, снижением адгезивной способности тромбоцитов, уменьшением содержания коагулоактивного фактора VIII и его иммунной антигенной активности [Meyer D., 1977]. При классической болезни Виллебранда одновременно снижаются все три показателя активности фактора VIII, хотя описано, например, состояние, при котором нормальное содержание антигена сочеталось со снижением адгезивной активности тромбоцитов и изменением их электрофоретической активности. У некоторых больных с синдромом Виллебранда в молекуле фактора VIII
уменьшается содержание одного из углеводов, в результате чего тормозятся процессы адгезии и ристоцетиновой агрегации. Некоторые приобретенные формы болезни Виллебранда могут возникать у больных с аутоиммунными заболеваниями [Ingram G. I. et al., 1971]. У них накапливаются антитела, которые преципитируют часть молекулы фактора VIII и нарушают нормальный процесс адгезии тромбоцитов. Обычно наблюдаются лимфоматозы и коллагенозы. Наиболее эффективны при лечении подобных больных криопреципитаты и менее эффективны концентраты фактора VIII.
Как уже указывалось, другие врожденные расстройства функции плазменных факторов свертывания крови встречаются реже. Они могут быть достаточно просто выявлены скрининговыми тестами. Обычно их лечение связано с необходимостью возмещения недостающего фактора, и это, как правило, может быть достигнуто инфузией свежезамороженной плазмы. Скри-нинговым методом не удается выявить дефицит фактора XIII (фибринстабилизирующий фермент), поскольку дефицит обнаруживается не ранее 2—3 сут после образования фибринового сгустка. Дефицит фактора XIII диагностируют обычно по ускоренному лизису образовавшегося сгустка в моче.
Дефицит витамина К. Жирорастворимый витамин К необходим для синтеза печенью факторов II (Протромбина), VII, IX и X. В связи с этим названные факторы принято именовать витамин-К-зависимыми. Витамин К синтезируется в кишечнике при участии кишечных бактерий. Его абсорбция в кишечнике происходит с участием желчи. Витамин К действует путем карбоксилирования глутаминовых остатков молекул аминокислот [Brozovic M., 1976]. Механизм действия его заключается в связывании одного из названных факторов с поверхностью фосфолипида в присутствии Са2+. Благодаря этому фактор становится функционально активным и участвует в процессах дальнейшего каскада, т. е. превращается из профермента в фермент. При дефиците и в отсутствие витамина К печень синтезирует неполноценные белки, которые не способны связываться с поверхностью фосфолипида. В печени образуется некоторое количество иммуноактивных аминокислотных соединений, которые сходны с нормальными белками и могут быть выявлены иммунологическими методами. В иностранной литературе эти соединения названы PIVKA (протеины, вызванные отсутствием витамина К или антагонизмом к нему). Сами по себе они также могут несколько ингибировать коагуляционный процесс. Их появление в крови неопровержимо свидетельствует об отсутствии витамина К. Однако при заболеваниях печени, приводящих к нарушению синтеза белков, продукция PIVKA прекращается. Если уровень витамина К в организме снижается, то активность витамин-К-зависимых факторов снижается со скоростью, соответствующей периоду их полураспада в крови (фактора VII— 2—4 ч, IX —25 ч, фактора X —40 ч, фактора II —60 ч).
У новорожденных в течение первых 3—5 дней имеется дефицит витамин-К-зависимых факторов из-за функциональной незрелости печени и сниженных запасов витамина К (стерильность кишечника и отсутствие
витамина К в материнском молоке). Введение ребенку 1 мг витамина K1 полностью подавляет геморрагический синдром. Большие дозы витамина К нежелательны, так как могут вызвать гемолитическую желтуху из-за дефицита гликолитических ферментов.
Дефицит витамина К наблюдается у больных с механической желтухой, поскольку желчь у них не попадает в область образования витамина — в кишечник. Среди других причин дефицита витамина К могут быть названы язвенный стоматит, длительная диарея, фиброзный цистит, длительное лечение минеральными маслами (вазелин). Стерилизация кишечника, например длительное применение антибиотиков, также снижает синтез витамина К. Для коррекции этих состояний необходимо внутривенное введение 10 мг витамина K1 ежедневно в течение недели.
Длительный прием производных кумарина (пелентан, фенилин) внутрь также ингибирует активирующее действие витамина К на факторы II, VII, IX, X. Поскольку существует множество лекарственных веществ, которые при комбинации с кумариновыми препаратами могут либо усиливать, либо ослаблять их действие, необходим контроль за эффективностью лечения кумаринами с применением ПВ-теста. Если передозировка кумариновых препаратов приводит к ятрогенному кровотечению, то больному необходимо ввести свежезамороженную плазму или концентрат протромбинового комплекса.
Болезни печени. Кровотечения часто осложняют заболевания печени. Время жизни гемокоагулирующих факторов значительно короче, чем других белков, поэтому острые нарушения синтетической функции печени прежде всего сказываются на уровне в крови витамин-К-зависимых факторов. Наблюдается также снижение активности фактора V, хотя общее содержание его в крови может оставаться достаточно высоким. Поскольку фактор V не является витамин-К-зависимым, ослабление его активности расценивается как более ранний и точный критерий развившейся печеночной недостаточности, чем дефицит витамина К. При более глубоких расстройствах функции печени может отмечаться снижение уровня фибриногена в крови или появление патологических молекул фибриногена с последующим нарушением процесса полимеризации образующегося фибрина.
В печени происходит также деградация (инактивация) активированных коагуляционных факторов и фибринолитических ферментов. Недостаточность деградационной функции печени может быть причиной возникновения ДВС-синдрома. Аналогично этому нарушение естественной деградации фибринолитических ферментов может привести к повышению фибринолитической активности и острому фибринолизу. Острый фибринолиз особенно опасен у больных со скрытой печеночной недостаточностью, оперируемых по поводу заболеваний легких, матки, предстательной железы, т. е. в тех случаях, когда высвобождается большое количество активаторов плазминогена, запускающих и усиливающих процесс фибринолиза. При заболеваниях печени нередко можно определить
повышенный уровень фактора VIII в крови, так как синтез его осуществляется вне печени, печеночный клиренс активированных молекул фактора VIII, происходящий в печени, замедлен.
При циррозе печени и портальной гипертензии возможна тромбоцитопения из-за вторичного гиперспленизма и потребления тромбоцитов. У больных алкоголизмом возможно угнетение функции костного мозга и продукции мегакариоцитов. В результате нередко развивается первичная тромбоцитопения.
У больных портальным циррозом печени обильные желудочнопищеводные кровотечения могут поддерживаться также нарушением коагуляционного потенциала, вызванным заболеванием печени. Такие больные, помимо общих мероприятий, направленных на остановку кровотечения, нуждаются в специальном лечении (инфузия препаратов плазмы, свежезамороженной плазмы, тромбоцитной массы и др.) Однако следует помнить, что использование в подобных случаях препаратов протромбинового комплекса взамен свежезамороженной плазмы может осложнить ситуацию развитием тромбоэмболических осложнений из-за высокого содержания в нем активированных факторов коагуляции [Kasper С.
К-, 1973].
6.4. Синдром диссеминированного внутрисосудистого свертывания
ДВС-синдром, известный также как тромбогеморрагический, или коагулопатия потребления, осложняет патологические процессы и состояния, например массивную кровопотерю, травматические повреждения, различные виды шоковых состояний, злокачественные новообразования, тяжелые деструктивные процессы в органах, массивные гемотрансфузии, гипоксические состояния, отравления ядами и др. [Балуда В. П., 1977]. В основе синдрома лежит рассеянное свертывание крови в мелких сосудах, блокирующее их и вызывающее глубокие нарушения функции органов. Развиваются тяжелая гипоксия и ацидоз, которые нередко приводят к гибели больного [Raby С., 1974]. В результате массивного коагуляционного процесса, истощающего коагуляционный потенциал организма, возникает дефицит ряда факторов свертывания, ведущий затем к неконтролируемым профузным кровотечениям (схема 6.4).
Схема 6.4. Развитие ДВС-синдрома
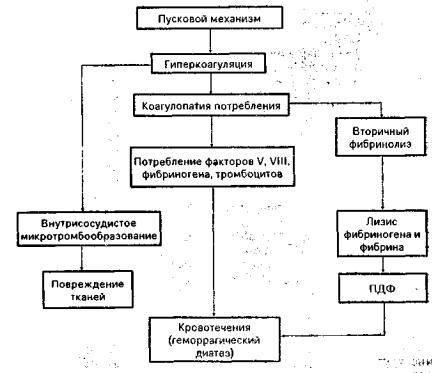
В основе многообразных и многочисленных пусковых механизмов ДВС-синдрома лежат три главных момента [Cash J. D., 1977]:
1)стимуляция коагуляционного процесса путем высвобождения тканевых факторов в кровоток. Это может иметь место, в частности, при обширных хирургических операциях, эпизодах внутрисосудистого гемолиза, диссеминации злокачественно перерожденной ткани;
2)активация тромбоцитарной агрегации, которая может возникнуть при септицемии, вирусной инвазии, болезни иммунных комплексов, появлении в циркуляции тромбина, образующегося в результате активации коагуляционных факторов;
3)тяжелые поражения эндотелия сосудистых стенок, возникающие в результате распространенного васкулита, при ожогах, ацидозе, инфекционном процессе, продолжительной гипотензии или гипоксии и активации как внешнего, так и внутреннего механизма коагуляции крови.
Следует подчеркнуть, что более чем в 60% случаев ДВС-синдром связан с сепсисом, вызываемым главным образом грам-отрицательной флорой. Нередко ДВС-синдром бывает обусловлен вирусной инфекцией, патогенной грибковой флорой, туберкулезными микобактериями.
В циркулирующей крови в результате ДВС-синдрома снижается содержание тромбоцитов, накапливаются продукты про-теолиза, которые оказывают антикоагулирующее и токсическое действие, усиливается процесс фибринолиза. Развивающийся тяжелый геморрагический синдром в ряде случаев может быть единственным клиническим проявлением этого сложного патологического процесса. Разнообразны провоцирующие ДВСсиндром патологические факторы. Это прежде всего образующиеся тканевые тромбопластины, коллаген, бактериальные коагулазы, воздействие ядов змей,
образование иммунных комплексов. Различия названных факторов определяют клинико-патогенетическое разнообразие проявлений ДВСсиндрома. Однако конечный механизм развития синдрома всегда связан с образованием в системе микроциркуляции рыхлых масс фибрина и агрегатов клеток крови [Баркаган 3. С. и др., 1979; Балу-Да В. П., 1979; Баркаган 3. С., 1980, и др.].
С точки зрения патофизиологии образование сгустков на уровне капилляров обусловлено прежде всего избытком тромбина, под влиянием которого происходит активная трансформация фибриногена в фибрин.
Вразвитии ДВС-синдрома различают несколько клинических стадий. Каждая из них имеет специфическую клинико-лабораторную характеристику
[Мачабели М. С., 1970; Баркаган 3. С., 1980],.
I стадия — гиперкоагуляция крови и образование внутрисо-судистых агрегаций клеток, формирование блокады микроциркуляции в органах (легкие, почки, печень и др.), комбинация, гиперкоагуляции с началом истощения свертывающих и противосвертывающих механизмов. Как правило, I стадия синдрома совпадает с острой фазой критического состояния.
II стадия — глубокое истощение факторов свертывания крови, развивающееся в результате потребления тромбоцитов, фибриногена, факторов V, VIII, XIII. В крови накапливаются ингибиторы свертывания крови и агрегации, а также продукты деградации фибриногена и фибрина, которые сами по себе обладают антикоагулянтной активностью. Возникают профузные кровотечения. Эта стадия характеризуется также максимальным истощением противосвертывающих механизмов, в частности антитромбина- Ш, который расходуется на инактивацию тромбина и ряда активированных протеолитических факторов свертывания. Снижается также концентрация плазминогена, который под влиянием активаторов трансформируется в плазмин.
III стадия — исходы и остаточные явления ДВС-синдрома (тромбозы и дистрофии органов).
Этиологическое множество форм ДВС-синдрома в значительной степени усложняет его диагностику. Однако преодоление трудностей облегчается тем, что при многих формах патологии ДВС-синдром является, как считает 3. С. Баркаган (1980), либо единственно возможным нарушением гемостаза, либо обязательным компонентом заболевания. В связи с этим клиническая диагностика ДВС-синдрома в значительной степени становится ситуационной, т. е. диагностика конкретного патологического состояния (сепсиса, кровопотери, распространенного ракового поражения, ожога) уже предполагает наличие ДВС-синдрома. Важным, хотя и не обязательным компонентом может быть наличие у больного клинически диагностируемых тромбогеморрагических явлений.
Вхирургической практике связь тромбогеморрагических явлений с возникающим или развившимся ДВС-синдромом обусловлена значительной кровопотерей, массивной гемотрансфузией, тяжелой травмой, сепсисом,
трансплантацией органов, искусственным кровообращением, ожогами, гипоксией и постгипоксическим синдромом, другими критическими состояниями. ДВС-синдром часто встречается в акушерской практике
[Herbert W., Cefalo R. С., 1984; Sher G., Satland В. Е., 1985].
Хотя основы изучения расстройств микроциркуляции у больных в критических состояниях заложены в конце 40-х — начале 50-х годов [Knisely
Н., 1947; Bloch A. S., Elliott S. Н., 1962, и ДР-], разработка учения о ДВС-
синдроме является достижением последних лет. Вместе с тем опыт лечения ДВС-синдрома пока невелик во всем мире. Вполне возможно, что потребуется частично или полностью пересмотреть, а может быть, дополнить ряд положений. С нашей точки зрения, одно из таких положений относится к гипердиагностике ДВС-синдрома. В последние годы достаточно типичную картину ДВС-синдрома, подтвержденного лабораторными данными и динамикой их в процессе лечения, мы наблюдали лишь у 20 из 1000 больных, леченных по поводу различных критических Состояний.
Другой важный момент связан с определением роли, которую в происхождении ДВС-синдрома играют ятрогенные факторы, такие как массивная гемотрансфузия, гиперосмоляльный синдром, инфузия кровезаменителей и плазмоэкспандеров. Этот вопрос требует дополнительных исследований.
В настоящее время в литературе отсутствуют четкая информация и данные о связи ДВС-синдрома с гипоксией или постгипоксическим (с возможным участием гиперкапнии) состоянием. В нашей клинической практике получены доказательства подобной связи, которые обсуждены ниже.
С клинической точки зрения при диагностике ДВС-синдрома важно обнаружить следующие типичные симптомы: тромбоцитопению, снижение содержания фибриногена в плазме, повышение содержания ПДФ в плазме, наличие в мазке крови обломков эритроцитов (феномен фрагментации), положительные этаноловый и протаминсульфатный тесты (у некоторых больных), снижение концентрации факторов V, VII, VIII, IX, X и антитромбина-III, иногда снижение активности фактора XIII. Геморрагический компонент синдрома формируется главным образом в стадии гипокоагуляции (см. схему 6.4) и представляет собой опасную, хотя и не обязательную фазу ДВС-синдрома. Он проявляется кровотечением из всех мест повреждения тканей и особенно опасен при хирургических и акушерских ситуациях прежде; всего в силу обширности области геморрагии [McKay D. G., 1983]. Возникшее вначале в определенной области кровотечение становится генерализованным и дополняется неспровоцированными носовыми геморрагиями, кровотечениями в желудочно-кишечный тракт, забрюшинными гематомами, кровоизлияниями в различные органы и кровотечениями в плевральную и брюшную полости. Характерны неостанавливаемые кровотечения из всех мест проколов кожи.
Вытекающая из ран или из матки кровь не образует полноценных свертков либо часами не свертывается. Эти нарушения, обусловленные
частично дефицитом фибриногена, возникают главным образом в результате активации фибринолиза и протеолиза, а также связаны с накоплением в плазме ПДФ, накоплением несвертывающихся или плохо свертывающихся фибри-ногеновых или фибрин-мономерных комплексов. Однако практически никогда не наблюдается полного исчезновения фибриногена из крови. По современным представлениям о патогенезе ДВС-синдрома, его развитие не связано исключительно с дефицитом фибриногена или с его патологией. Более того, известны случаи, когда этот синдром возникал при нормальном или даже повышенном уровне фибриногена.
Внастоящее время убедительно доказано, что ДВС-синдром — комплексное заболевание, в основе которого лежит не только блокада микроциркуляторного сосудистого русла осаждающимся фибрином, агрегатами клеток и продуктами фибринолиза и протеолиза, но и повреждение стенок сосудов указанными элементами. Развивающийся сладж-синдром и ацидоз также вызывают дистрофию стенок сосудов. Важнейшим компонентом этого процесса является также патология тромбоцитов, которая служит одной из главных причин неостанавливаемых кровотечений при ДВС-синдроме [Kowalski D. S., SolumM., 1973].
Нарушения микроциркуляции в наибольшей степени выражены в легких и почках. В легких развивается картина, характерная для СДРВ с интерстициальным отеком легких, синдромом внутрилегочного шунтирования и нарушением диффузии газов через альвеолярнокапиллярную мембрану. Появляется и прогрессирует гипоксия, которая
клинически проявляется одышкой, цианозом, снижением PaО2. Нарастает острая почечная недостаточность, которая выражается в олигурии, иногда анурии, низкой плотности мочи, появлении в моче белка и свободного гемоглобина, цилиндров, эритроцитов. Повышается содержание мочевины и креатинина крови.
При геморрагических проявлениях диагноз ДВС-синдрома можно ставить с уверенностью, если концентрация фибриногена в крови 1 г/л или
менее, протромбиновый индекс менее 45%, а число тромбоцитов снижается до 90-109/л [Kunz F. et al., 1974]. Вследствие активации коагуляционной системы и нарастающего внутрисосудистого тромбоза развивается также вторичное усиление фибринолитической активности, которая ведет к образованию плазмина, растворяющего свертки фибрина и разрушающего циркулирующий фибриноген.
Вплазме появляется большое количество ПДФ [Серов В.Н., Макацария А.Д., 1987], уровень которых при острых вариантах ДВС-синдрома превышает 80—100 мкг/мл. ПДФ можно определить экспресс-методом, используя специальные коммерческие наборы. У некоторых больных уровень ПДФ иногда не соответствует выраженности синдрома и остается невысоким. Это связано с угнетением фибринолитической системы и прогностически оценивается как неблагоприятный симптом, поскольку свидетельствует о необратимости блокады микрососудистого русла.
Удлинение тромбинового времени обычно связано с истощением
коагулируемого фибриногена, увеличением концентрации ПДФ, которые в подобных случаях действуют как патологические антикоагулянты, а также с повышением уровня циркулирующего гепарина. Все это значительно увеличивает антикоагулянтный потенциал крови и обусловливает массивные кровотечения при низком уровне фибриногена. При увеличении тромбинового времени вдвое по сравнению с нормой кровотечение становится угрожающим.
Важное значение в диагностике ДВС-синдрома имеет выявление дефицита в плазме антитромбина-III, на долю которого приходится до 80% антикоагулянтного потенциала плазмы. Установлено, что дефицит антитромбина-III ниже 30% не совместим с жизнью, поскольку приводит к множественным тромбозам [Баркаган 3. С. и др., 1980] и не корригируется гепари-нотерапией. Развивающаяся в критических состояниях активация всех ферментных систем организма, включая фибринолити-ческую, комплементарную, калликреиновую, резко уменьшает в плазме содержание антитромбина-III, являющегося основным ингибитором активированных факторов и других протеаз. Происходит интенсивное потребление антитромбина-III на инактивацию всех протеаз, участвующих в процессе гемокоагуляции,— активированных факторов XII, XI, IX, X, II и др. Истощение содержания антитромбина-III существенно снижает антикоагулянтный и антитромботический эффект эндогенного и экзогенного гепарина. Как мы уже указывали, ДВС-синдром имеет многофакторный патогенез, который еще не изучен до конца. В табл. 6.2 представлен ряд состояний, которые могут быть непосредственной причиной различных коагулопатий, в том числе ДВС-синдрома. Среди них есть указание на гипоксию и постгипоксический синдром. На возможную связь коагулопатий с хроническим гипоксическим состоянием, обусловленным врожденным пороком сердца, указывали Е.П. Степанян, А.И. Лагутина (1959) и Л.М. Терентьева (1964). Однако вероятность развития ДВС-синдрома при острой гипоксии в литературе практически не обсуждается. Между тем возможность
идаже обязательность освобождения значительного количества тромбопластина и других тканевых коагулаз при гипоксическом повреждении клетки неоспорима. Это предполагает активацию коагуляционного потенциала, которую при гипоксии нередко можно подтвердить документально. В этой связи считаем важным сослаться на собственное наблюдение, подтверждающее связь ДВС-синдрома с гипоксией
игиперкапнией.
Больной X., 61 года, долгие годы страдавший бронхиальной астмой, поступил в отделение реанимации в связи с развитием астматического статуса. Опуская обстоятельства, предшествовавшие возникновению статуса, его причины, динамику развития и ряд обстоятельств лечения, укажем лишь, что прогрессирование статуса привело в конце концов к необходимости перевода больного на ИВЛ. Несмотря на многократную фибробронхоскопию, лаваж, массивную бронхолитическую терапию постепенно развились гиперкапния (РаСО2 65 мм Рт. Ст.) и гипоксия (Рао2 52 мм рт. ст.).
Максимально допустимый в создавшихся условиях режим вентиляции не улучшил состояние больного, и через 1 сут после начала ИВЛ стала нарастать гиперкапническая и
