
Нормальная физиология / КР6 Сосудистая система, регуляция кровообращения
.pdf
|
Фактор |
роста |
эндотелия |
сосудов |
|
́ |
́ |
́ |
́ |
(VEGF; англ. Vascular endothelial growth factor) — сигнальный белок, вырабатываемый клетками для стимулирования васкулогенеза (образование эмбриональной сосудистой системы) и ангиогенеза (рост новых сосудов в уже существующей сосудистой системе). В настоящее время известно несколько различных факторов данного семейства (которое, в свою очередь,
является подклассом достаточно обширного на сегодняшний день класса факторов роста). Наиболее важный представитель – VEGF-A. Его экспрессия определяется множеством факторов, в т. ч. провоспалительными. Однако наибольшее значение имеет экспрессия, запускаемая опосредованно через транскрипционный фактор, индуцируемый гипоксией (НIF).
Белки VEGF служат частью системы, отвечающей за восстановление подачи кислорода к тканям в ситуации, когда циркуляция крови недостаточна. Концентрация VEGF в сыворотке крови повышена при бронхиальной астме и сахарном диабете. Основные функции VEGF — создание новых кровеносных сосудов в эмбриональном развитии или после травмы, усиление роста мышц после физических упражнений, обеспечение коллатерального кровообращения (создание новых сосудов при блокировании уже имеющихся).
Повышенная активность VEGF может привести к возникновению различных болезней. Так, со́лидные раковые опухоли не могут вырасти крупнее некоторого ограниченного размера, не получив адекватного кровоснабжения; опухоли же, способные экспрессировать VEGF, могут расти и метастазировать. Избыточная экспрессия VEGF может вызвать сосудистые заболевания тех или иных частей тела (в частности, сетчатки глаз). Некоторые созданные в последние годы лекарственные препараты (такие, как бевацизумаб) способны, ингибируя VEGF, контролировать или замедлять течение таких заболеваний.
РОЛЬ VEGF В ПАТОЛОГИИ.
Уровень VEGFxxx коррелирует с неблагоприятных прогнозом при раке молочной железы. Многочисленные исследования показывают снижение общей выживаемости и выздоровления с этими опухолями при избыточной экспрессии VEGF. Сверхэкспрессия VEGFxxx может быть первым шагом в процессе метастазирования — шагом, который включает «ангиогенный» переключатель. Хотя VEGFxxx связан с плохой выживаемостью, его точный механизм действия в прогрессии опухоли остается неясным.
Белки VEGFxxx также выделяются при ревматоидном артрите в ответ на ФНО-α, вызывая повышение сосудистой проницаемости и отёки, а также стимулирование ангиогенеза (формирование капилляров).
VEGFxxx играет важную роль при диабетической ретинопатии. Микроциркуляторные проблемы в сетчатке людей с диабетом могут привести к ишемии сетчатки, что приводит к высвобождению VEGFxxx, который начинает преобладать над антиангиогенными изоформами VEGFxxxb. Активность VEGFxxx, в свою очередь, способна привести к образованию новых кровеносных сосудов в сетчатке (предвещая изменения, которые могут представлять угрозу для зрения).
https://t.me/kalecurly |
https://vk.com/kalecurly |

Важное значение имеют белки VEGF в патологии влажной формы возрастной макулодистрофии, являющейся ведущей причиной слепоты у пожилых людей в промышленно развитых странах. У сосудистой патологии возрастной макулодистрофии наблюдается определённое сходство с диабетической ретинопатией, хотя причины заболевания и типичный источник неоваскуляризации отличаются.
Сывороточный уровень белка VEGF-D значительно выше (по сравнению со среднестатистической нормой) у больных с ангиосаркомой[1]. У пациентов, страдающих от эмфиземы легких, было установлено снижение уровня VEGF в лёгочных артериях. В почках повышенная экспрессия VEGFxxx в клубочках непосредственно вызывает гломерулярную гипертрофию, связанную с протеинурией. Изменения уровня VEGF могут указывать на ранние стадии разви-
тия преэклампсии.
— рецептор с тирозинкиназной активностью, активируемый сигнальным бел-
ком VEGF (англ. Vascular endothelial growth factor)[3][4]. Известно три типа рецепторов, которые нумеруются как 1, 2 и 3. В зависимости от альтернативного сплайсинга, они бывают мембраносвязанные и растворимые[5].
Работа рецептора.
Все члены семейства белков VEGF стимулируют клеточный отклик, связываясь с рецепторными тирозинкиназами на поверхности клетки; активизация данных белков происходит путём их трансфосфорилирования. Все VEGF-рецепторы имеют внеклеточную часть, состоящую из 7 имму- ноглобулин-подобных областей, один трансмембранный участок и внутриклеточную часть, содержащую тирозинкиназный домен. Белок VEGF-A связывается с рецепторами VEGFR-1 (Flt-1) и VEGFR-2 (KDR/Flk-1); при этом рецептор VEGFR-2 выступает как посредник почти во всех известных реакциях клетки на VEGF. Функции рецептора VEGFR-1 определены менее чётко (хотя полагают, что он модулирует сигналы VEGFR-2). Ещё одна функция VEGFR−1 заключается в том, что он может выступать как «пустой» рецептор, изолируя белок VEGF от рецептора VEGFR-2 (что представляется особенно важным при ангиогенезе во время развития зародыша)[3].
https://t.me/kalecurly |
https://vk.com/kalecurly |
Оксид азота — сосудорасширяющее вещество, которое выделяют эндотелиальные клетки в норме. Наиболее важным эндотелиальным фактором релаксации является оксид азота (NO). Это липофильный газ, который выделяют эндотелиальные клетки в ответ на различные химические и физические стимулы.
Фермент эндотелиальная синтаза оксида азота способствует синтезу NO из кислорода и аргинина путем редукции неорганического нитрата. NO диффундирует из эндотелиоцита в кровь и действует местно, т.к. период полужизни NO составляет примерно 6 сек. В гладкомышечных клетках сосудистой стенки NO активирует растворимую гуанилатциклазу (рис. 17–6),
в результате циклический гуанозинтрифосфат (цГТФ) превращается в циклический гуанозин-
монофосфат (цГМФ). цГМФ активирует ГМФ-зависимую протеинкиназу, различные влияния которой на внутриклеточные процессы и приводят к расслаблению гладких мышц и расширению сосудов.
Ток крови по артериям и артериолам увеличивает в эндотелиальных клетках напряжение сдвига, которое возникает в результате трения между кровью и сосудистой стенкой. Напряжение сдвига вызывает деформацию эндотелиальных клеток, что приводит к выделению NO, расширяющего кровеносные сосуды. Это целесообразная реакция, поскольку метаболические механизмы, контролирующие местный кровоток в тканях, влияют только на мельчайшие артерии и артериолы. Возрастание кровотока в микроциркуляторном русле стимулирует выделение NO в более крупных сосудах, т.к. скорость кровотока и напряжение сдвига в них тоже возрастают. Таким образом, выделение NO увеличивает диаметр сосудов, расположенных выше по течению крови, каждый раз, когда увеличивается кровоток в микрососудах, расположенных ниже по течению крови. Без такой реакции эффективность механизмов, регулирующих местный кровоток, была бы крайне низкой из-за высокого сопротивления мелких артерий.
Синтез и выделение NO стимулируют также некоторые вазоконстрикторы, например ангиотензин II, который связывается со специфическими рецепторами мембран эндотелиоцитов. Усиленное выделение NO в этом случае предупреждает выраженное сужение сосудов.
Повреждение эндотелиальных клеток и снижение синтеза NO на фоне хронической гипертензии или атеросклероза может привести к чрезмерной вазоконстрикции, что увеличит тяжесть гипертензии и степень повреждения эндотелия. Без надлежащего лечения возможно нарушение функций таких органов, как сердце, почки и головной мозг.
Задолго до открытия NO клиницисты применяли нитроглицерин, амилнитраты и другие производные нитратов для лечения пациентов с приступами мучительной боли из-за ишемии сердечной мышцы (стенокардией, или «грудной жабой»). Эти препараты в организме разрушаются с выделением NO и расширением кровеносных сосудов, в т.ч. сосудов сердца.
Другое практическое значение NO для физиологии и фармакологии связано с разработкой и применением лекарственных средств, которые являются ингибиторами специфической фосфодиэстеразы 5 (ФДЭ-5) — фермента, катализирующего распад цГМФ. Препараты данной группы пролонгируют сосудорасширяющее действие NO, предупреждая распад цГМФ. Ингибиторы ФДЭ-5 используют главным образом для лечения эректильной дисфункции. Механизм эрекции обусловлен стимуляцией парасимпатическим медиатором ацетилхолином высвобождения NO в пещеристом теле. Ингибиторы ФДЭ-5 препятствуют деградации NO, в результате усиливается расширение кровеносных сосудов пещеристого тела, что способствует эрекции.
https://t.me/kalecurly |
https://vk.com/kalecurly |

СРС 5. Общие закономерности регуляции органного кровотока. Функциональная (рабочая) и реактивная (постокклюзионная) гиперемия.
Локальные механизмы
NО как координатор. При рассмотрении всех факторов, связанных с локальной регуляцией кровоснабжения, имеет значение тот факт, что отдельные области микроциркуляторного русла обладают разной чувствительностью к этим факторам. При зависимом от напряжения сдвига выделении NО метаболическое расширение терминальных артериол может распространяться на вышележащие сосуды, достигая крупных и терминальных артерий (восходящая вазодилатация). Примерами отчасти синергистического, отчасти антагонистического взаимодействия этих локальных механизмов на тонус сосудов являются ауторегуляция областей кровообращения, функциональная гиперемия и реактивная гиперемия.
Ауторегуляция. Основной механизм ауторегуляции обеспечивает миогенная реакция. В этом случае при повышении трансмурального давления происходит миогенно обусловленное сокращение, настолько сильное, что кровоснабжение остается неизменным в широком диапазоне давлений. Вне этого диапазона наблюдается более или менее пассивное растяжение сосудов. Феномен ауторегуляции можно прежде всего наблюдать в сосудах почек, головного мозга, сердца, скелетной мускулатуры и желудочно-кишеч- ного тракта. Ауторегуляция сохраняется даже после выпадения функции вазомоторных нервов, но при более высоких уровнях кровоснабжения. Напротив, при сильной симпатической активации происходит соответствующий (параллельный оси абсцисс) сдвиг фазы плато соотношения давления и силы потока к более низким значениям. Пределы ауторегуляторной области, как и степень кровоснабжения, в отдельных органах различаются
(рис. 28.29).
Единственным органом, в котором отсутствует ауторегуляция, являются легкие. При увеличении перфузионного давления диаметр сильно растяжимых сосудов легких увеличивается, что приводит к непропорциональному увеличению силы потока (рис. 28.29).
https://t.me/kalecurly |
https://vk.com/kalecurly |

Функциональная (метаболическая) гиперемия. Линейное соотношение между ин-
тенсивностью обмена веществ и кровоснабжением прежде всего можно наблюдать в органах с сильно меняющейся метаболической активностью, таких как сердце, скелетная мышца и экзокринные железы. Эта функциональная гиперемия является следствием преобладания локально-химических вазодилататорных эффектов над миогенными и нейрогенными вазоконстрикторными влияниями. Локальные медиаторы действуют на гладкую мускулатуру не только напрямую, но и опосредованно путем торможения выделения норадреналина из симпатических варикозов. В терминальных и крупных артериях, диаметр которых не контролируется метаболически, дополнительным антагонистом нейрогенной вазоконстрикции выступает зависимое от напряжения сдвига высвобождение NО.
Реактивная гиперемия. После временного прерывания кровотока во всех тканях может возникнуть реактивная (постишемическая) гиперемия. Максимум реактивного увеличения кровоснабжения, как и продолжительность, зависит от длительности окклюзии сосуда, а также от активности метаболизма пораженной ткани. В развитии реактивной гиперемии принимают участие миогенный, метаболический и эндотелиальный компоненты. При снижении трансмурального давления во время остановки кровоснабжения происходит утрата миогенного тонуса и, следовательно, после повторного открывания сосуда происходит его расширение. Этот механизм играет важную роль прежде всего при кратковременных эпизодах ишемии (< 30 с). При более продолжительных нарушениях происходит помимо прочего накопление вазоактивных метаболитов и снижение P(O2). Миогенно-метаболически индуцируемая вазодилатация значительно усиливается после открывания афферентного сосуда за счет зависимого от напряжения сдвига выделения NО.
https://t.me/kalecurly |
https://vk.com/kalecurly |

СРС 6. Механизмы изменения артериального давления при физической нагрузке.
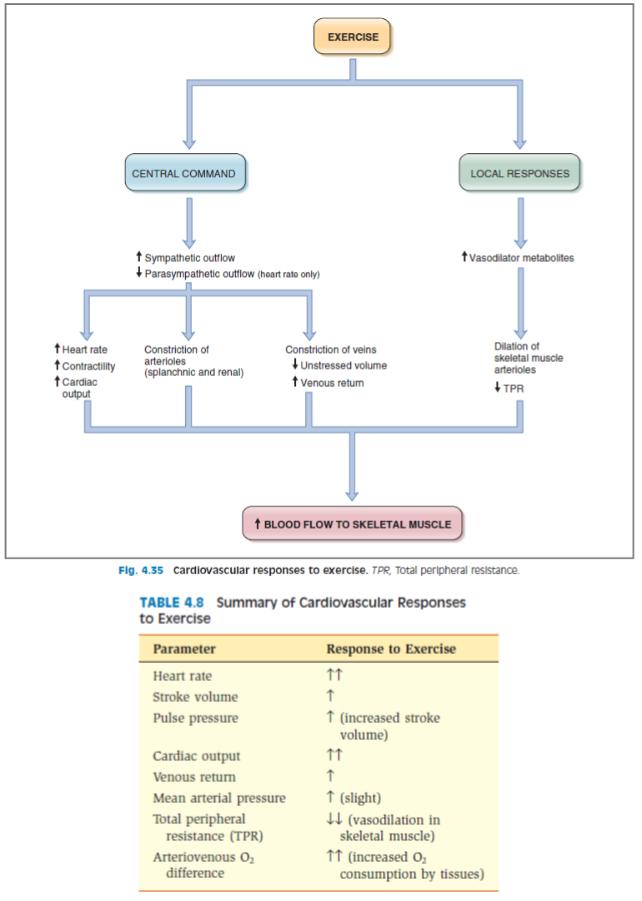
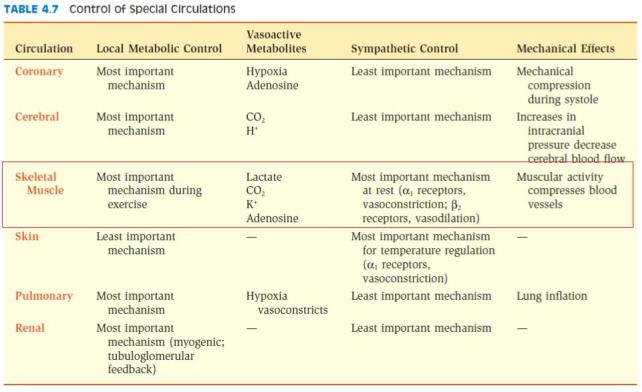
Физиологические изменения гемодинамики при физических нагрузках
Физическая нагрузка нуждается в существенном повышении функции сердечно-сосудистой системы, от которой в значительной степени (обычно в тесной взаимосвязи с другими физиологическими системами организма) зависит обеспечение работающих мышц достаточным количеством кислорода и удаления из тканей углекислоты и других продуктов тканевого метаболизма. Именно поэтому с началом мышечной работы в организме происходит сложный комплекс нейрогуморальних процессов, которые приводят, с одной стороны, в результате активизации симпатоадреналовой системы, к повышению основных показателей системы кровообращения – частоте сердечных сокращений, ударного и минутного объемов крови, системного артериального давления, объема циркулирующей крови и др., а с другой стороны – предопределяют изменения тонуса сосудов в органах и тканях. Изменения сосудистого тонуса проявляются в снижении тонуса и, соответственно, расширении сосудов периферического сосудистого русла (преимущественно гемокапилляров) в то же время с увеличением тонуса и сужением мелких сосудов внутренних органов. Вышеприведенные изменения тонуса сосудов обеспечивают рациональное перераспределение регионального кровотока между функционально активными и неактивными при нагрузке органами. В функционально активных органах кровообращение существенно увеличивается, например, в скелетных мышцах в 15-20 раз (при этом количество функционирующих гемокапилляров может вырасти в 50 раз), в миокарде – в 5 раз, в коже (для обеспечения адекватной теплоотдачи) – в 3-4 раза, в легких – почти в 2-3 раза. В функционально неактивных при нагрузке органах (печени, почках, мозге и др.) кровообращение значительно уменьшается. Если в состоянии физиологического покоя кровообращение во внутренних органах составляет около 50% минутного объема кровообращения (МОК), то при максимальной физической нагрузке он может снижаться до 3-4% от МОК.
Методичка:
Сократительная активность скелетных мышц у человека обеспечивает выполнение производительного физического труда, например, при сельскохозяйственных работах, обработке металлов и дерева (слесарные, столярные работы), сборочных работах и т.д., а также выполнении физических нагрузок в спорте. У тренированных спортсменов (легкоатлетов, лыжников, велосипедистов) при интенсивной физической нагрузке потребление кислорода скелетными мышцами может возрастать до 5-6 л/мин, а мышечный кровоток – до 25-30 л/мин, почти 90-95% величины сердечного выброса. В указанных условиях артериальное давление может повышаться у них до 200 мм рт. ст., а диастолическое до 100 мм рт.ст. Следовательно, интенсивная физическая нагрузка приводит не только к увеличению кровотока в скелетных мышцах (рабочая гиперемия), но и выраженным сдвигам системного крововобращения (увеличение артериального давления, сердечного выброса, венозного возврата). Таким образом, изменения системного кровообращения имеют основное значение для обеспечения адаптации всего организма к условиям физической нагрузки.
Различают краткосрочные и долгосрочные механизмв адаптации сердечно-сосудистой системы. Уже перед началом физической нагрузки кортико-висцеральные взаимодействия по типу условных рефлексов приводят к активации симпатической нервной системы, и повышению в результате артериального давления и частоты сердечных сокращений («предстартовая лихорадка»). Важно также отметить, что импульсы от коры бльших полушарий активируют симпатические холинергические вазодилататорные нервы сосудов скелетных мышц. В результате, сосуды в скелетных мышцах расширяются уже перед началом физической нагрузки. При начале физи-
https://t.me/kalecurly |
https://vk.com/kalecurly |
ческой нагрузки сокращение скелетных мышц нижних конечностей обусловливает увеличение венозного возврата («мышечная помпа»), что по механизму Франка-Старлинга способствует возрастанию сердечного выброса.
В ответ на продолжение физической нагрузки возбуждение проприо- и хеморецепторов скелетных мышц способствует рефлекторной активации центра кровообращения и дальнейшему усилению симпатических нейрогенных влияний на сердце и сосуды. При этом частота сердечных сокращений может возрастать до 190 уд./мин. Повышение сократимости миокарда
вответ на возбуждение симпатических нервов приводит к увеличению ударного объема сердца (за счет снижения остаточного объема), что вместе с увеличением частоты сердечных сокращений способствует возрастанию сердечного выброса. Важно, однако, подчеркнуть, что многократное возрастание сердечного выброса (до 25-30 л/мин) не может быть обеспечено только увеличением частоты сердечных сокращений и сократимости миокарда. При физической нагрузке в результате выраженной констрикции венозных сосудов спланхнической области в кровеносное русло поступает дополнительный объем крови, что увеличивает венозный возврат. Поэтому именно увеличение венозного возврата является определяющим фактором возрастания сердечного выброса в указанных условиях. Выделение адреналина мозговым веществом надпочечников в ответ на активацию симпатической нервной системы также способствует констрикции вен, мобилизации дополнительного объема крови, увеличению венозного возврата и сердечного выброса. Таким образом, увеличение венозного возврата крови к сердцу, сократимости миокарда и частоты сердечных сокращений являются ключевыми факторами возрастания сердечного выброса, с 5-6 л/мин в покое до 25-30 л/мин, т.е. в 5-6 раз. Важно подчеркнуть также, что в норме увеличение работы сердца сопровождается значительным возрастанием коронарного кровотока (в покое 250 мл/мин), в 5-6 раз что обеспечивает адекватное кровоснабжение миокарда.
Констрикция артериальных сосудов в большинстве регионов (спланхническая область, кожа, почки) способствует перераспределению кровотока к скелетным мышцам. Следует отметить, что в условиях интенсивной физической нагрузки в мышцах образуются метаболиты,
впервую очередь, аденозин, которые вызывают расширение сосудов. При этом сосуды становятся малочувствительными к сосудосуживающему влиянию катехоламинов («функциональный симпатолиз»). Поэтому на фоне многократного увеличения сердечного выброса (до 20-30 л/мин) дополнительный объем крови направляется к скелетным мышцам. Выраженная дилатация сосудов скелетных мышц способствует также снижению общего периферического сопротивления сосудов.
Таким образом, в условиях интенсивной мышечной работы увеличение сердечного выброса осуществляется в результате взаимодействия миогенных, нейрогенных и гуморальных механизмов регуляции деятельности сердца.
Кмиогенному относится механизм Франка-Старлинга в ответ на увеличение венозного возврата крови к сердцу при сокращении скелетных мышц и возрастании глубины дыхания. Возбуждение симпатической нервной системы в указанных условиях может происходить двумя путями: 1) в результате влияний кортикальных моторных центров на кортикальные вегетативные центры, т.н. феномен коиннервации моторных и вегетативных центров; 2) в результате возбуждения хеморецепторов скелетных мышц при их интенсивном сокращении в ответ на сдвиги внутриклеточного pH, т.н. мышечный метаборефлекс. Активация симпатической нервной системы вызывает также и усиление выброса катехоламинов надпочечниками, что также способствует увеличению частоты сердечных сокращений и сократимости миокарда. Увеличение концентрации катехоламинов в крови оказывает непосредственное влияние на перераспределение объема крови из вен в сосудистое русло, что способствует возрастанию венозного возврата и сердечного выброса.
https://t.me/kalecurly |
https://vk.com/kalecurly |
В плане долгосрочной адаптации сердца следует отметить, по крайней мере, три механизма: во-первых, развитие рабочей гипертрофии миокарда, в результате чего возрастают размеры сердца и конечно-диастолический объем желудочков в покое; во-вторых, развитие дополнительных коллатералей сосудов миокарда, что увеличивает функциональные возможности кровоснабжения миокарда; наконец, в-третьих, повышение тонуса блуждающих нервов, в результате чего снижается частота сердечных сокращений в покое. Перечисленные процессы приводят к тому, что у тренированных людей и спортсменов возрастание сердечного выброса достигается за счет увеличения ударного объема сердца, тогда как частота сердечных сокращений повышается в меньшей степени, чем у нетренированных людей. Таким образом, систематические физические упражнения обеспечивают благоприятные условия для создания резервов увеличения сердечного выброса, сократительной функции миокарда, а также коронарного кровотока.
У спортсменов различают три возможных типа изменений в сердце:
1)увеличение толщины стенок - концентрическая гипертрофия;
2)увеличение объёма полости левого желудочка эксцентрическая гипертрофия;
3) концентрическое ремоделирование - увеличение толщины стенок при уменьшении объёма полости.
Для электрокардиограммы «спортивного сердца» характерны синусовая брадикардия, ранняя реполяризация, признаки гипертрофии левого желудочка.
Важно, однако, подчеркнуть, что любая гипертрофия левого желудочка рассматривается современной медициной как самостоятельный фактор риска возникновения патологий, которые могут проявляться с возрастом. Следовательно, сформировав себе однажды спортивное сердце, человек должен продолжать занятия спортом хоть в каком-то виде всю жизнь. При переходе к малоподвижному образу жизни возрастает вероятность возникновения и развития патологии сердечно-сосудистой системы, самая частая из которых - артериальная гипертензия. Одним из основных факторов риска развития ишемической болезни сердца у спорстменов является прием анаболических стероидов.
Вместе с тем, наиболее частая причина смерти от сердечно-сосудистой патологии у профессиональных спортсменов - гипертрофическая кардиомиопатия, заболевание, являющееся генетически обусловленным. На нее приходится 36% всех известных случаев смертности в спорте. Это одно из немногих заболеваний, при которых занятия спортом категорически противопоказаны.
https://t.me/kalecurly |
https://vk.com/kalecurly |
https://t.me/kalecurly |
https://vk.com/kalecurly |
https://t.me/kalecurly |
https://vk.com/kalecurly |
