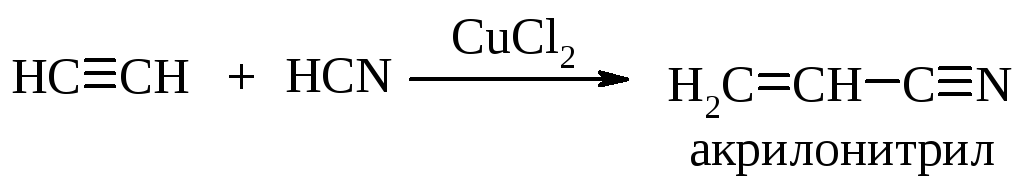- •И.С. Колпащикова, е.Р. Кофанов, е.М. Алов углеводороды. Галогенпроизводные углеводородов
- •1. Алканы
- •1.1. Гомологический ряд, изомеры
- •Гомологический ряд алканов. Число структурных изомеров
- •1.2. Строение метана
- •1.3. Строение этана
- •1.4. Вращение вокруг простой углерод-углеродной связи. Конформации
- •1.5. Физические свойства
- •1.6. Химические свойства
- •1.6.1. Хлорирование и бромирование метана. Механизм реакции
- •1.6.2. Строение метильного радикала
- •1.6.3. Расчет изменения энергии в ходе реакции
- •1.6.4. Энергетическая диаграмма реакции. Связь энергии
- •Хлорирования метана
- •Бромирования метана
- •1.6.5. Причина различной реакционной способности галогенов
- •Зависимость реакционной способности галогенов от энергии связи h–Hal
- •1.6.6. Галогенирование высших алканов. Механизм
- •1.6.7. Медленная стадия. Энергетическая диаграмма
- •1.6.8. Причина различной устойчивости радикалов
- •1.6.9. Зависимость скорости образования радикалов
- •1.6.10. Расчет реакционной способности различных связей
- •1.6.11. Селективность в реакциях хлорирования
- •Малореакционного Br• с пропаном
- •1.6.12. Нитрование
- •1.6.13. Сульфоокисление и сульфохлорирование
- •1.6.14. Окисление
- •1.6.15. Термическое разложение алканов, крекинг
- •1.6.16. Ионные реакции алканов
- •1.7. Методы синтеза алканов
- •1.7.1. Гидрирование алкенов и алкинов
- •1.7.2. Реакция Вюрца
- •2.2. Плоскополяризованный свет. Оптическая активность
- •2.3. Строение молекул и оптическая активность
- •2.4. Обозначение конфигураций
- •2.5. Соединения с несколькими хиральными центрами.
- •2.6. Методы разделения энантиомеров
- •3. Циклоалканы
- •3.1 Номенклатура. Изомерия
- •3.2. Физические свойства
- •3.3. Строение
- •Теплоты сгорания и энергии напряжения циклоалканов
- •3.4. Химические свойства
- •3.5. Способы получения
- •4.2. Строение этена
- •4.3. Физические свойства
- •Физические свойства алкенов
- •4.4. Химические свойства
- •4.4.1. Гидрирование. Теплота гидрирования
- •4.4.2. Теплота гидрирования и устойчивость алкенов
- •4.4.3. Присоединение галогенов
- •4.4.3.1. Механизм реакции
- •4.4.3.2. Реакционная способность галогенов в реакции АdЕ
- •4.4.4. Присоединение галогеноводородов
- •4.4.4.1. Механизм реакции
- •4.4.4.2. Направление электрофильного присоединения
- •К пропену
- •4.4.4.3. Реакционная способность и селективность
- •4.4.4.4. Перегруппировка
- •Механизм реакции
- •4.4.5. Присоединение бромистого водорода в присутствии
- •1. Инициирование:
- •2. Рост цепи:
- •3. Обрыв цепи:
- •4.4.6. Присоединение серной кислоты
- •4.4.7. Гидратация алкенов. Присоединение спиртов
- •4.4.8. Гидроборирование алкенов
- •4.4.9. Алкилирование алкенов
- •4.4.10. Полимеризация алкенов
- •4.4.11. Окисление
- •4.4.12. Реакция аллильного замещения. Галогенирование
- •Характеристики химических связей в молекуле алкинов
- •Характеристики связей с-н в алканах, алкенах и алкинах
- •5.2. Физические свойства
- •5.3. Химические свойства
- •5.3.1. Реакции присоединеня
- •5.3.1.1. Каталитическое гидрирование и восстановление
- •5.3.1.2. Реакции электрофильного присоединения Галогенирование
- •Гидрогалогенирование
- •Гидратация
- •5.3.1.3. Нуклеофильное присоединение
- •5.3.2. Кислотность алкинов
- •Константы кислотности некоторых соединений
- •5.3.3. Взаимодействие алкинов с карбонильными соединениями
- •5.3.4. Окисление алкинов
- •5.3.5. Радикальное присоединение бромоводорода
- •5.4. Способы получения
- •6. Диены
- •6.1. Устойчивость сопряженных диенов
- •Теплоты гидрирования алкенов и диенов
- •Гибридизация атомов углерода и длины простых углерод-углеродных связей
- •6.2. Химические свойства
- •6.2.1. Электрофильное присоединение
- •6.2.3. Диеновый синтез. Реакция Дильса-Альдера
- •6.2.4. Полимеризация
- •6.3. Способы получения
- •7. Арены
- •7.1. Сравнение свойств бензола со свойствами алкенов
- •Сравнение химических свойств циклогексена и бензола
- •7.2. Теплота гидрирования. Энергия резонанса
- •7.3. Строение бензола
- •7.4. Ароматичность
- •7.5. Физические свойства
- •Физические свойства аренов
- •7.6. Химические свойства
- •7.6.1. Электрофильное замещение
- •7.6.1.1. Нитрование
- •Превращения -комплекса
- •1.6.1.2. Галогенирование
- •7.6.1.3. Сульфирование
- •7.6.1.3. Алкилирование по Фриделю-Крафтсу
- •7.6.1.4. Ацилирование
- •7.6.1.5. Хлорметилирование
- •7.6.1.6. Формилирование
- •7.6.2. Свободнорадикальное замещение в боковой цепи аренов
- •7.6.3. Реакции окисления
- •7.7. Методы синтеза
- •8. Электрофильное замещение в производных
- •8.1. Влияние заместителей на реакционную способность
- •8.2. Механизм ориентации - влияние заместителей на выбор
- •Классификация заместителей. Электронные эффекты
- •9. Многоядерные ароматические соединения
- •9.1. Нафталин
- •9.1.1. Строение нафталина
- •9.1.2. Химические свойства
- •9.1.2.1. Реакции электрофильного замещения
- •9.1.2.2. Ориентация в реакциях электрофильного замещения
- •9.1.2.3. Восстановление и окисление нафталина
- •9.2. Антрацен и фенантрен
- •10. Гетероциклические соединения
- •10.1. Пятичленные гетероциклы
- •10.1.1. Строение
- •10.1.2. Химические свойства
- •10.1.3. Способы получения
- •10.2. Пиридин
- •10.2.1. Строение пиридина
- •10.2.2. Химические свойства
- •10.3. Хинолин
- •11. Галогеналканы
- •11.1. Нуклеофильное замещение
- •Реакции нуклеофильного замещения
- •11.1.1. Бимолекулярное нуклеофильное замещение
- •Бимолекулярного нуклеофильного замещения, sn2 - процесс согласованный одностадийный:
- •11.1.2. Мономолекулярное нуклеофильное замещение
- •Мономолекулярного нуклеофильного замещения. Sn1-двухстадийный процесс
- •Мономолекулярного нуклеофильного замещения
- •11.1.3. Сравнение реакций sn 1 и sn 2
- •Влияние условий реакции на относительное значение двух механизмов
- •11.1.4. Амбидентные ионы
- •11.2. Реакции отщепления (элиминирование)
- •11.2.1. Бимолекулярное отщепление е2
- •Состав продуктов е2-реакции 2-замещенных пентанов (под действием c2h5oөk)
- •Состав продуктов реакции трет-пентилбромида с алкоголятами калия roөk (70-75о с)
- •5.2.2. Мономолекулярное отщепление е1
- •11.2.3. Сравнение реакций нуклеофильного замещения и элиминирования
- •12.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола. Отщепление – присоединение
- •12.3. Бимолекулярное нуклеофильное замещение путем
- •12.4. Ориентация при нуклеофильном замещении
- •13. Магнийорганические соединения
- •13.1. Получение и строение магнийорганических соединений
- •13.2. Синтез спиртов и кислот
- •Оглавление
- •Углеводороды. Галогенпроизводные углеводородов
- •150023, Ярославль, Московский пр., 88
- •150000, Ярославль, ул. Советская, 14а
- •И.С. Колпащикова, е.Р.Кофанов, е.М.Алов
- •Углеводороды.
- •Галогенпроизводные углеводородов
Гидрогалогенирование
Алкины реагируют с галогеноводородами (хлороводородом, бромоводородом) подобно алкенам. Присоединение происходит в две стадии, по правилу Марковникова.
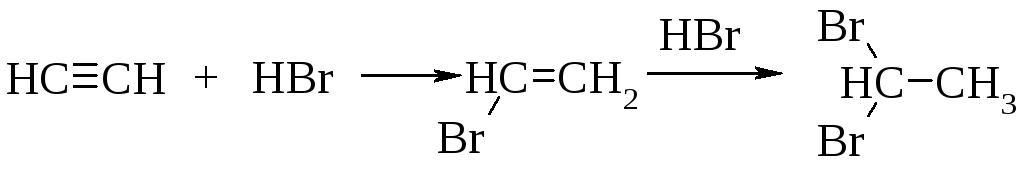
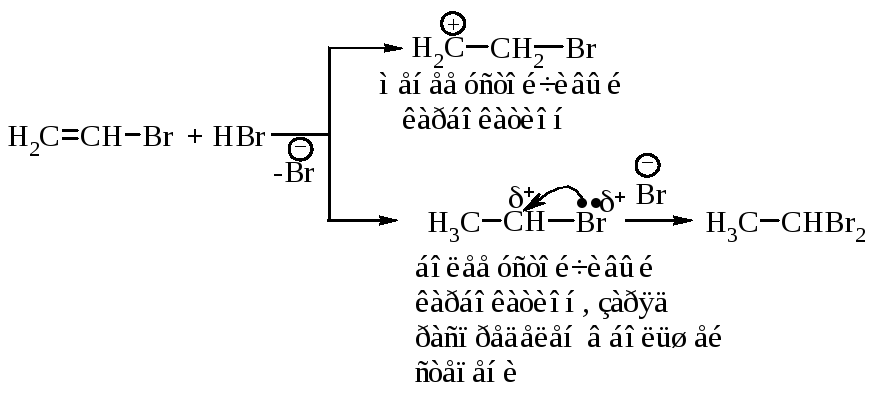
Механизм реакции. Образующийся в первой быстрой стадии -комплекс во второй медленной стадии превращается в -комплекс - карбокатион.

В третьей стадии происходит стабилизация карбокатиона – взаимодействие с анионом брома.

Взаимодействие бромалкена со второй молекулой бромоводорода происходит также по правилу Марковникова.
Гидратация
Присоединение воды к алкинам протекает в присутствии серной кислоты и солей двухвалентной ртути (реакция Кучерова).
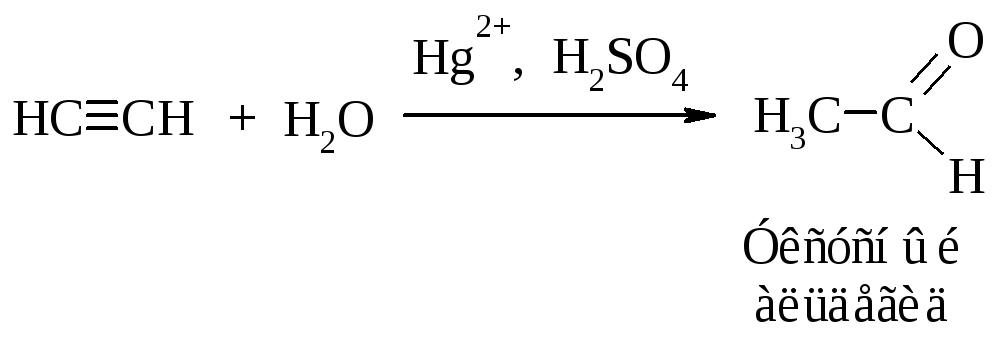
Гидратация гомологов ацетилена происходит в соответствии с правилом Марковникова.

Ионы ртути образуют с молекулами алкинов -комплексы, которые увеличивают растворимость алкинов в воде. Присоединение протона к алкину является стадией, определяющей скорость реакции. При этом разрывается -связь, и образуется ненасыщенный спирт с группировкой, содержащей при углероде в sp2 -состоянии группу -ОН (енол).
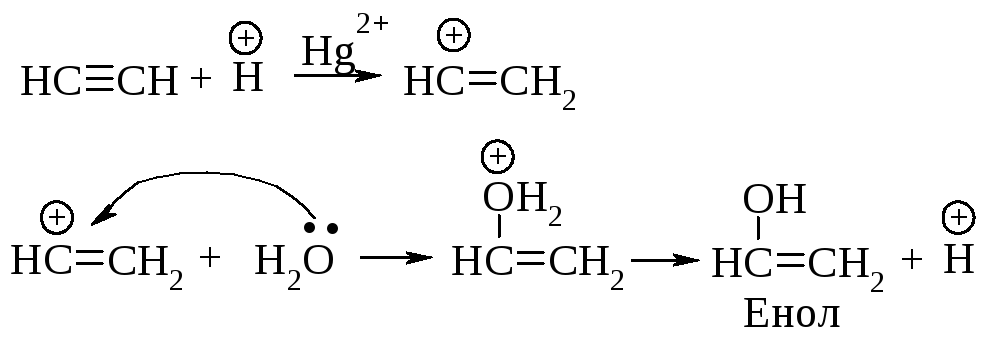
Енолы обычно неустойчивы и быстро превращаются в карбонильные соединения. В случае этенола, образующегося из ацетилена, конечным продуктом является ацетальдегид, из енолов, получающихся из других алкинов, образуются кетоны.
Механизм превращения енола I в альдегид состоит в следующем: протон присоединяется к углероду при двойной связи с образованием карбокатиона II, стабилизация которого происходит за счёт отрыва протона от кислорода с образованием уксусного альдегида.

Перегруппировка енола в альдегид является примером превращения более сильной кислоты в более слабую. Протон легко отщепляется от кислорода енола I. Обратная реакция – отщепление протона от атома углерода с образованием енола I происходит очень трудно.

Равновесие между енолом и карбонилсодержащим соединением представляет собой прототропное равновесие, т.е. равновесие между структурами, которые отличаются положением водорода и кратной связи. Этот тип превращений называют также кето-енольной таутомерией (динамическая изомерия).
Каталитическая гидратация алкинов протекает легче, чем гидратация алкенов. Примером селективной гидратации тройной связи в присутствии двойной связи может служить реакция превращения винилацетилена в метилвинилкетон.
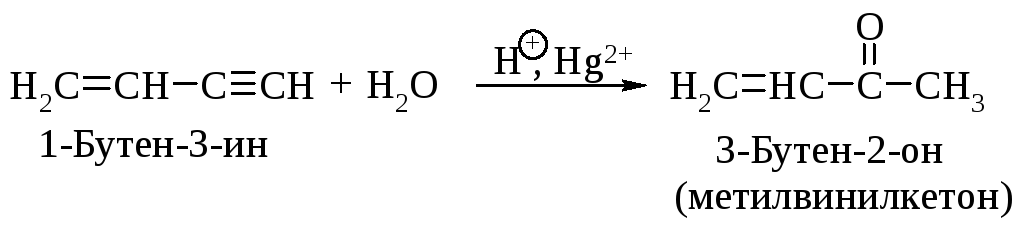
Гидроборирование
Другой способ присоединения элементов воды (Н и ОН) состоит в реакции присоединения борана по тройной связи с последующим окислением триалкенилборана пероксидом водорода в щелочной среде.
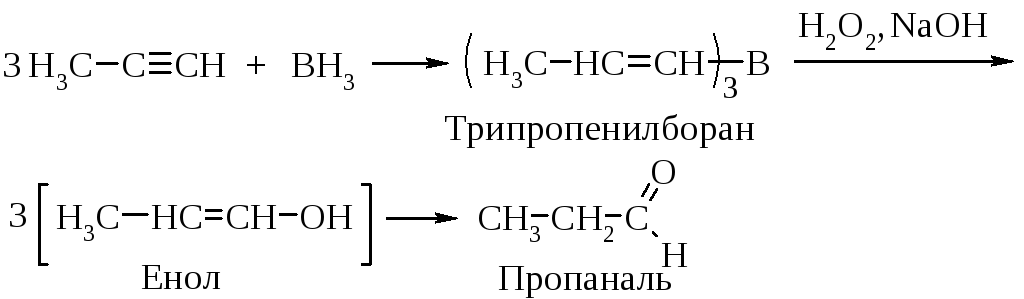
Образовавшийся виниловый спирт изомеризуется в более устойчивый альдегид (если алкин имеет концевую тройную связь) или кетон.
Присоединение карбоновых кислот
Присоединение карбоновых кислот к алкинам катализируется солями ртути и приводит к винилацетатам.

Гомологи ацетилена с концевой тройной связью реагируют с кислотами в соответствии с правилом Марковникова.
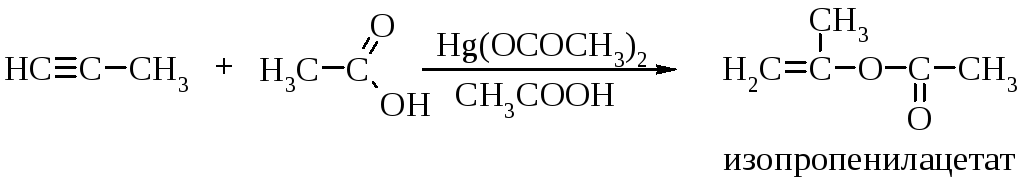
5.3.1.3. Нуклеофильное присоединение
В алкинах sp-гибридизованный атом углерода обладает более высокой электроотрицательностью, чем sp2-гибридизованный атом в алкенах и sp3-гибридизованный атом в алканах. Вместе с тем положительно заряженные ядра атомов углерода алкинов с внешней стороны экранированы в меньшей степени. Поэтому алкины вступают в реакции нуклеофильного присоединения AdN, на стадии определяющей скорость реакции, происходит присоединение нуклеофила.
Присоединение спиртов (реакция Фаворского)
Примером реакции нуклеофильного присоединения AdN является присоединение спиртов к алкинам в присутствии твердых щелочей.
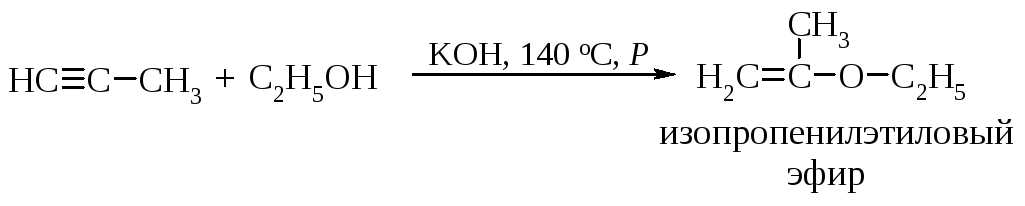
Механизм реакции
Образование нуклеофила в реакции между спиртом и щелочью.
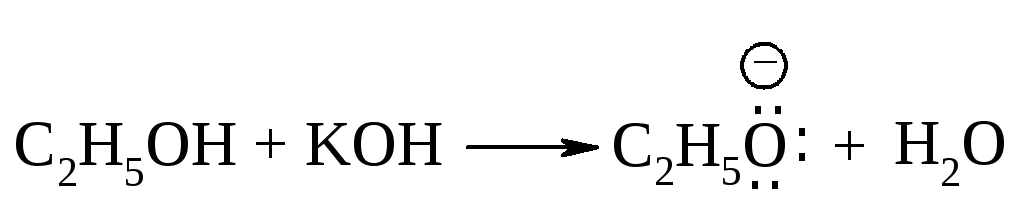
Первая стадия (медленная): нуклеофильное присоединение нуклеофила С2H5OӨ к алкину.

Вторая стадия (быстрая): стабилизация карбаниона путём отрыва протона от молекулы спирта, при этом регенерируется алкоксид-анион.
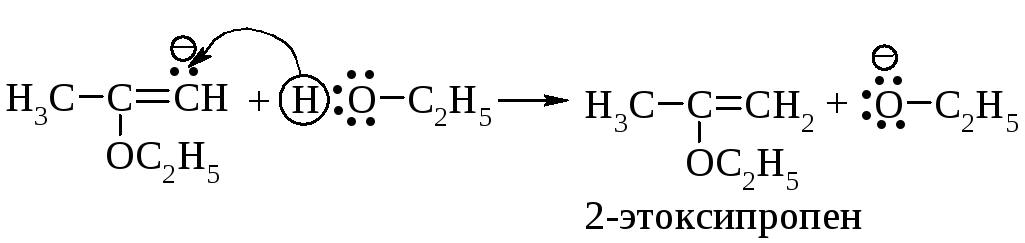
Синильная кислота так же присоединяется к ацетилену с образованием акрилонитрила. Реакция протекает в присутствии солей одновалентной меди. Стадией, лимитирующей скорость этой реакции, является нуклеофильное присоединение цианид-иона к тройной связи.